PEG胁迫下偏关苜蓿ProDH基因表达与活性分析
2018-03-12贾蓉庞妙甜原慧熊乙董宽虎朱慧森
贾蓉,庞妙甜,原慧,熊乙,董宽虎,朱慧森
(山西农业大学 动物科技学院,山西 太谷 030801)
植物受到干旱、高盐、低温、重金属胁迫时,会直接或间接的发生水分胁迫,为了缓解逆境对植物细胞造成的伤害,植物体内会积累大量的脯氨酸、可溶性糖和甜菜碱等一系列渗透调节物质[1]。脯氨酸(Proline)作为在生物体内广泛存在的一种渗透调节物质,有助于保持细胞或组织的持水能力,有效缓解水分胁迫对植物细胞造成的损伤[2],起到稳定蛋白质分子和核酸的作用[3]。在胁迫缓解之后,脯氨酸降解产生的能量可以快速补充植物对碳、氮和能量的需求[4]。植株体内脯氨酸的合成途径有两种,即谷氨酸途径和鸟氨酸途径[5]。脯氨酸的降解代谢途径在脯氨酸运转蛋白(ProT)的协助下将脯氨酸从细胞质运输到线粒体开始,随后被脯氨酸脱氢酶(proline dehydrogenase,ProDH)和P5C脱氢酶催化形成谷氨酸[6],ProDH是此过程的关键限速酶。
目前在很多植物中已经克隆出了ProDH基因[7~12],研究最深入的是模式植物拟南芥,已发现2种脯氨酸脱氢酶基因,分别是ProDH1和ProDH2,且2个基因是共表达的,只是在基因表达上表现出不同的趋势[9]。同样烟草也有2个ProDH基因,却没有发现共表达现象[11]。ProDH基因在不同物种上有不同的表达模式[13]。目前为止,关于苜蓿中ProDH基因的报道较少,有待进一步研究。
偏关苜蓿(MedicagoSativacv. Pianguan)1993年由山西省农科院畜牧研究所和偏关县畜牧局整理申报登记,此品种是黄土高原地区近几年发现的优良地方苜蓿品种,具有产量高、抗旱、耐寒、营养价值高等优点[14],近年来,对苜蓿抗旱性的研究已经成为了牧草学研究方向的热点,并逐渐从形态学发展到生理生化及分子生物学等更微观的领域[15]。研究偏关苜蓿在PEG胁迫条件下ProDH活性及基因的表达模式,对于揭示其在干旱条件下脯氨酸的积累机制,培育地方抗旱新种质资源提供科学参考。
1 材料与方法
1.1 试验材料
参照Djilianov[16]等的研究,使用含20% PEG的Hoagland 营养液胁迫生长四周的偏关苜蓿幼苗,分别胁迫处理0 h、24 h、48 h、72 h后,使用无菌水反复冲洗,置于灭菌的滤纸上将水分吸干,采集植物的叶片[7]分装至1.5 mL离心管中,液氮中快速冷冻,-80 ℃保存,用于后期检测。
1.2 试验试剂
PrimeScriptTMRT reagent Kit with gDNA Eraser、DNA marker、SYBR© Premix Ex TaqTMⅡ(Tli RNaseH Plus)均购自宝生物工程(大连)有限公司,琼脂糖购自Invitrogen,氯仿、异丙醇、乙醇等试剂均为国产分析纯。
1.3 试验方法
1.3.1 脯氨酸含量测定
参照赵福庚等[17](2002)的方法测定偏关苜蓿在PEG胁迫不同时间点的脯氨酸含量。
1.3.2 脯氨酸脱氢酶活性测定
参照赵福庚等[17](2002)的方法测定偏关苜蓿PEG胁迫不同时间点的ProDH活性。
1.3.3 偏关苜蓿ProDH基因表达量测定
采用传统Trizol方法提取偏关苜蓿Total RNA[18]。使用Quawell Q500核酸蛋白检测仪测定RNA浓度及OD260/280值,通过琼脂糖凝胶电泳检测提取得到的Total RNA的质量,参照 PrimeScriptTMRT reagent Kit with gDNA Eraser说明书去除基因组DNA反转录成cDNA。
根据已报道豆科牧草蒺藜苜蓿CDS区序列[19],采用Primer5.0软件设计引物(表1)。

表1 引物序列Table 1 Sequence of primers
(1)qRT-PCR反应体系:

cDNA2μLPCRForwardPrimer0.8μLPCRReversePrimer 0.8μLROXReferenceDye0.4μLSYBRPremixEixTaqTMII10μLdH2O6μLTotal20μL
以10倍稀释的cDNA为模版,根据SYBR®Premix Ex TaqTMⅡ(Tli RNaseH Plus)说明书,使用ABI PRISM 7500 Real-time PCR System(ABI,USA),按照下列体系和反应条件采用qRT-PCR分析方法测定ProDH基因的相对表达量。
(2)反应条件:
采用95 ℃预变性30 s,95 ℃变性5 s,60 ℃退火延伸34 s,40个循环,再经过95 ℃ 15 s,60 ℃ 1 min,95 ℃ 30 s,60 ℃ 15 s进行熔解曲线分析。
1.3.4 数据处理
本次试验采用ΔΔCt法进行qRT-PCR数据的处理,即在内参基因和目的基因扩增效率相同的情况下,目的基因的含量=2-ΔΔCt,其中,ΔΔCt=(CtTarget-CtActin)处理组-(CtTarget-CtActin)对照组,2-ΔΔCt表示试验组目的基因的表达相对于对照组的变化倍数。本试验数据采用Excel 2003和SAS9.3统计分析软件进行方差分析,所有数据均采用Mean±SE的形式,P<0.05表示数据差异性显著。所有试验均经过至少3次独立试验。
2 结果与分析
2.1 PEG胁迫对偏关苜蓿脯氨酸含量的影响
如图1所示,随着胁迫时间的延长脯氨酸含量逐渐增加,各处理组间差异均显著(P<0.05),并在胁迫72 h时含量达到最高,为392.2 μg·g-1。

图1 PEG胁迫对脯氨酸含量的影响Fig.1 Proline content under PEG stress 注: 数据采用Mean±SE的形式,肩标不同小写字母(a、b、c、d)表示各组之间差异显著(P﹤0.05),下同。Note: Data were expressed as Mean±SEM. Data with different letters (a, b, c, d) indicated that the group was significant different from other groups (P<0.05), the same as follow.
2.2 PEG胁迫对偏关苜蓿ProDH活性的影响
图2显示了偏关苜蓿在PEG不同时间胁迫处理下植株中ProDH活性的变化。如图所示,植株在干旱胁迫0 h、24 h、48 h和72 h下ProDH的活性发生明显变化,随着胁迫时间的延长ProDH的活性逐渐降低,各处理组间差异均显著(P<0.05),在胁迫72 h后活性达到最低,降到21.35 U·mg-1FW。

图2 PEG胁迫对ProDH活性的影响Fig.2 ProDH activity under PEG stress
2.3 偏关苜蓿Total RNA纯度检测
提取偏关苜蓿植株总RNA,经1%凝胶电泳检测结果显示清晰的28sRNA、18sRNA 和5sRNA条带(图3),且28sRNA、18sRNA亮度比为2∶1,说明RNA完整;经Quawell Q5000 核酸蛋白检测仪检测OD260/280 值均在1.8~2.0之间,表明RNA 无降解、无明显的酚类或者蛋白质的污染,可用于后续试验。
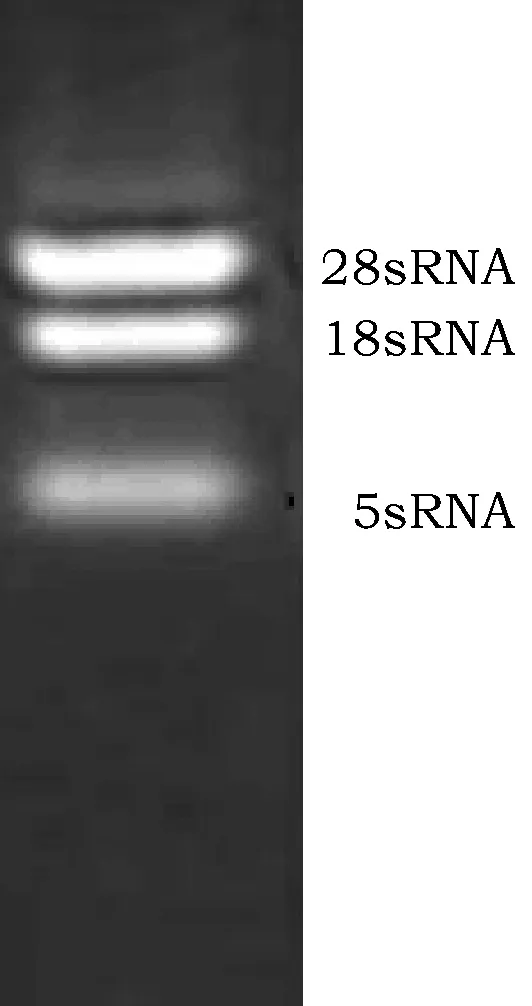
图3 偏关苜蓿总RNA凝胶电泳Fig.3 Agarose gel electrophoresis validation of RNA from Medicago sativa cv.Pianguan
2.4 荧光定量PCR反应条件的确定
样品进行实时定量扩增后,得到一条反应核酸扩增过程的S形荧光定量动力学曲线,循环阈值位于PCR产物消除荧光背景后进入指数增长期的始点。图4和5显示,溶解曲线为单峰,且扩增曲线的基线平整,拐点清楚即指数区较明显,扩增曲线整体平行性好。

图4 内参实时扩增曲线图及产物Fig.4 Amplification and dissociation plots of reference gene

图5 目的基因实时扩增曲线图及产物溶解曲线图Fig.5 Amplification and dissociation plots of target gene
2.5 ProDH基因在PEG干旱胁迫下的表达
用20% PEG对偏关苜蓿进行不同时间的胁迫处理,通过qRT-PCR分析在不同时间的ProDH基因的相对表达量。如图6所示,随着胁迫时间的延长偏关苜蓿ProDH基因的相对表达量逐渐增加,与处理0 h相比,处理24 h、48 h和72 h下ProDH基因的相对表达量显著增加(P<0.05),且与时间呈正相关。各处理组间,ProDH基因的相对表达量均有显著性差异(P<0.05)。
3 讨论与结论
植物在干旱等非生物胁迫下,脯氨酸的积累是对逆境胁迫下的一种适应性应答,积累过程是合成与降解两个过程共同作用的结果,脯氨酸的合成主要有谷氨酸和鸟氨酸两种途径。王丽媛[20]的研究认为在植物受到逆境胁迫时,脯氨酸的主要合成途径是谷氨酸合成途径,而脯氨酸的降解主要受到ProDH调控,ProDH造成脯氨酸含量下降,加剧植物细胞干旱胁迫伤害。本研究对偏关苜蓿受到干旱胁迫时脯氨酸含量、ProDH的酶活力及其基因表达量进行了分析,发现随着胁迫时间的延长脯氨酸的含量逐渐升高,ProDH活力逐渐降低,这一趋势与理论结果相同。但是对ProDH基因表达量测定发现随着胁迫时间的延长,基因表达量上升,且明显高于对照组,这与ProDH的活性趋势并不一致。
Ribarits等[11]和Funck等[12]在拟南芥和烟草中均克隆到了2个有功能的ProDH基因,通过对拟南芥、烟草等植物进行胁迫处理发现ProDH基因的表达模式和调控模式不相同,表明了不同物种间脯氨酸的合成和降解代谢途径不尽相同,具有明显的种间特异性和组织特异性。同样,魏丽娟等[21]的研究结果也显示ProDH基因表达模式与植株ProDH活性结果不一致,得出该基因的酶活性受到转录和翻译水平的双重调控的结论。因此推测偏关苜蓿中极有可能存在多个ProDH基因,并且受到了转录和翻译双重调控,对这一现象仍需通过进一步试验进行验证。在不同的植物物种中,ProDH的调控方式存在着很大差异, 因此研究不同物种ProDH的特性,才能揭示该酶在本物种抗逆和生长发育中发挥的作用。
qRT-PCR通过检测PCR产物中荧光信号强度来定量PCR的产物,具有精确度高、操作简单、效率高等优点[22]。本试验以偏关苜蓿叶片总RNA反转录得到的cDNA为模版,以β-actin为内参,鉴定了ProDH在PEG干旱胁迫处理下的表达情况,为ProDH基因在苜蓿中的表达调控研究积累了资料。
[1]焦蓉,刘好宝,刘贯山,等.论脯氨酸累积与植物抗渗透胁迫[J].中国农学通报,2011,27(7):216-221.
[2]张娜,黄韫宇,冯洁,等.甘蓝脯氨酸脱氢酶基因克隆与RNAi表达载体构建[J].中国农业大学学报,2011,16(3):87-94.
[3]Verbruggen N,Hermans C.Proline accumulation in plants:a review [J].Amino Acids,2008,35(4):753-759.
[4]Hare P D,Cress W A.Metabolic implications of stress-induced proline accumulation in plants[J].Plant Growth Regulation,1997,21(2):79-102.
[5]Delauney A J,Hu C A,Kishor P B,et al.Cloning of ornithine delta-aminotransferase cDNA from Vigna aconitifolia by trans-complementation in Escherichia coli and regulation of proline biosynthesis[J].Journal of Biological Chemistry,1993,268(25):18673-18678.
[6]朱慧森,刘艳香,董宽虎,等.PEG胁迫对偏关苜蓿脯氨酸代谢途径关键酶的影响[J].草地学报,2011,19(6):1000-1004,1024.
[7]Kiyosue T,Yoshiba Y,Yamaguchishinozaki K,et al.A nuclear gene encoding mitochondrial proline dehydrogenase,an enzyme involved in proline metabolism,is upregulated by proline but downregulated by dehydration inArabidopsis[J].The Plant Cell,1996,8(8):1323-1335.
[8]Nakashima K,Satoh R,Kiyosue T,et al.A gene encoding proline dehydrogenase is not only induced by proline and hypoosmolarity, but is also developmentally regulated in the reproductive organs ofArabidopsis[J].Plant Physiology,1998,118(4):1233-1241.
[9]Deuschle K,Funck D,Forlani G,et al.The role of Δ1-pyrroline-5-carboxylate dehydrogenase in proline degradation[J].Plant Cell,2004,16(12):3413-3425.
[10]Miller G,Stein H,Honig A,et al.Responsive modes ofMedicagosativaproline dehydrogenase genes during salt stress and recovery dictate free proline accumulation[J].Planta,2005,222(1):70-79.
[11]Ribarits A,Abdullaev A,Tashpulatov A,et al.Two tobacco proline dehydrogenases are differentially regulated and play a role in early plant development[J].Planta,2007,225(5):1313-1324.
[12]Funck D,Eckard S,Muller G,et al.Non-redundant functions of two proline dehydrogenase isoforms inArabidopsis[J].BMC Plant Biology,2010,10(1):70.
[13]Rayapati P J,Stewart C R,Hack E,et al.Pyrroline-5-Carboxylate Reductase Is in Pea (PisumsativumL.) Leaf Chloroplasts[J].Plant Physiology,1989,91(2):581-586.
[14]庞妙甜.PEG胁迫对苜蓿种子萌发及幼苗脯氨酸代谢关键酶活性的影响[D].太谷:山西农业大学,2016.
[15]Mattioli R,Falasca G,Sabatini S,et al.The proline biosynthetic genesP5CS1 andP5CS2 play overlapping roles inArabidopsisflower transition but not in embryo development[J].Physiologia Plantarum,2009,137(1):72-85.
[16]Djilianov D,Dragiiska R,Yordanova R,et al.Physiological changes in osmotic ally stressed detached leaves of alfalfa genotypes selected in vitro[J].Plant Science,1997,129(2):147-156.
[17]赵福庚,刘友良,章文华.大麦幼苗叶片脯氨酸代谢及其与耐盐性的关系[J].南京农业大学学报,2002,25(2):6-10.
[18]熊军波.紫花苜蓿响应盐胁迫的蛋白质组研究[D].北京:中国农业科学院,2011.
[19]杨国锋,苏昆龙,赵怡然,等.蒺藜苜蓿叶绿体密码子偏好性分析[J].草业学报,2015,24(12):171-179.
[20]王丽媛,丁国华,黎莉.脯氨酸代谢的研究进展[J].哈尔滨师范大学自然科学学报,2010,26(2):84-89.
[21]魏丽娟,张娟,王蕾,等.南蛇藤脯氨酸脱氢酶基因的克隆和表达特性[J].植物学报,2014,49(6):682-691.
[22]魏春花,曾文炉,周启星,等.荧光定量PCR技术在环境领域的应用[J].中国环境监测,2012,28(4):48-53.
