杜氏盐藻电击转化体系的优化
2018-03-12宋程飞郝敬云程蔚兰史飞飞季春丽李润植
宋程飞,郝敬云,程蔚兰,史飞飞,季春丽,李润植
(山西农业大学 分子农业与生物能源研究所,山西 太谷 030801)
杜氏盐藻(Dunaliellasalina)是一种光自养的单细胞真核绿藻,细胞没有纤维质细胞壁,在高盐(NaCl浓度>30%)环境下能够正常生长。一些盐藻株系能高水平合成β-胡萝卜素(>10%细胞干重)和油脂(40%~50%细胞干重),是生产天然β-胡萝卜素和优质生物燃料的良好原料[1,2]。杜氏盐藻细胞结构简单、易于建立规模培养体系对盐碱地进行改良和利用。特别是盐藻能在高盐环境下正常生长,大规模养殖不易发生病虫等污染,这使得盐藻成为一种进行目标化合物生物合成途径基因修饰的理想生物种质材料,进而以遗传改造的盐藻工程株系为平台商业化生产高附加值天然产品[3,4]。
目前, 已有采用基因枪法[5,6]、玻璃珠法[7,8]、超声波法[9]转化盐藻获得成功的报道,这些转化方法存在操作繁杂和成本高、转化效率低且不稳定等缺陷。Brown等[10]使用电击法对微藻进行遗传转化,不仅成本低而且操作起来简单快捷,易于建立标准的转化程序。耿德贵等[11~13]和孙煜等[14]也报道了使用电击法成功转化杜氏盐藻的相关内容。迄今为止,有关盐藻遗传转化试验多是将GUS、GFP等报告基因导入细胞中。冯书营等[8]使用玻璃珠转化法,成功地将GUS报告基因转化进入盐藻细胞中。耿德贵等[12]使用电击法转化盐藻细胞,瞬时表达了GUS和GFP报告基因。然而,鲜有报道应用目标功能基因对杜氏盐藻遗传转化,已有的盐藻转化方法难以重复获得稳定转化株系。
为此,本研究在系统分析杜氏盐藻生长和发育特性的基础上,以植物表达载体pCAMBIA3301为骨架,构建高效表达来自富油植物斑鸠菊(Vernoniagalamensis)VgDGAT1a基因(编码控制TAG合成的关键酶DGAT)的载体,以抗除草剂草铵膦Bar基因为选择标记,对盐藻进行电转化并优化了各项技术参数,以期获得高效简便的盐藻遗传转化体系,为进一步对盐藻进行代谢组装,培育富集目标化合物的优异盐藻工程株系和实现高值微藻产品商业化生产提供理论及技术支撑。
1 材料与方法
1.1 材料
试验所用藻种为杜氏盐藻 (Dunaliellasalina),是由本实验室在运城盐湖所取水样中分离纯化所得,命名为YC-011。所用培养基为DM培养基(表1)。用于遗传转化的表达载体VgDGAT1a-pCAMBIA3301(图1)载有除草剂草铵膦抗性基因Bar和外源目的基因VgDGAT1a,它编码控制TAG合成的一个关键酶即DGAT1。
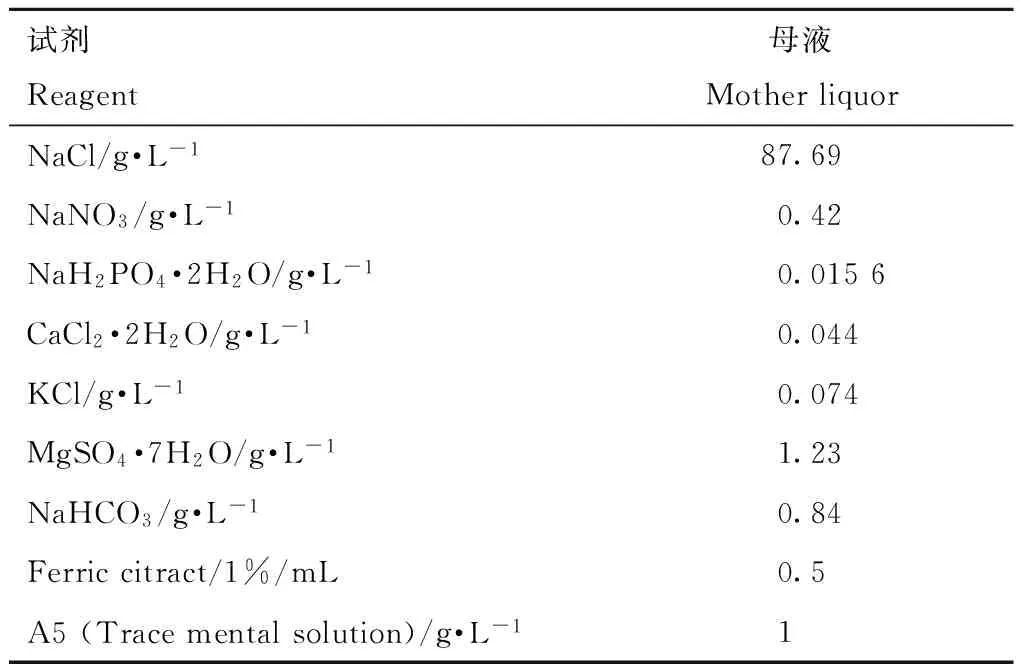
表1 DM培养基(母液)配方
注:其中A5 (Trace mental solution)的组成成分如下:H3BO32.86 g·L-1, MnCl2·4H2O 1.86 g·L-1,ZnSO4·7H2O 0.22 g·L-1, Na2MoO4·2H2O 0.39 g·L-1, CuSO4·5 H2O 0.08 g·L-1, Co(NO3)2·6 H2O 0.05 g·L-1。
Note: The composition of A5(Trace mental solution) is as follows: H3BO32.86 g·L-1, MnCl2·4H2O 1.86 g·L-1,ZnSO4·7H2O 0.22 g·L-1, Na2MoO4·2H2O 0.39 g·L-1, CuSO4·5 H2O 0.08 g·L-1, Co(NO3)2·6 H2O 0.05 g·L-1.

图1 用于盐藻转化的超表达VgDGAT1a基因载体图谱简示Fig.1 Schematic diagram showing VgDGAT1a overexpression vector used for Dunaliella salina transformation
1.2 方法
1.2.1 杜氏盐藻生长曲线的绘制
取生长至对数期的盐藻培养液,按体积比1∶10的接种量进行接种,在温度(24士0.5) ℃、光强3 000 Lux,光暗比16 h∶8 h的条件下培养。每天上午9时,对培养液的吸光度值进行测定,3次重复,取平均值作为当天的测试结果。然后绘制生长曲线,横坐标为培养时间,纵坐标为吸光度值。
1.2.2 盐藻对除草剂草铵膦的敏感性试验
(1)液体培养筛选
取培养至第7天的盐藻细胞,取适量草铵膦加入培养基中,终浓度梯度设置为0、10、20、30、40、50 mg·L-1等,每个梯度6次重复,培养条件同1.2.1。
每天上午9点和下午4点对藻细胞的形态各进行一次观察和记录。培养至对数期时,通过稀释平板计数法进行细胞计数,分别计算各筛选浓度下藻细胞的致死率。
(2)固体培养筛选
配置含草铵膦(PPT)的固体筛选培养基,草铵膦浓度梯度分别为0、5、10、15、20 mg·L-1。取100 μL对数期的盐藻细胞,均匀涂布于DM固体筛选培养基上。每个梯度设置6组重复。培养条件同1.2.1,培养24 h后,将平板倒置。随后每天上午9点和下午4点,各进行一次观察,并记录藻落数量和生长变化。
1.2.3 盐藻电击转化体系的建立及优化
(1)试验材料
取培养至第7天的藻细胞,4 500 r·min-1离心5 min,弃上清。用新鲜培养基对收集的细胞冲洗一次,再次离心,收集盐藻细胞于离心管底部。加2×HEPES[11]电击缓冲液(HEPES 0.04 mol·L-1、NaCl 1 mol·L-1、KCl 0.01 mol·L-1、CaCl20.01 mol·L-1、甘露醇0.4 mol·L-1、山梨醇0.4 mol·L-1)调整藻液浓度至1×106个·mL-1。取400 μL藻液转移至1.5 mL EP管中,冰浴5~10 min后用于下一步电转化。依次确定最佳脉冲时间、脉冲电压、质粒浓度和藻细胞培养时间内。
(2)电击转化盐藻细胞
将冰浴的质粒和藻细胞混合液移至经预冷处理的0.2 cm电击杯中,参照李海东等[15]的方法,依据设置好的脉冲电压、脉冲时间、质粒浓度和藻细胞培养天数等梯度参数,进行电击转化,每个参数分别重复6次。
(3)转化细胞的培养
将转化的盐藻细胞立即冰浴5 min后,从电击杯移至1.5 mL EP管中。6 000 r·min-1离心3 min,倒掉上清液。向离心管底部细胞沉淀加1 mL 培养基,用移液枪反复吹打均匀。避光静置过夜培养,使藻细胞恢复生长。在显微镜下,统计完整细胞数和总细胞数(完整细胞数+破碎细胞数)。两者数目之比值即为细胞存活率。
(4)筛选阳性转化藻细胞
常温下,收集经过电击转化的盐藻细胞。6 000 r·min-1离心5 min后,弃上清。加入60 μL培养基,重悬沉淀于离心管底部的藻细胞。取重悬浮的藻细胞涂布于DM固体筛选(含20 mg·L-1草铵膦)培养基,并设对照。培养至不再有新藻落长出且藻落数基本稳定,在第18天时,进行单藻落计数。筛选和非筛选培养基上的藻落数目比值即为电击转化盐藻的转化效率/%。
(5)盐藻细胞电击转化体系的优化
转化过程中,设置不同的脉冲电压、脉冲时间、藻细胞培养时间、质粒浓度,对转化后细胞存活率和转化效率进行比较。
1.2.4 草铵膦抗性转化藻株的分子鉴定
取1×109个杜氏盐藻转化子细胞,用CTAB法提取基因组DNA[15]。用Trizol法提取总RNA[15],反转录获得cDNA。分别以DNA和cDNA为模板,进行PCR扩增,分子鉴定转基因的整合和表达。
用于扩增目的基因的引物序列为:
F(forward): GCTCTAGAGCCATGGCGT
TATTAGATACG
R (reverse): TCCCCCGGGGGATTATTTGC TTTTCCCCTTTT
VgDGAT1a基因的PCR反应程序:

扩增完成后,进行1%的琼脂糖凝胶电泳,检测PCR结果。
2 结果与分析
2.1 绘制盐藻生长曲线
每天在同一时间点取杜氏盐藻培养液,在最佳波长下进行吸光度的测定,设置3组平行重复。在绘制生长曲线时,以培养时间作为横坐标、OD684值作为纵坐标,如图2所示。可见,盐藻细胞生长呈“S”型,生长至第7天时,盐藻细胞进入对数生长期。

图2 杜氏盐藻的生长曲线Fig.2 The growth curve of Dunaliella salina
2.2 筛选阳性转化子的最适草铵膦浓度
2.2.1 液体培养筛选所用草铵膦浓度的确定
液体筛选培养基培养藻细胞至对数期时,各筛选浓度下藻细胞的致死率如表2。可见,随着草铵膦浓度的增加,细胞死亡率增大;至40 mg·L-1时细胞致死率为100%。
表2不同剂量草铵膦液体培养中盐藻在第7天的死亡率
Table 2 The lethal rate ofDunaliellasalinaon day 7 in the liquid medium with different dose of glufosinate-ammonium

浓度/mg·L-1Concentration死亡率/%Lethalrate00e1016.2±0.022d2037.9±0.035c3072.6±0.045b40100a50100a
注: 表中小写字母表示处理间存在显著性差异(P<0.05)。
Note: small letters indicate that the differences between treatments are significant atP<0.05.
由图3可见,低浓度草铵膦(10 mg·L-1)就造成部分藻细胞解体,细胞内容物流出,藻细胞完全致死的草铵膦浓度为40 mg·L-1。因此,液体培养基中的筛选浓度选择40 mg·L-1。
2.2.2 固体培养筛选所用草铵膦浓度的确定
固体筛选培养基培养藻细胞,各筛选浓度下藻细胞长出的时间及其生长状态和数量如表3。
由表3可见,生长至第4天时,对照组有嫩绿色藻落长出,长势良好,在培养基表面成片生长。草铵膦浓度为5 mg·L-1的培养基,与对照组相比,藻落长出的时间推迟5 d,藻落颜色嫩绿,生长密集。10 mg·L-1草铵膦的培养基,第13天时藻落才长出,颜色浅,数量少,均为单藻落,说明10 mg·L-1草铵膦对藻细胞有一定的抑制作用。15 mg·L-1草铵膦筛选培养基,到30 d时,仅有几个单藻落,说明此浓度草铵膦显著抑制了盐藻细胞的生长。20 mg·L-1草铵膦筛选培养基,没有藻落长出(图4),藻细胞生长完全被抑制。因此,实验确定以20 mg·L-1草铵膦浓度作为在固体培养基中筛选转基因盐藻的浓度。

图3 不同浓度草铵膦对盐藻存活的影响Fig.3 Effects of different concentration of glufosinate-ammonium on Dunaliella salina survival
Table3 The tolerance ofDunaliellasalinato glufosinate-ammonium in solid medium

浓度/mg·L-1Concentration藻落长出所需时间/dTimeneededforalgaespotformation生长状态与藻落数量Growthstatusandcellnumber04细胞鲜绿色,藻落密集成片59细胞颜色嫩绿,藻落密集成片1013细胞颜色变浅绿,藻落数较对照组减少,均是单藻落1530藻落颜色发黄,藻落数极少20--

图4 不同浓度草铵膦对盐藻生长的影响Fig.4 Effects of different doses of glufosinate-ammonium on Dunaliella salina growth
由图3和图4可知,液体培养基中转基因盐藻的筛选浓度为40 mg·L-1;而固体培养基中的筛选浓度为20 mg·L-1。造成这种差异的原因可能是:一般情况下,与液体培养条件下的藻细胞相比,固体培养条件下的藻细胞生长速度慢,生长势弱。因此,固体培养所用筛选基的筛选浓度比液体的筛选浓度低。而且,液体筛选时,藻液与培养基的接触面积相对于固体筛选更大,所以致死浓度相对更高一些。
2.3 电击法各转化参数的优化
2.3.1 电击参数对细胞存活率的影响
脉冲电压和脉冲时间对细胞存活率的影响如图5,即脉冲电压一定时,细胞存活率随着脉冲时间的增长而下降;脉冲时间一定时,细胞存活率同样随着脉冲电压增大而减小。

图5 脉冲电压和脉冲时间对杜氏盐藻细胞存活率的影响Fig.5 The effect of pulse voltage and time on cell survival rate of Dunaliella salina
2.3.2 电击参数对细胞转化效率的影响
筛选和非筛选培养基上的藻落数目比值为盐藻的转化效率(‰)。由图6得,脉冲电压和脉冲时间分别为0.4 kV和4 ms时,筛选和非筛选培养基上的藻落数目比值最高,即转化效率最高。

图6 脉冲电压和脉冲时间对杜氏盐藻细胞转化效率的影响Fig.6 The effect of pulse voltage and time on cell conversion efficiency of Dunaliella salina
2.3.3 藻细胞培养时间对转化效率的影响
取培养天数不同、生长良好的盐藻细胞即不同藻龄的细胞进行电击转化。由表4可见,在电击参数相同的情况下,随着藻细胞培养时间的增加转化效率先升后降。其中,培养7 d的盐藻细胞转化效率最高,为1.98±0.01‰。培养7 d的藻细胞,正处于对数生长期,分裂旺盛,容易吸附外源基因,导致转化效率高[16]。
表4藻细胞培养时间对转化效率的影响
Table 4 Effects of different cell culture time on transformation efficiency ofDunaliellasalina

藻细胞培养时间/dculturetime脉冲电压/kVpulsevoltage脉冲时间/mspulsetime转化效率/‰transformationefficiency10.440e30.440.02±0.01d50.440.83±0.02c70.441.98±0.01a90.441.04±0.03b
注:表中小写字母表示处理间存在显著性差异(P<0.05)。
Note: small letters indicate that the differences between treatments are significant atP<0.05.
2.3.4 质粒浓度对盐藻细胞转化效率的影响
图7显示,在最佳脉冲电压和脉冲时间下,盐藻电击转化效率表现为随着质粒浓度的增加先增后降,当质粒浓度6 mg·L-1时,转化效率最高,约为2.63‰。
经上述各项检测,确立了杜氏盐藻电转化技术的优化体系。脉冲电压和脉冲时间分别为:0.4 kV、4 ms;质粒浓度6 mg·L-1,培养7 d的盐藻细胞为受体。盐藻转化效率高达2.63‰。
2.4 草铵膦抗性转化株的分子鉴定
从固体筛选平板上随机挑取4株单藻落,将其在液体筛选培养基中扩大培养,分别提取基因组DNA、总RNA,将RNA反转录成cDNA[16]。根据VgDGAT1a基因的上下游引物,进行PCR扩增。电泳结果(图8、9)显示,分别以转基因盐藻的DNA和cDNA为模板,PCR扩增片段与阳性对照大小一致(1 584 bp)。将PCR扩增片段送到生物公司测序。测序结果显示PCR产物序列与VgDGAT1a基因序列(登陆号:EF653276)完全一致,说明盐藻VgDGAT1a基因遗传转化成功,并且表达正确。

图8 转基因盐藻VgDGAT1a DNA分子鉴定Fig.8 DNA identification of VgDGAT1a in transgenic Dunaliella salina 注:M:DNA Marker为DL2000,泳道1~4为4株转基因盐藻的DNA PCR扩增产物,泳道5为阳性对照Note: M: DNA lader 2000; lane 1~4: PCR product of transgenic Dunaliella salina; lane 5: positive control
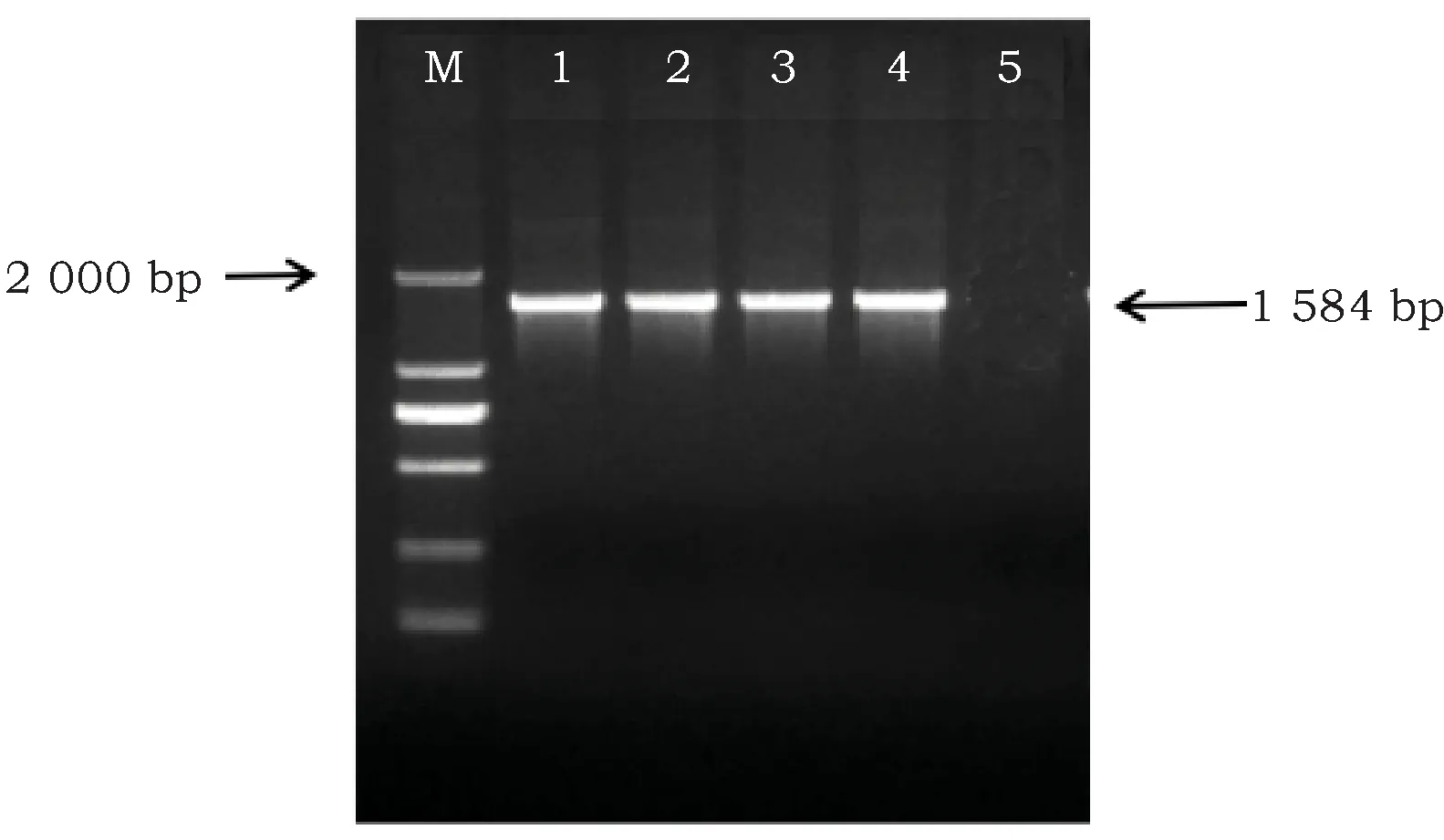
图9 转基因盐藻VgDGAT1a mRNA分子鉴定Fig.9 mRNA identification of VgDGAT1a in transgenic Dunaliella salina 注:M: Marker为DL2000;泳道1~4为转基因藻株的反转录PCR扩增产物,泳道5为阴性对照Note: M: DNAlader 2000; lane 1~4: PCR product of transgenic Dunaliella salina, lane 5: negative control
3 讨论与结论
近几年来,藻类基因工程研究以及应用微藻规模化生产高值天然化合物研发日益广为关注。一些特色经济藻类具有规模化培养简便、生长周期短、光合效率高和遗传背景较高等植物简单等特点,是进行基因修饰良好的生物种质,可通过代谢组装培育能高效合成积累高值化合物的生物反应器[17,18]。基于前人有关盐藻遗传转化的研究[19,20],本文对杜氏盐藻电转化技术进行优化,建立了高效的电击遗传转化体系。与其他转化研究应用抗生素筛选转化藻细胞不同,本文应用抗除草剂草铵膦基因为选择标记,在培养基中加入20 mg·L-1草铵膦,就可杀死非转化的藻细胞,获得阳性转化藻细胞速度快、效率高。
除使用表达载体和筛选标记外,其他影响盐藻转化效率因素包括受体藻细胞生长状态及预处理、载有目的基因的质粒浓度、脉冲电压、脉冲时间、缓冲液成分及用量,以及电击后藻细胞处理等[20,21]。本研究对这些参数进行了系统优化,转化效率显著提高(图5)。Shimogawara等[19,22]以莱茵衣藻为转基因受体,对电转化参数进行优化,转化效率提高到2×105个转化子/μg DNA。以钝顶螺旋藻为受体藻种,王高歌等[23]利用电击法进行转化,亦获得较高转化效率(电击导致细胞成活率为40%~60%)。本文通过调节电击参数(脉冲电压0.4 kV、脉冲时间4 ms)控制受体细胞存活率处于50%~70%区间,获得较高的转化率。本文建立的优化盐藻电击转化技术,以培养7 d处于对数生长期的盐藻为受体,应用6 mg·L-1载体质粒浓度,在0.4 kV电压、脉冲时间为4 ms条件下进行电转化,获得2.63‰的转化效率,比现有方法转化率提高了1.14倍。
本研究利用建立的优化电击转化方法,首次将含有目的基因VgDGAT1a的植物真核表达载体VgDGAT1a-pCAMBIA3301转化进入杜氏盐藻细胞并且成功表达。关于转VgDGAT1a基因盐藻的油脂含量提高量、表型分析及其作用机理,我们将另作报道。本研究显示,广泛用于高等植物的表达载体pCAMBIA3301和除草剂抗性基因Bar同样可以用于杜氏盐藻等微藻的遗传转化。源于高等植物的基因和表达载体DNA元件的应用, 将扩宽微藻遗传转化所需的DNA元件和目的基因来源。这极有利于应用基于基因修饰的代谢工程技术对盐藻等微藻进行目标代谢途径组装,以定向培育高效生产高值目标化合物工程微藻优异株系。本文成功将控制TAG合成的关键酶基因DGAT1导入盐藻,有望提高盐藻细胞油脂积累量。未来进一步对盐藻细胞脂肪酸合成和TAG积累途径进行精细组装,创育出光合效率高且富集优质油脂的盐藻新种质。这样的工程盐藻藻种可应用盐碱化水体进行规模化养殖,进而商业化生产优质生物燃油。这将促进盐碱地资源化高值利用新途径的创立和绿色生物能源产业链的拓展。
[1]孙协军,李秀霞,冯彦博,等.杜氏盐藻β-胡萝卜素超高压提取工艺优化[J].中国食品学报,2016,16(3):88-94.
[2]虞海天.杜氏盐藻中β-胡萝卜素的提取纯化及制备生物燃料的研究[D].呼和浩特:内蒙古大学,2014.
[3]Fisher M,Gokhman I,Pick U,et al.A structurally novel transferrin-like protein accumulates in the plasma membrane of the unicellular green alga Dunaliella salina grown in high salinities[J].Journal of biological chemistry,1997,272(3):1565-1570.
[4]尹卫强,刘颖芬,李炳乾,等.国内杜氏盐藻综合利用的现状及发展趋势[J].盐业与化工,2013,12:1-3.
[5]吕玉民,谢华,牛向丽,等.用基因枪法将bar基因导入杜氏盐藻及转基因藻株的检测[J].郑州大学学报(医学版),2004,39(1):31-35.
[6]潘卫东,袁保梅,谢华,等.杜氏盐藻叶绿体转化载体pDS16S-CAT的构建[J].郑州大学学报(医学版),2004,39(1):25-28.
[7]Jin E S,Polle J E W,Melis A.Involvement of zeaxanthin and of the Cbr protein in the repair of photosystem II from photoinhibition in the green alga Dunaliella salina[J].Biochimica et Biophysica Acta (BBA)-Bioenergetics,2001,1506(3):244-259.
[8]冯书营,贾岩龙,刘红涛,等.杜氏盐藻玻璃珠新型转化方法的建立[J].生物工程学报,2007,23(2):358-362.
[9]刘红艳,凌均棨,麦穗.转基因盐藻防龋疫苗的基础研究1—超声转化编码嵌合体SBR-CT△A1基因[J].牙体牙髓牙周病学杂志,2006,16(3):137-141.
[10]Brown L E,Sprecher S L,Keller L R.Introduction of exogenous DNA into Chlamydomonas reinhardtii by electroporation[J].Molecular and cellular biology,1991,11(4):2328-2332.
[11]Geng DG,Han Y,Wang YQ,et al.Construction of a system for the stable expression of foreign genes in Dunaliella salina[J].Acta Bot Sin,2004,46(3):342-345.
[12]耿德贵,王义琴,孙勇如,等.GUS基因在杜氏盐藻细胞中的瞬时表达[J].高技术通讯,2002,12(2):35-39.
[13]Rasala B A,Barrera D J,Ng J,et al.Expanding the spectral palette of fluorescent proteins for the green microalga Chlamydomonas reinhardtii[J].The Plant Journal,2013,74(4):545-556.
[14]Sun Y,Yang Z,Gao X,et al.Expression of foreign genes in Dunaliella by electroporation[J].Molecular biotechnology,2005,30(3):185-192.
[15]李海东,仝颜丽,郑立,等.等鞭金藻的电转化体系[J].海洋环境科学,2012,31(5):677-681.
[16]李炎,张娅楠,吕利群.草鱼肾细胞电转条件的优化及草鱼呼肠孤病毒NS26蛋白的瞬时表达[J].病毒学报,2014,30(3):278-284.
[17]Pratheesh P T,Vineetha M,Kurup G M.An efficient protocol for the Agrobacterium-mediated genetic transformation of microalga Chlamydomonas reinhardtii[J].Molecular biotechnology,2014,56(6):507-515.
[18]Ishikura K,Takaoka Y,Kato K,et al.Expression of a foreign gene in Chlamydomonas reinhardtii chloroplast[J].Journal of Bioscience and Bioengineering,1999,87(3):307.
[19]谢伟民,李合松,刘会珍,等.小球藻和莱茵衣藻原生质体的电转化研究[J].激光生物学报,2015,24(2):180-185.
[20]Anila N,Chandrashekar A,Ravishankar G A,et al.Establishment of Agrobacterium tumefaciens-mediated genetic transformation in Dunaliella bardawil[J].European Journal of phycology,2011,46(1):36-44.
[21]Nishi T,Yoshizato K,Yamashiro S,et al.High efficiency in vivo gene transfer using intraarterial plasmid DNA injection following in vivo electroporation[J].Cancer Research,1996,56(5):1050-1055.
[22] Shimogawara K,Fujiwara S,Grossman A,et al.High efficiency transformation of Chlamydomonas reinhardtii by electroporation[J].Genetics,1998,148(4):1821-1828.
[23]王高歌,茅云翔,张宝红,等.电转化法转化钝顶螺旋藻转化条件的研究[J].高技术通讯,2002(10):91-95.
