β-catenin过表达的间充质干细胞对改善海水吸入型肺损伤治疗效果的研究
2018-03-12王博荣李鹏程刘菲金发光
王博荣 李鹏程 刘菲 金发光
溺水事故常有发生,据全球统计,每年因海水淹溺导致的死亡总数达到14万人。当海水进入肺内,肺泡膜上皮屏障遭到破坏,蛋白渗出充满肺泡腔,引起肺水肿,气体交换障碍,导致呼吸衰竭,甚至死亡,这是急性呼吸窘迫综合征(acute respiratory distress syndrome, ARDS)的生理特性[1]。因此,肺泡上皮细胞的再生和修复是改善肺损伤的关键。目前除了保守对症支持治疗,ARDS患者没有有效的治疗策略。然而有研究显示,间充质干细胞移植为减少ARDS的病死率提供了一种可能途径[2]。
间充质干细胞(mesenchymal stem cells, MSCs)具有多向分化能力和免疫调节特性,已报道能够分化成肺泡上皮细胞,促进再生,减轻炎症,改善病理损伤,甚至减少急性肺损伤(acute lung injury, ALI)模型病死率[2-4]。然而,由于MSCs在ALI肺组织模型的低移植率和低分化率,导致治疗效果不佳[5-6]。因此,阐明MSCs在上皮的修复功能,使干细胞在受损肺组织得以定殖,分化成肺泡上皮细胞,改善对ALI模型的治疗作用的机制尤为重要[7]。
经典Wnt信号通路,依赖β-catenin的聚集,是细胞增殖、活化,决定细胞命运,及胚胎发育过程中的细胞极性,发展成稳定的成熟组织的基本通路之一[8]。最近的一些研究表明,实际上经典Wnt通路及其下游信号分子对MSCs的自我更新和分化起着至关重要的作用,并且表达一些配体、受体、和Wnt通路的抑制剂[9]。Wnt配体绑定到Frizzled家族蛋白及低密度脂蛋白受体相关蛋白(low-density lipoprotein receptor-related protein, LRP),可抑制糖原合成酶(GSK-3β)磷酸化和胞质中β-catenin降解,从而使胞内大量β-catenin聚集,进而转移到核内,调节靶基因表达[10]。因此,β-catenin被认为是经典Wnt通路的一个关键信号调节器。
先前的研究显示,在体外实验中证实激活经典Wnt/β-catenin通路能够促进大鼠MSCs分化成Ⅱ型肺泡上皮细胞,不仅具有抗氧化功能,还能够促进自身向受损肺组织迁移、定殖[11]。然而,Wnt/β-catenin通路在体内如何调节MSCs的增殖、分化,如何对ALI的治疗起作用仍然未知。体内环境十分复杂,与体外环境不同,会影响MSCs的定殖与分化。一项近期研究显示,过表达β-catenin的慢病毒载体稳定转染的大鼠MSCs,通过激活Wnt /β-catenin信号通路,调节大鼠MSCs迁移、增殖、分化[12]。
目前,少有报道MSCs移植治疗海水吸入引起的肺损伤治疗效果,几乎没有证据表明MSCs移植治疗海水吸入型肺损伤(seawater inhalation induced acute lung injury, SWI-ALI)的治疗效果可以通过β-catenin过表达改善。本研究的目的是确定MSCs通过β-catenin过表达对受损的肺泡上皮细胞的修复作用和它对SWI-ALI大鼠模型的总体治疗效果,从而进一步明确其作用机制。
材料和方法
一、实验材料
健康雄性SD大鼠,购于第四军医大学实验动物中心,SPF级,实验过程中对动物的处置符合中华人民共和国科学技术部2006年颁布的《关于善待实验动物的指导性意见》标准。Ctnnb1基因的过表达慢病毒购于上海吉凯基因化学技术有限公司,L-DMEM培养基购于美国Gibco公司,NIR815细胞标记试剂盒购于美国affymetrix公司。配方海水:根据我国国家海洋局第三海洋研究所提供配方配制,主要成分及含量接近我国东南沿海海水:NaCl 26.518 g/L,MgCl22.447 g/L,MgSO43.305 g/L,CaCl21.141 g/L,NaBr 0.083 g/L,NaHCO30.202 g/L,KCl 0.725 g/L,pH 8.2,比重1.05,渗透压 1 300 mmol/L。主要仪器设备:超净工作台购于中国苏净安泰公司,体内光学成像系统购于美国Caliper Life Sciences公司,高速台式离心机购于美国 Eppendorf公司。
二、研究方法
1. Ctnnb1基因过表达慢病毒包装和构建: 慢病毒载体EF1α-MCS-3FLAG-CMV-EGFP-T2A-Puromycin(过表达Ctnnb1)在上海吉凯有限公司包装和构建。空载体EF1a-EGFP作为一个空的对照。
2. 慢病毒转染MSCs: MSCs(5×104/孔)接种于六孔板,每孔2 ml,过夜培养。转染前细胞换液,每孔加入1 ml完全L-DMEM培养基含10%血清,加入目的基因病毒(2E+8TU/ml)5 μl,最后加入0.5 ml感染增强液(5 μg/ml)。3 d后通过荧光显微镜观察荧光表达效果,确定转染效率。将转染慢病毒载体的MSCs在普通正常DMEM培养基中, 37 ℃、5%的二氧化碳培养箱中孵化。传代至6~10代细胞用于实验。
3. 构建海水吸入型肺损伤大鼠模型: SD大鼠称重,腹腔内注入戊巴比妥(50 mg/kg)麻醉,大鼠保持仰卧位,头位高于水平30°。大鼠共36只,被随机分为四组,每组(n=9)。空白对照组:未经任何处理健康大鼠:SWI-ALI模型组:每个大鼠气道注入1 ml的配方海水,10 min后注入30 μl PBS;MSCs治疗组:每个大鼠气道注入1 ml的配方海水,10 min后注入MSCs(500 000个细胞于30μl PBS里);MSCs-Ctnnb1治疗组:每个大鼠气道注入1 ml的配方海水,10 min后注入 MSCs-Ctnnb1(500 000个细胞于30 μl PBS里)。老鼠被置于含氧量正常房间中直到完全恢复清醒。4 h后大鼠被腹主动脉离断处死。采集标本送检。
4. 苏木精和伊红染色: 采集右肺上叶标本置入多聚甲醛溶液24 h,转入75%乙醇溶液待送检。取回蜡块包埋组织,矢状切片厚5 μm,切面苏木精和伊红染色。染色切片可以看到水肿、肺泡间质炎症和出血、肺不张、坏死、透明膜形成。每只动物随机选取9个切片高倍视野观察每张幻灯片。
5. MSCs标记和追踪: NIR815染料标记细胞,NIR815染料的细胞(5×105)直接气道注入海水处理过的MSCs治疗组和MSCs-Ctnnb1治疗组大鼠模型。每组三个肺组织标本分别在处理后12 h,48 h体外肺部成像,使用光学成像系统(激发光=786 nm,发射光=814 nm,曝光时间4 000 ms)。自体荧光光谱模式使用软件包大师2.4。肺部荧光强度是衡量器官目的区域与正常化平均信号基于曝光时间和目的区域的面积比(按比例缩小的计数/秒)。
结 果
一、MSCs慢病毒载体有效转染
MSCs分别转染空白对照EF1a-eGFP和目的基因EF1a-MCS-3FLAG-CMV- EGFP-T2A-Puromycin(过表达Ctnnb1)培养10代。本研究中,eGFP细胞阳性率反映了MSCs目的基因的转染效率。第10代MSCs-Ctnnb1和MSCs-GFP的转染效率通过荧光显微镜可检测出,分析显示转染效率大于90%,见图1。结果表明,慢病毒介导的转染是有效的和稳定的。
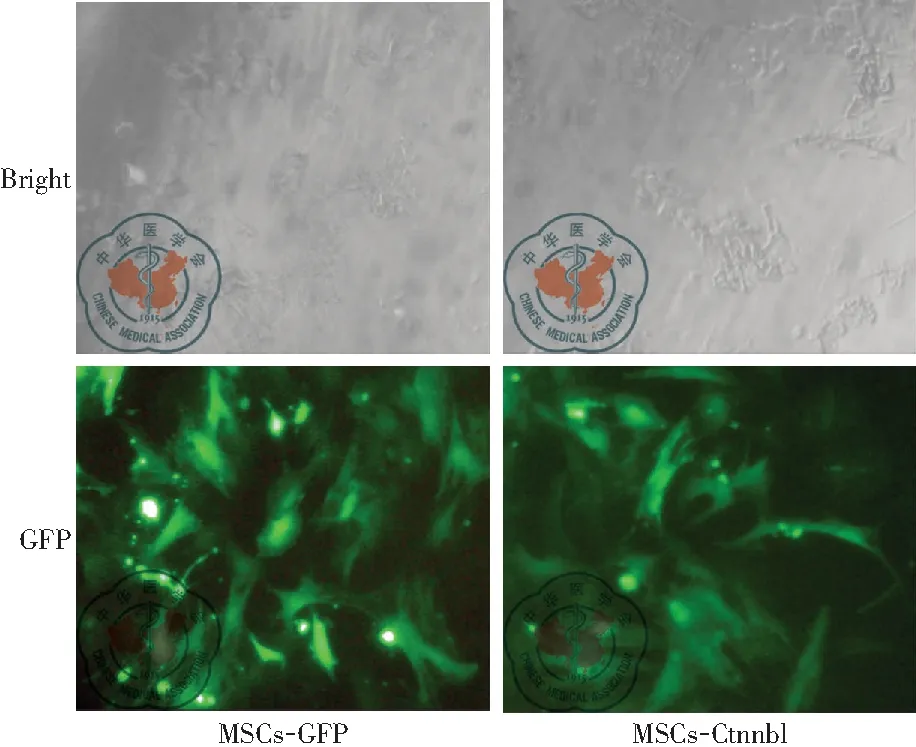
图1 同视野光学显微镜观察(上层)和荧光显微镜观察绿色荧光蛋白(下层)对比图(×200)
二、实验动物组织病理学检测
从海水吸入型肺损伤鼠模型的肺组织观察到肺泡壁增厚,肺泡间质炎性细胞浸润,出血,肺泡渗出和水肿。然而在干细胞干预后4 h MSCs治疗组和MSCs-Ctnnb1治疗组比SWI-ALI模型组组织病理学特征明显缓解。MSCs-Ctnnb1治疗组比MSCs治疗组病理改善效果更好,见图2。
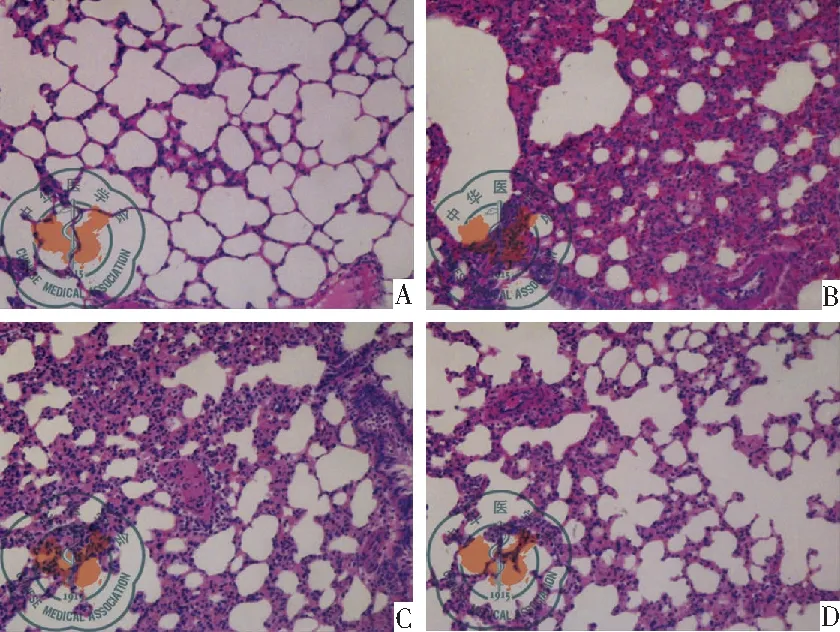
图2 肺组织病理学检测:海水吸入后4 h各组鼠模型肺组织病理学HE染色显微镜下形态(×200)
三、MSCs在肺组织内的保留
MSCs治疗组和MSCs-Ctnnb1治疗组大鼠干细胞干预造模后12 h和48 h进行肺组织体外近红外光谱成像追踪。彩色荧光图像信号表明,MSCs-Ctnnb1治疗组比MSCs治疗组干细胞干预造模后12 h、48 h检测荧光信号更强。每个组的信号在12 h后逐渐减弱,48 h后信号明显减少,但仍能被检测出,见图3。
讨 论
MSCs可以迁移和定殖到受损肺组织是ALI/ARDS的一个潜在治疗策略。MSCs在受损肺组织相对低的移植率和分化率限制了对ARDS的有利治疗作用[13-14]。在目前的研究中,将β-catenin基因稳定转染MSCs,经典Wnt通路是细胞和组织发育、分化及其它生理功能的一个根本调控通路[8]。经典Wnt通路的激活主要取决于β-catenin的聚集。经典Wnt配体绑定卷曲(Fz)共受体和低密度脂蛋白受体相关蛋白(LRP-5,6),从而抑制糖原合成酶GSK-3β磷酸化及β-catenin降解,β-catenin大量积累进而转移入核内调控基因表达[10]。因此,β-catenin被认为是经典Wnt通路的关键信号调节器。在研究中,利用慢病毒载体介导干细胞转染获得长期稳定的β-catenin基因过表达MSCs株。获得的MSCs株传10代测感染效率仍高达90%,并通过PCR和Western blot验证了其感染效率是稳定的。有研究表明β-catenin过表达使MSCs核内β-catenin累积,被认为可促进Wnt/β-catenin通路的激活[7]。但β-catenin过表达激活Wnt/β-catenin通路的具体机制是什么,尚不清楚,还需进一步探索及研究。
在体外实验中证实激活经典Wnt/β-catenin通路能够促进大鼠MSCs分化成Ⅱ型肺泡上皮细胞,不仅具有抗氧化功能,还能够促进自身向受损肺组织迁移、定殖[11]。这表明经典Wnt通路可提高MSCs对肺损伤的治疗作用。在目前的研究中,通过MSCs稳定转染β-catenin基因,证实了Wnt/β-catenin通路对AWI-ALI大鼠模型的这种积极作用。
MSCs可能具有在受损炎症点聚集,发挥抗炎作用,分化成特定细胞,修复受损组织的生物学功能。很多研究都证实了MSCs向炎症、创伤、缺血和肿瘤等疾病受损部位迁移和定殖的能力,主要在受损点增殖而不是在无损伤的部位[15-20]。同样,很多研究证实急性肺损伤鼠模型明显比正常对照鼠模型干细胞移植效果好[3, 21]。近来其它研究中也有证实经典Wnt/β-catenin信号通路在MSCs迁移中的积极作用[22-23]。通过细胞迁移实验研究发现Wnt3a和LiCl刺激经典Wnt信号通路促进骨髓MSCs迁移到受损肺组织[11]。与以上研究一致,本实验结果表明β-catenin过表达的MSCs相比对照MSCs明显增加其在AWI-ALI鼠模型肺内的定殖。
经典Wnt/β-catenin信号通路除了促进干细胞迁移和定殖到急性肺损伤大鼠肺组织,对干细胞移植到复杂的体内环境还有一个积极的保护作用,可以降低干细胞存活率的不利因素,如氧化物、炎症因子、缺氧和缺血等。有研究发现经典Wnt信号通路保护骨髓MSCs抗氧化应激,明显增加干细胞存活率和抑制细胞凋亡[11]。此外体外实验表明β-catenin过表达MSCs比对照组促进增殖。所有这些机制可能促进MSCs在海水吸入型受损肺内的定殖作用。
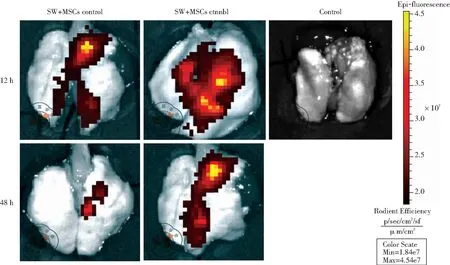
图3 体外近红外光谱成像的肺组织荧光信号表达(SW+MSCs control:MSCs治疗组;SW+MSCs-Ctnnb1:MSCs-Ctnnb1治疗组)
很多研究指出MSCs可以调控大部分免疫细胞的活性[24-26],在本实验中也证实了MSCs能够抑制ALI鼠模型体内炎症,多方面的证据支持这个结论:促炎因子如干扰素-γ、IL-1β、IL - 6的分泌减少,而抗炎细胞因子IL - 10增加[5, 21],β-catenin过表达的MSCs放大这种效应,然而基本机制尚不清楚,值得进一步探索。
以上结果表明通过β-catenin过表达激活经典Wnt/β-catenin通路提高间充质干细胞的增殖及向受损肺组织的迁移能力,增加MSCs在肺内的定殖、缓解病理损伤,能够提高MSCs对SWI-ALI的治疗效果。
1 金发光, 郭佑民. 地塞米松调节claudin-4减轻海水淹溺性肺水肿的机制研究[J/CD]. 中华肺部疾病杂志: 电子版, 2013, 6(2): 124-129.
2 Ortiz LA, Gambelli F, McBride C, et al. Mesenchymal stem cell engraftment in lung is enhanced in response to bleomycin exposure and ameliorates its fibrotic effects[J]. Proc Natl Acad Sci U S A, 2003, 100(14): 8407-8411.
3 Yamada M, Kubo H, Kobayashi S, et al. Bone marrow-derived progenitor cells are important for lung repair after lipopolysaccharide-induced lung injury[J]. J Immunol, 2004, 172(2): 1266-1272.
4 Kotton DN, Ma BY, Cardoso WV, et al. Bone marrow-derived cells as progenitors of lung alveolar epithelium[J]. Development, 2001, 128(24): 5181-5188.
5 Gupta N, Su X, Popov B, et al. Intrapulmonary delivery of bone marrow-derived mesenchymal stem cells improves survival and attenuates endotoxin-induced acute lung injury in mice[J]. J Immunol, 2007, 179(3): 1855-1863.
6 Mei SH, McCarter SD, Deng Y, et al. Prevention of LPS-induced acute lung injury in mice by mesenchymal stem cells overexpressing angiopoietin 1[J]. PLoS Med, 2007, 4(9): e269.
7 Cai SX, Liu AR, He HL, et al. Stable genetic alterations of beta-catenin and ROR2 regulate the Wnt pathway, affect the fate of MSCs[J]. J Cell Physiol, 2014, 229(6): 791-800.
8 Logan CY, Nusse R. The Wnt signaling pathway in development and disease[J]. Annu Rev Cell Dev Biol, 2004, 20: 781-810.
9 Etheridge SL, Spencer GJ, Heath DJ, et al. Expression profiling and functional analysis of wnt signaling mechanisms in mesenchymal stem cells[J]. Stem Cells, 2004, 22(5): 849-860.
10 Leyns L, Bouwmeester T, Kim SH, et al. Frzb-1 is a secreted antagonist of Wnt signaling expressed in the Spemann organizer[J]. Cell, 1997, 88(6): 747-756.
11 Liu AR, Liu L, Chen S, et al. Activation of canonical wnt pathway promotes differentiation of mouse bone marrow-derived MSCs into type Ⅱ alveolar epithelial cells, confers resistance to oxidative stress, and promotes their migration to injured lung tissue in vitro[J]. J Cell Physiol, 2013, 228(6): 1270-1283.
12 Cai SX, Liu AR, Chen S, et al. Activation of Wnt/beta-catenin signalling promotes mesenchymal stem cells to repair injured alveolar epithelium induced by lipopolysaccharide in mice[J]. Stem Cell Res Ther, 2015, 6: 65.
13 Gupta N, Su X, Popov B, et al. Intrapulmonary delivery of bone marrow-derived mesenchymal stem cells improves survival and attenuates endotoxin-induced acute lung injury in mice[J]. J Immunol, 2007, 179(3): 1855-1863.
14 Mei SH, McCarter SD, Deng Y, et al. Prevention of LPS-induced acute lung injury in mice by mesenchymal stem cells overexpressing angiopoietin 1[J]. PLoS Med, 2007, 4(9): e269.
15 Chen J, Li Y, Wang L, et al. Therapeutic benefit of intravenous administration of bone marrow stromal cells after cerebral ischemia in rats[J]. Stroke, 2001, 32(4): 1005-1011.
16 Bensidhoum M, Chapel A, Francois S, et al. Homing of in vitro expanded Stro-1- or Stro-1+ human mesenchymal stem cells into the NOD/SCID mouse and their role in supporting human CD34 cell engraftment[J]. Blood, 2004, 103(9): 3313-3319.
17 Devine SM, Cobbs C, Jennings M, et al. Mesenchymal stem cells distribute to a wide range of tissues following systemic infusion into nonhuman primates[J]. Blood, 2003, 101(8): 2999-3001.
18 Rochefort GY, Vaudin P, Bonnet N, et al. Influence of hypoxia on the domiciliation of mesenchymal stem cells after infusion into rats: possibilities of targeting pulmonary artery remodeling via cells therapies?[J]. Respir Res, 2005, 6: 125.
19 Kollar K, Cook MM, Atkinson K, et al. Molecular mechanisms involved in mesenchymal stem cell migration to the site of acute myocardial infarction[J]. Int J Cell Biol, 2009, 2009: 904682.
20 Barbash IM, Chouraqui P, Baron J, et al. Systemic delivery of bone marrow-derived mesenchymal stem cells to the infarcted myocardium: feasibility, cell migration, and body distribution[J]. Circulation, 2003, 108(7): 863-868.
21 Xu J, Woods CR, Mora AL, et al. Prevention of endotoxin-induced systemic response by bone marrow-derived mesenchymal stem cells in mice[J]. Am J Physiol Lung Cell Mol Physiol, 2007, 293(1): L131-L141.
22 Neth P, Ciccarella M, Egea V, et al. Wnt signaling regulates the invasion capacity of human mesenchymal stem cells[J]. Stem Cells, 2006, 24(8): 1892-1903.
23 Shang YC, Wang SH, Xiong F, et al. Wnt3a signaling promotes proliferation, myogenic differentiation, and migration of rat bone marrow mesenchymal stem cells[J]. Acta Pharmacol Sin, 2007, 28(11): 1761-1774.
24 Stagg J. Immune regulation by mesenchymal stem cells: two sides to the coin[J]. Tissue Antigens, 2007, 69(1): 1-9.
25 Maccario R, Podesta M, Moretta A, et al. Interaction of human mesenchymal stem cells with cells involved in alloantigen-specific immune response favors the differentiation of CD4+T-cell subsets expressing a regulatory/suppressive phenotype[J]. Haematologica, 2005, 90(4): 516-525.
26 Uccelli A1, Moretta L, Pistoia V. Immunoregulatory function of mesenchymal stem cells[J]. Eur J Immunol, 2006, 36(10): 2566-2573.
