基于SIRT1信号轴探讨有氧运动与白藜芦醇对糖尿病大鼠血管氧化应激和炎症的影响
2018-03-11许桂清刘一平
李 俊,许桂清,刘一平
糖尿病是威胁人类健康最重要的非传染性慢性病之一,以血管内皮功能紊乱和动脉粥样硬化为特征的血管并发症是糖尿病诱导心血管事件,导致死亡的主要原因。大量研究显示,氧化应激在血管内皮损伤和动脉粥样硬化形成过程中发挥关键作用,而炎症贯穿于血管病变的整个过程[1-2],因此,降低血管氧化应激,缓解炎症对糖尿病并发症的防治具有非常重要的作用。
近年多项研究表明,沉默信息调节因子1(SIRT1)对血管具有保护性作用。SIRT1在血管内皮细胞上高度表达,对抑制动脉硬化,降低血管氧化应激和炎症具有重要意义[3]。白藜芦醇是一种植物多酚类混合物,最初发现来源于红葡萄酒,是SIRT1最重要的激动剂,在治疗心血管和代谢性疾病中发挥重要作用。除此之外,规律性运动同样可以降低慢性炎症,改善血糖平衡,对血管起到保护作用[4-5]。有研究显示,运动能够增加骨骼肌、肝脏等组织SIRT1蛋白表达和活性[6-7],但有关运动对SIRT1在血管组织中表达作用的研究还鲜有报道,运动是否可以通过SIRT1机制来改善糖尿病血管炎症还无法确定。因此,本课题为进一步揭示SIRT1在有氧运动和白藜芦醇改善糖尿病大鼠血管氧化应激和炎症中的作用,对糖尿病大鼠进行8周有氧运动和白藜芦醇干预,并基于SIRT1信号轴来探讨有氧运动和白藜芦醇对糖尿病大鼠血管氧化应激和炎症的影响机制。
1 研究对象与方法
1.1 实验动物
6周龄清洁型Sprague Dawley大鼠42只[合格证号:SCXK(闽)2012-0002],体重210~260 g。饲养环境温度和湿度分别控制在22~24oC和50%~70%,12 h昼夜循环。
1周适应性喂养后,随机选取7只作为正常组对照组,并以普通饲料喂养,其余35只采用高脂饲料喂养(64.8%基础饲料,15%猪油,15%蔗糖,5%蛋黄粉,0.2%胆酸钠),制作糖尿病模型。4周高脂饲料喂养后,禁食12 h,30 mg/kg剂量,大鼠腹腔注射链脲佐菌素(STZ,溶于0.1 mol/L柠檬酸缓冲液),正常对照组注射相应容量的柠檬酸缓冲液。STZ注射2周后,空腹血糖值大于11.1 mmol/L确定为糖尿病,最终符合糖尿病模型大鼠共29只。造模成功后,糖尿病组大鼠继续以原先配制的高脂饲料喂养,自由进食饮水,直到实验结束。
1.2 研究设计
1.2.1 实验分组 正常对照组(Normal Con,NC)7只,糖尿病组分为4组:糖尿病对照组(Diabetes Control,DC)7只;糖尿病运动组(Diabetes Swimming,DS)7只,进行8周有氧运动干预;糖尿病白藜芦醇处理组(Diabetes Res,DR)7只,进行8周白藜芦醇处理;糖尿病白藜芦醇+运动联合干预组(Diabetes Res Swimming,DRS)8只,同时给予8周白藜芦醇和有氧运动处理。
1.2.2 给药方法 采用腹腔注射白藜芦醇,剂量为30 mg/kg/d,每周监控大鼠体重变化,并根据体重变化调整药物用量。
1.2.3 运动方案 正式游泳运动干预前,所有运动组大鼠进行1周时间的适应性游泳练习。正式运动干预方法为1 h/d,5 d/week,共8周游泳运动干预。运动负荷设计为:前4周无负荷游泳,后4周负重1%体重。游泳池为圆形塑料桶(直径60 cm,高75 cm),水深45~50 cm,水温控制在32~34oC,每桶同时容纳3只大鼠。游泳过程中时刻观察游泳大鼠的状态,防止出现大鼠溺水淹死等意外发生。
1.2.4 样本制备 大鼠最后一次干预结束后24 h处死,处死前禁食12 h。大鼠血液样本4oC、3 500 r/min离心10 min,取上清液,-20oC保存。迅速剥离主动脉放入冷冻管中,置于-80oC储存待用。
1.3 指标检测
1.3.1 空腹血糖检测 大鼠禁食12 h,尾部取血,使用血糖仪和血糖试纸(罗氏卓越血糖仪及配套试纸)检测大鼠血糖。
1.3.2 糖耐量实验 大鼠禁食12 h,按2 g/kg剂量腹腔注射葡萄糖溶液,注射后分别在第0、30、60、120 min进行血糖测定,并记录检测数据。
1.3.3 血清样本检测 甘油三酯(TC)、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)和低密度脂蛋白胆固醇(LDL-C)采用相应试剂盒进行检测(南京建成生物工程研究所),胰岛素(Insulin)、白介素-1β(IL-1β)和血管细胞粘附分子-1(VCAM-1)采用ELISA检测法测定(南京建成生物工程研究所),上述指标检测方法均对照试剂盒说明进行操作。
1.3.4 血管超氧化物歧化酶(SOD)活性和丙二醛(MDA)浓度检测 首先,将主动脉按1∶9比例加入生理盐水,研磨,制作10%组织匀浆液;其次,采用BCA法测量组织匀浆液的蛋白浓度(江苏碧云天生物技术研究所);最后,按照SOD和MDA检测试剂盒说明书进行操作(南京建成生物工程研究所),并根据计算公式计算出组织匀浆液SOD活性和MDA浓度。
1.3.5 Western Blotting 将主动脉和裂解液混合放入匀浆器中进行研磨,提取主动脉总蛋白。使用BCA法测定蛋白浓度后,高温变性,并置于-80oC保存待用。制备浓缩胶和分离胶,将蛋白样品注入到上样孔内进行电泳。电泳结束后,转膜1.5 h。取膜,用5%脱脂奶粉封闭1 h,一抗SIRT1、核因子相关因子2(Nrf2)、血红素氧合酶-1(HO-1)、抑制子kappa B(IκBα)、NADPH氧化酶4(NOX4)和GAPDH(Abcam,美国)4oC孵育过夜,洗膜,二抗室温孵育1 h,洗膜。ECL化学发光显色、拍照。
1.4 数据统计
采用SPSS 19.0软件进行数据统计,数据采用平均数±标准误表示,组间差异分析采用one-way ANOVA,P<0.05认为具有统计性差异。
2 研究结果
2.1 大鼠糖耐量实验结果
8周干预后,禁食12 h,按2 g/kg剂量腹腔注射葡萄糖溶液,观测大鼠0、30、60和120 min血糖变化(见图1A)。所有组大鼠在第30 min血糖值达到最高水平,然后逐渐降低。在第30 min时,DC组血糖值最高,其次是DS、DR、DRS组,NC组血糖最低。在120 min时,DC组与其他组相比,仍处于较高的血糖水平。GlucoseAUC0-2h值反应了机体调节血糖平衡的能力,GlucoseAUC0-2h值越大,说明调节血糖能力越低,相反,值越小,调节能力越强。所有糖尿病组GlucoseAUC0-2h值均显著高于正常对照组(P<0.01),其中DC组最高,与其他干预组相比,在统计上具有显著性差异(P<0.01),干预组之间GlucoseAUC0-2h值虽然存在一定差异,但没有统计性意义(见图1B)。
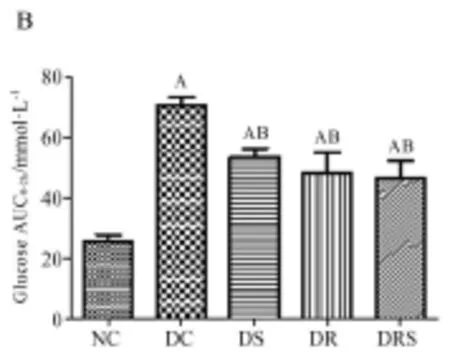
图1 大鼠糖耐量测试结果(Mean±SEM,n=6/group)Figure1 The Result of Glucose Tolerance Test in Rats(Mean±SEM,n=6/group)
2.2 大鼠糖脂代谢相关指标
8周实验干预后,大鼠体重、空腹血糖、空腹胰岛素、胰岛素敏感指数和血脂指标显示,DC组体重最大,而DR和DRS组与糖尿病对照组相比体重较轻,但没有统计性差异;糖尿病组FBG均显著高于正常对照组,干预组FBG均低于糖尿病对照组,但仅DRS组具有统计学意义(P<0.05);DC和DR组FINS明显高于NC组(P<0.01,P<0.05),DRS组与DC组相比,FINS明显较低(P<0.05);糖尿病组胰岛素敏感指数(ISI)显著低于正常对照组(P<0.01),DRS组ISI明显高于DC组(P<0.05);在血脂指标上,DC组TG、TC和LDL-C均明显高于NC组(P<0.05),干预组3项血脂均低于DC组,但仅DRS组具有统计性意义(P<0.05),DC组HDL-C明显低于NC组(P<0.05),而干预组HDL-C水平均高于DC组,但仅DRS组具有明显差异(P<0.05)(见表1)。
2.3 大鼠血管SIRT1蛋白表达
8周干预后血管SIRT1蛋白表达水平显示,DC和DS组SIRT1表达水平显著低于NC组(P<0.05,P<0.01),DS、DR和DRS组SIRT1蛋白表达水平明显高于DC组(P<0.05,P<0.01)(见图2)。
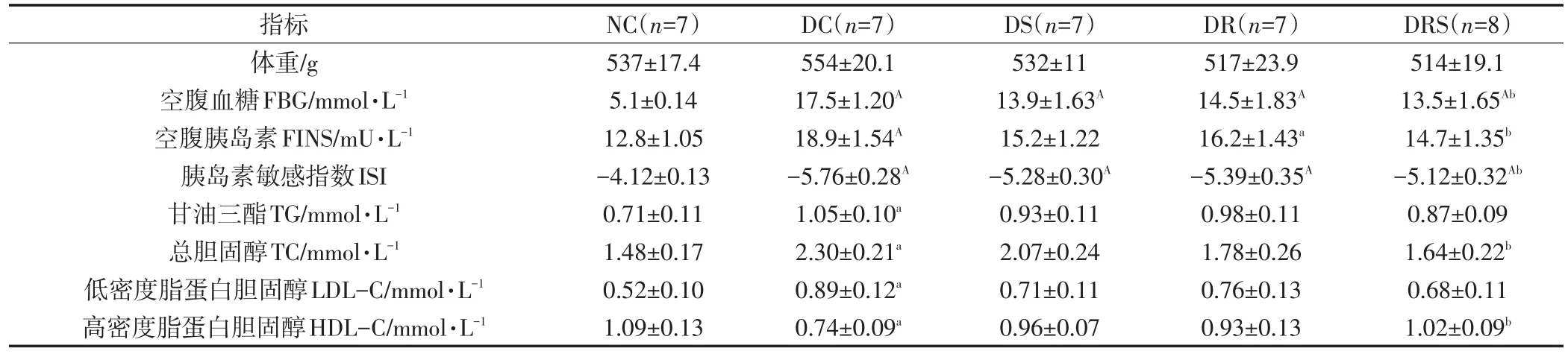
表1 大鼠体重、血糖、胰岛素和血脂指标(Mean±SEM)Table1 The Indicators of Weight,Blood Glucose,Insulin and Serum Lipid(Mean±SEM)
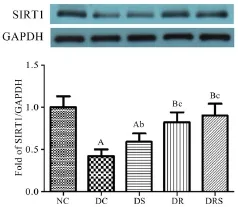
图2 大鼠血管SIRT1蛋白表达(Mean±SEM,n=6/group)Figure2 The Protein Express of SIRT1 in Aorta of Rats(Mean±SEM,n=6/group)
2.4 糖尿病大鼠血管氧化应激指标
结果显示,NC和DC组Nrf2蛋白表达最低,DS、DR和DRS组蛋白表达均显著高于NC和DC组(P<0.01),但3组之间没有明显差异;HO-1是Nrf2的下游蛋白,DC组大鼠HO-1蛋白表达最低,DS、DR和DRS组HO-1蛋白表达明显高于DC组(P<0.05)(见图3)。
结果显示,NC组大鼠血NOX4蛋白表达水平最低,均明显低于其他4组(P<0.05,P<0.01),而DC组表达最高;DS、DR和DRS组NOX4蛋白表达均明显低于DC组(P<0.05,P<0.01)(见图4)。
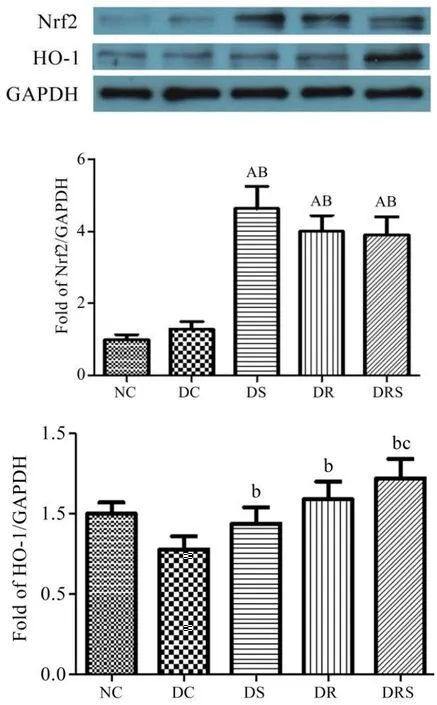
图3 大鼠血管Nrf2和HO-1蛋白表达(Mean±SEM,n=6/group)Figure3 The Protein Express of Nrf2 and HO-1 in Aorta of Rats(Mean±SEM,n=6/group)
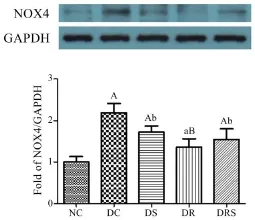
图4 大鼠血管NOX4蛋白表达水平(Mean±SEM,n=6/group)Figure4 The Protein Express of NOX4 in Aorta of Rats(Mean±SEM,n=6/group)
8周干预后大鼠血管SOD活性和MDA水平显示,DC组SOD活性明显低于NC组(P<0.05),DRS组大鼠血管SOD活性最高,均高于其他4组大鼠(P<0.05);DC组MDA水平明显高于NC组,DS和DRS组MDA水平明显低于DC组(P<0.05),DS、DR和DRS组之间没有明显差异(见图5)。
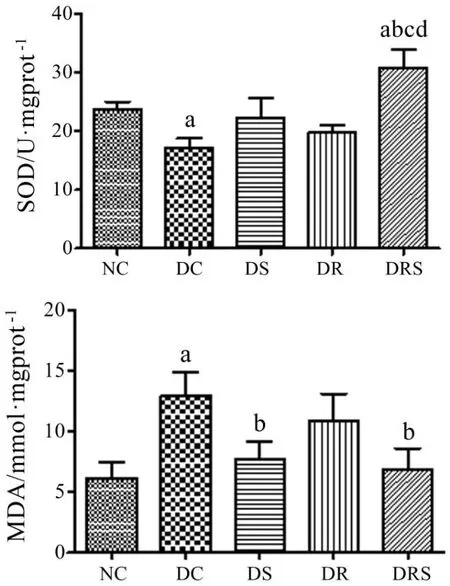
图5 大鼠血管SOD活性和MDA水平(Mean±SEM,n=7/group)Figure5 The Level of SOD and MDA in Aorta of Rats(Mean±SEM,n=7/group)
2.5 大鼠血清IL-1β和VCAM-1指标
8周干预后,对大鼠血清白介素-1β(IL-1β)和血管细胞粘附分子-1(VCAM-1)进行检测发现,DC组血清IL-1β浓度显著高于NC组(P<0.01),DS、DR和DRS组大鼠IL-1β浓度显著低于DC组(P<0.05,P<0.01),其中DRS组大鼠血清IL-1β水平最低,与DS组相比,具有明显差异(P<0.05);DC组VCAM-1浓度最高,显著高于NC组(P<0.01),DS组明显低于DC组(P<0.01),DR和DRS组VCAM-1水平均显著低于DC和DS组(P<0.01)(见图6)。
2.6 糖尿病大鼠血管IκBα蛋白表达
8周干预后大鼠血管炎症信号IκB蛋白表达显示,DC组表达最低,DS、DR和DRS组大鼠血管IκB蛋白表达均明显高于DC组(P<0.05,P<0.01),DS组表达低于NC组(P<0.05),DRS组表达高于DS组(P<0.05)(见图7)。
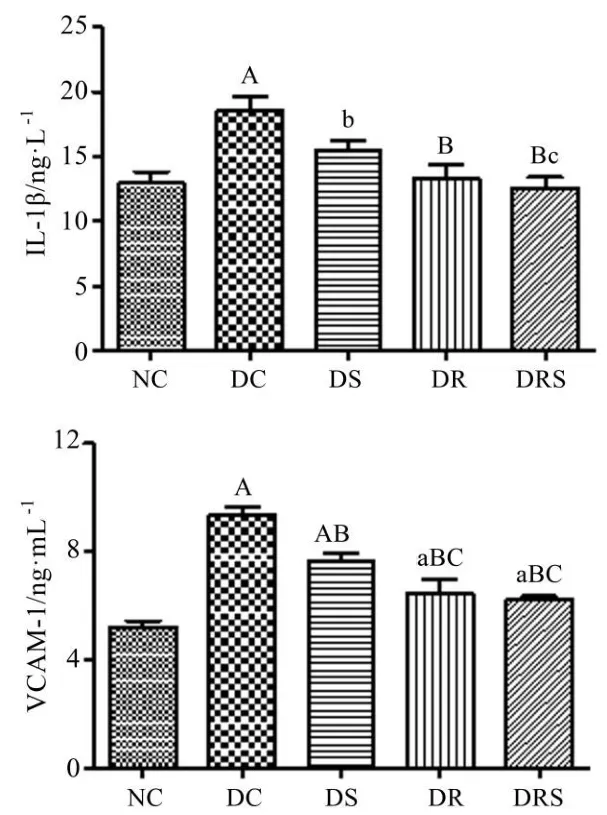
图6 大鼠血清IL-1β和VCAM-1浓度(Mean±SEM,n=7~8/group)Figure6 The Serum Concentration of IL-1β and VCAM-1 in Rats(Mean±SEM,n=7~8/group)
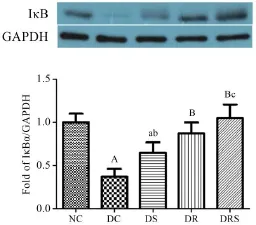
图7 大鼠血管IκBα蛋白表达(Mean±SEM,n=6/group)Figure7 The Protein Express of IκBα in Aorta of Rats(Mean±SEM,n=6/group)
3 讨论与分析
3.1 有氧运动和白藜芦醇对糖尿病大鼠糖脂代谢的影响
白藜芦醇具有心血管保护作用,是SIRT1最重要的激动剂。SIRT1作为一种能量感受器,能够调节机体代谢,如胰岛素分泌、肝脏糖异生和脂肪酸氧化。研究显示,SIRT1敲除或抑制可以通过干扰胰岛素受体磷酸化和糖原合成损害胰岛素信号[8]。相反,肝脏SIRT1过表达能够缓解肝性脂肪变性,改善胰岛素敏感性,导致葡萄糖代谢平衡的改善[9]。SIRT1可以直接对胰岛β细胞产生作用,促进血糖吸收和利用[10]。本研究显示,给予白藜芦醇处理能够缓解糖尿病大鼠糖耐量受损,降低空腹血糖,提高胰岛素敏感性,进一步说明SIRT1在改善胰岛素分泌,调节血糖平衡中的积极作用。除此之外,数据也显示了有氧运动和白藜芦醇均能上调糖尿病大鼠血管SIRT1蛋白表达,同时对调节血糖平衡具有一定的作用,尤其是有氧运动和白藜芦醇联合干预对降低糖尿病大鼠血糖,提高胰岛素敏感性表现出更为明显的改善效果。
SIRT1还参与脂肪细胞的聚集,调节脂肪代谢。在肥胖小鼠中,脂肪组织SIRT1表达较低,导致脂肪酸利用率降低。SIRT1上调可以减少脂肪储存,增加脂肪酸氧化。高脂饮食小鼠给予白藜芦醇处理可以增加脂肪分解,改变血脂平衡,减缓体重的增加[11-12]。本研究显示,给予白藜芦醇处理的糖尿病大鼠血清TG、TC和LDL-C浓度降低,HDL-C升高,体重降低,虽然在数据上没有表现出明显的变化差异,但仍然可以看出,白藜芦醇在血脂代谢上所发挥的作用。有氧运动也显示出类似的效果,而有氧运动和白藜芦醇联合干预却能够明显改善糖尿病大鼠血脂代谢,但其机制还并不清楚,还需要进一步实验研究。
3.2 有氧运动和白藜芦醇对糖尿病大鼠血管氧化应激的影响
白藜芦醇能够增加血管舒张功能,减少血管平滑肌增生,防止动脉粥样硬化[13],其作用主要归因于SIRT1的抗氧化和抗炎症特性。目前,体内外研究表明,白藜芦醇能够降低ROS生成,上调内源性抗氧化基因和血管保护分子基因表达[14]。但研究显示,SIRT1直接抗氧化效应并不强,主要是通过作用于下游转录因子促进抗氧化基因的表达来调节细胞内氧化应激和细胞毒性[15]。SIRT1可以通过调节NOX和Nrf2来影响细胞氧化还原状态。
3.2.1 SIRT1/Nrf2信号在改善糖尿病大鼠血管氧化应激中的作用 Nrf2属于CNC家族成员,是内源性抗氧化系统中关键的转录因子。在正常生理条件下,Nrf2与Keap1结合在细胞质中,位于胞浆中的Nrf2被泛素化,并被蛋白酶体降解,使Nrf2处于较低的水平。当Keap1受到亲电物质、自由基、重金属等物质时,Nrf2与Keap1分离,并转位至细胞核,与内源性抗氧化反应元件(ARE)结合,促使NQO1、HO-1、SOD等抗氧化酶基因的表达[16]。Nrf2还能够对血管内皮起到保护性作用,主要是通过其下游因子HO-1发挥作用。HO-1属于抗氧化物质,其主要功能是将血红素降解为CO分子、亚铁离子和胆绿素,胆绿素通过胆绿素还原酶生成具有抗氧化功能的胆红素[17],同时HO-1诱导的CO可以激活可溶性鸟苷酸环化酶,增强血管内皮依赖性舒张功能,对血管具有保护作用[18]。目前,越来越多的证据表明,Nrf2激动剂可以预防和治疗糖尿病并发症,Keap1-Nrf2系统在糖尿病发病机制和并发病中发挥重要的作用[19]。
本研究显示,有氧运动和白藜芦醇均能明显上调糖尿病大鼠血管Nrf2蛋白表达,尽管正常对照组和糖尿病对照组血管Nrf2蛋白表达水平较低,可能是由于正常生理条件下Nrf2受到Keap1抑制而处于较低水平。除此之外,有氧运动和白藜芦醇还能够上调糖尿病大鼠血管Nrf2下游因子HO-1蛋白表达,但对血管SOD活性影响较小,同样可以推测有氧运动和白藜芦醇可能激活了糖尿病大鼠血管Nrf2/ARE信号通路,提高血管组织的抗氧化能力。
有研究显示,内皮细胞Nrf2活性及下游NQO1和HO-1基因表达随白藜芦醇呈剂量性增加,白藜芦醇处理明显缓解高脂喂养Nrf2过表达小鼠血管氧化应激,改善血管内皮功能,而对Nrf2敲除小鼠的血管保护作用消失,认为Nrf2信号通路在SIRT1介导的血管保护效应中发挥关键作用[20]。目前已有大量报道显示,SIRT1/Nrf2信号通路对细胞氧化应激和炎症的积极作用。B.ZHANG等[21]通过激活糖尿病心肌损伤大鼠SIRT1/Nrf2信号降低心肌细胞氧化应激,增强心肌功能。E.N.KIM等[22]通过白藜芦醇激活SIRT1/Nrf2信号,促进下游HO-1和SOD抗氧化基因表达,改善了肾损伤衰老小鼠肾脏功能、炎症和细胞凋亡。这些研究与本研究结果类似,有氧运动和白藜芦醇均能明显上调SIRT1蛋白表达,并激活Nrf2信号,说明有氧运动和白藜芦醇可能通过激活糖尿病大鼠SIRT1/Nrf2信号通路,增加血管抗氧化能力。
3.2.2 SIRT1/NOX4信号在改善糖尿病大鼠血管氧化应激中的作用 脉管系统中,氧化应激产生过多ROS,激活NF-κB炎症信号,诱导炎症基因的表达,损伤血管内皮细胞,导致血管发生紊乱。NOX4是脉管系统中ROS最主要的来源之一,主要表达在血管内皮和平滑肌细胞[23]。研究显示,动脉粥样硬化、脑卒中和心脏病等心血管疾病都表现出较高的NOX4水平[24]。NOX4上调能够导致血管内皮细胞凋亡和炎症反应。
目前研究报告显示,SIRT1可以通过调节NOX4来影响细胞内ROS生成[25]。M.J.ZARZUELO等[26]采用SIRT1抑制剂明显增强NOXs活性,及其亚基p22和NOX4mRNA表达,增加ROS生成,而给予白藜芦醇处理可以预防这一结果的发生。这些研究与本研究结果相似,8周白藜芦醇干预明显抑制糖尿病大鼠血管NOX4蛋白表达,同时降低了糖尿病大鼠血管MDA浓度。近年来有学者从NOX4角度研究运动调节血管氧化应激的作用,大部分研究显示,运动能够降低病理性血管NOX4表达。S.TOUATI等[27]研究显示,12周有氧运动能够降低高脂饮食肥胖大鼠主动脉NOX2和NOX4的活性及蛋白表达。本研究数据同样显示了类似的结果,8周有氧运动抑制血管NOX4蛋白表达和MDA浓度,缓解血管氧化应激。因此可以推测,有氧运动和白藜芦醇可能通过激活SIRT1信号,抑制NOX4表达来降低糖尿病大鼠血管氧化应激。
综上所述,NOX4和Nrf2是调节细胞氧化还原平衡的2个重要因子,NOX4与Nrf2之间的失衡可能破坏细胞氧化还原的平衡状态。糖尿病血管组织细胞表现为氧化与抗氧化平衡的严重失调,而有氧运动和白藜芦醇均能降低糖尿病血管NOX4蛋白表达和MDA浓度,同时激活Nrf2信号及下游HO-1表达,尤其是有氧运动和白藜芦醇联合干预表现出更为明显的抗氧化效果,说明有氧运动和白藜芦醇可能通过激活SIRT1信号调节Nrf2和NOX4之间的平衡,缓解糖尿病大鼠血管氧化应激。
3.3 SIRT1/NF-κB信号在白藜芦醇和有氧运动改善糖尿病大鼠血管炎症中的作用
大量研究显示,规律性有氧运动能够缓解炎症反应[28]。本研究也显示了类似的结果,8周有氧运动降低了糖尿病大鼠血清IL-1β和VCAM-1水平。实验选取血清IL-1β和VCAM-1作为血管炎症指标,其中IL-1β反映了机体的慢性炎症状态,VCAM-1是血管特异性分泌的细胞粘附分子,是反映血管炎症的主要指标。除此之外,研究数据还显示了,给予白藜芦醇处理能够明显降低糖尿病大鼠血清IL-1β和VCAM-1浓度,说明白藜芦醇同样具有抗炎作用。目前已有大量研究表明,SIRT1是免疫反应的调节器,在许多组织中能够抑制炎症[29-30]。SIRT1过表达或白藜芦醇处理能够降低高脂饮食诱导的肝脏炎症水平[31]。A.CSISZAR等[32]报道了给予Res处理能够缓解吸烟诱导的大鼠主动脉炎症反应,包括炎症信号的抑制,降低炎症介质,如细胞间粘附分子-1(ICAM-1)、诱导型一氧化氮合酶(iNOS)、IL-1β和肿瘤坏死因子-α(TNF-α)。
SIRT1的抗炎作用与炎症信号NF-κB有关。NF-κB介导的信号转导是炎症反应中最重要的信号通路,该信号参与细胞炎症反应,促进凝血和促炎基因的表达,在糖尿病血管并发症和动脉粥样硬化中发挥关键作用。在正常生理状态下,NF-κB亚基p50和p65形成二聚物与IκB以失活的方式结合在细胞质中,当细胞受到ROS或促炎因子等刺激时,细胞内NF-κB信号被激活,细胞质中p65与IκB分开,并转移到细胞核,激活下游TNF-α、VCAM-1和IL-1β等炎症基因的表达[33]。NF-κB p65并不能真正反映NF-κB信号的激活,因此,对糖尿病大鼠血管NF-κB p65抑制剂IκB进行检测显示,有氧运动和白藜芦醇均能上调IκB蛋白表达,抑制了p65向细胞核的转位,且大鼠血清IL-1β和VCAM-1浓度均有明显的下降,说明有氧运动和白藜芦醇可能抑制了NF-κB炎症信号,降低下游炎症基因的表达。
大量研究表明,SIRT1可以通过抑制NF-κB信号来影响炎症反应,SIRT1是NF-κB的潜在抑制剂。SIRT1过表达能够降低高脂饮食小鼠肝脏NF-κB活性及下游炎症因子表达[34],肝脏SIRT1特异性敲除能够激活高脂饮食小鼠肝脏NF-κB信号[35],SIRT1过表达可以预防高糖诱导的人类脐静脉内皮细胞NF-κB信号的激活,降低内皮细胞损伤[36]。前期研究同样显示,8周有氧运动干预能够激活SIRT1/NF-κB信号,缓解糖尿病大鼠血管炎症[37]。SIRT1抑制NF-κB介导的炎症反应主要通过2种方式:SIRT1通过去乙酰化RelA/p65 Lys310,促进p65与IκB结合,抑制NF-κB活性[38];SIRT1通过降低细胞核内CBP/P300乙酰基转移酶的活性来降低核内p65乙酰化水平,减弱p65与DNA的结合,并促进p65转位至细胞质与IκB结合[39]。从上述的研究结果来看,有氧运动和白藜芦醇上调SIRT1和IκB蛋白表达,降低炎症因子,可以推测有氧运动和白藜芦醇可能通过激活SIRT1信号来抑制NF-κB炎症信号。因此可以认为,有氧运动和白藜芦醇有可能是通过激活SIRT1/NF-κB信号通路机制来缓解糖尿病大鼠血管炎症。
4结 论
有氧运动和白藜芦醇及联合干预能够有效改善糖尿病大鼠血糖代谢平衡,降低血管氧化应激,缓解血管炎症。其机制可能与SIRT1有关,SIRT1对Nrf2与NOX4信号以及NF-κB信号的调节,可能在有氧运动和白藜芦醇改善糖尿病大鼠血管氧化应激和炎症中发挥积极的作用。
