脱硫石膏制备纳米级硫酸钙晶须的试验研究
2018-03-09吴叶高建明唐永波
吴叶,高建明,唐永波
(江苏省土木工程材料重点实验室,东南大学 材料科学与工程学院,江苏 南京 210096)
我国燃煤电厂大多采用湿法脱硫工艺,这一工艺产生的大量脱硫石膏占用耕地,污染环境[1]。脱硫石膏等工业副产石膏的资源化利用刻不容缓。此外,合理利用脱硫石膏不仅能够节约天然石膏,还可以减少环境污染,同时能够变废为宝,具有重要的社会价值。
硫酸钙晶须分散好,尺寸均匀,结构稳定,具有优良的化学稳定性,而且低毒,由于生产原料价格低廉,其生产成本低,仅是SiC的1/300~1/200[2],是一种性价比很高的材料,被广泛应用于造纸、塑料、橡胶、建筑材料等领域[3-4]。以脱硫石膏为原料制备硫酸钙晶须具有重要的意义。许多学者[5-6]以无机盐的水溶液为溶剂,在常压下成功制备硫酸钙晶须,这些盐包括:NaCl、KCl、MgCl2、CaCl2等。但是,常压盐法制备的硫酸钙晶须直径较大,长径较短。Guan和Jiang[7]利用丙三醇水溶液制备出硫酸钙晶须,研究了丙三醇浓度对体系中水活度的影响。HeHua[8]利用水热法以磷石膏为原料,研究了不同丙三醇与水体积比对硫酸钙晶须形貌的影响。本文以脱硫石膏为原料,以丙三醇水溶液为溶剂,研究了温度、丙三醇浓度、原料粒度和晶种对石膏晶须形貌的影响,成功制备出高长径比的硫酸钙晶须,平均直径为176.40~248.98 nm,长径比达到206.50~311.08,晶须表面光滑,结构完整,尺寸均匀,对硫酸钙晶须的工业化生产具有重要指导意义。
1 试验
1.1 原材料
脱硫石膏:南京一夫材料股份有限公司,其主要化学成分见表1,SEM照片如图1所示;丙三醇:纯度为99.5%;水:去离子水。

表1 脱硫石膏的主要化学成分 %

图1 脱硫石膏的SEM照片
1.2 试验方法
首先,将丙三醇与水按照一定的质量分数配制成溶剂,加入一定质量分数的脱硫石膏后,搅拌均匀形成悬浮液,然后移入高温高压反应釜中,保持恒温反应一段时间。反应过程中,保持一定速度持续搅拌反应釜中的料浆。当反应结束后,立即用预先准备好的开水洗涤硫酸钙晶须数遍,直至丙三醇洗净,对硫酸钙晶须进行脱水,立即在150℃下干燥数小时后取出、密封保存。
本文研究晶种对石膏晶须形貌的影响,将一部分脱硫石膏先移入高温高压反应釜中进行反应,反应完全后,立即打开反应釜,加入剩余部分的脱硫石膏,保持恒温反应一段时间,最后对硫酸钙晶须进行脱水、干燥,得到最终产品。为避免加入未反应原料对系统造成太大的温度扰动,先将剩余部分的脱硫石膏用烘箱加热至80℃再加入反应釜。
采用X射线衍射仪对硫酸钙晶须进行物相分析;采用场发射环境扫描电子显微镜观测硫酸钙晶须的微观形貌以及颗粒尺寸。通过统计分析计算晶须的平均长度、平均直径和长径比。
2 基本原理
2.1 晶体成核
2.1.1 成核率
单位时间单个体积内含有的大于临界尺寸的晶核数量被称为成核率[9]。经典的成核理论,均匀成核过程中自由能的变化可表示为[10]:
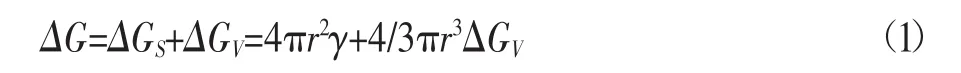
式中:ΔG——溶质小胚团和溶质的整体自由过剩能,J;
ΔGS——表面过剩自由能,J/m2;
ΔGV——体积过剩自由能,J/m3;
r——晶核尺寸,m;
γ——晶粒表面与溶液间的界面张力,N/m。
临界自由过剩能表示为:

式中:J——成核率,%;
T——温度,℃;
S——饱和度,%;
v——分子体积,m3。
从式(3)可以看出,成核率 J受 T、S、γ这3个变量的影响。
2.1.2 晶种
在过饱和溶液中引入小尺寸晶种是诱发结晶的较好方法,晶种并不是必须使用自身材料的结晶体,同晶异形体通常也能诱发结晶。文献[10]指出,二次成核随着晶种尺寸或晶种数量的增加而减少。潜伏期随着晶种尺寸的减小而减短,但不受晶种数量的影响。增加体系过饱和度能够增加二次成核,缩短潜伏期。晶体的尺寸能够影响二次成核,晶种越大,在扰动系统中,其接触能力和碰撞能力更大,能够生产更多的次级晶核;如果晶种尺寸太小,就会悬浮在停滞的液体中,很少能够与搅拌器或其它晶体的接触。晶种存在时,原料颗粒将与晶种结合而变得活跃,开始成核结晶。
2.2 丙三醇溶剂的影响机理
石膏溶解平衡方程如下所示:
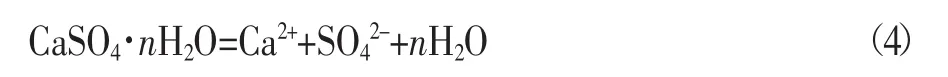
其中n=0、0.5和2,分别对应无水石膏、半水石膏和二水石膏。其溶度积常数(热力学平衡常数)可以表示为:

式中:Ksp——CaSO4·nH2O溶度积常数;
a——活度。
当溶液过饱和时,二水石膏在高温下转化为半水石膏,化学反应式如下[6-7]:

二水石膏向半水石膏转化取决于水的活度,丙三醇的加入影响溶液中水的活度[7]。文献[8]指出,丙三醇中的羟基可以与溶液中极少量的Ca2+结合,丙三醇的加入,可以促进二水硫酸钙的溶解,加快形成过饱和溶液;在丙三醇搬运和迁移作用下,Ca2+和SO42-与晶核结合,逐渐生长为晶须。同时,丙三醇在半水硫酸钙晶须的不同表面具有选择吸附性,使半水石膏硫酸钙沿C轴生长,最终形成纤维状晶体。
3 结果讨论与分析
3.1 不同反应温度对晶须形貌的影响
保持不变的试验条件:丙三醇浓度为60%,原料粒度中位径为35.95 μm,未添加晶种。二水硫酸钙向半水硫酸钙晶须的转化过程是一个吸热过程[11]。一方面,由式(3)可以看出,成核率与温度与过饱和度密切相关,当温度的升高时,溶液体系中过饱和度增加,成核的几率增大,成核越小,晶须生长速率加快。另一方面,随着温度升高,丙三醇与水分子之间的相互作用逐渐变得剧烈,体系中水的活度逐渐降低。由式(7)可知,在其它工艺参数相同的条件下,二水石膏转化成半水石膏的平衡常数变小,更易生成的硫酸钙晶须。不同反应温度对晶须形貌的影响见图2。

图2 不同反应温度对晶须形貌的影响
由图2可知,当温度为110℃时,生成的硫酸钙晶须平均直径为450.4 nm,平均长径比为156.84;当温度为120℃时,生成的硫酸钙晶须平均直径为368.8 nm,平均长径比为198.27;当温度为130℃时,生成的硫酸钙晶须平均直径为308.9 nm,平均长径比为225.6。因此,选取130℃为最优的反应温度。
3.2 不同丙三醇浓度对晶须形貌的影响
保持不变的试验条件:温度为120℃,原料粒度中位径为35.95 μm,未添加晶种,不同丙三醇浓度对晶须形貌的影响见图3。

图3 不同丙三醇浓度对晶须形貌的影响
由图3可知,溶剂中未添加丙三醇时,生成的硫酸钙晶须,平均直径较大,为1.20~1.56 μm,晶须平均长径比为31.6~50.6。随着溶剂中丙三醇浓度的增加,生成的硫酸钙晶须长度逐渐变长,直径逐渐减小,长径比增大。当溶剂中丙三醇浓度达为20%时,生成的硫酸钙晶须平均直径,为789.2~858.4 nm,平均长径比增大到55.3~78.7;当溶剂中丙三醇浓度达为40%时,生成的硫酸钙晶须平均直径为589.1~653.0 nm,平均长径比为89.3~126.8;当溶剂中丙三醇浓度为60%时,生成的硫酸钙晶须平均直径为186.4~260.0 nm,平均长径比为202.3~301.0;当溶剂中丙三醇浓度为80%时,生成的硫酸钙晶须平均直径为146.2~201.3 nm,长径比达到218.5~316.4 nm;当溶剂中丙三醇浓度为90%时,生成的硫酸钙晶须晶须长度有所变短,为 26.8~32.0μm,但平均直径显著变小,为94.0~120.4,长径比达到223.3~340.4。这是因为,随着丙三醇的加入,丙三醇中的羟基与溶液中的Ca2+结合,由式(4)可知,促进原料的溶解,原料的溶解度增大,晶体成核变小,生成的硫酸钙晶须变细,丙三醇浓度越大,原料溶解度越大,晶体成核越小,生成的硫酸钙晶须越细。当溶剂中丙三醇浓度为90%时,生成的硫酸钙晶须形成“扫帚”状,这可能是由于生成的晶须直径过细,比表面积过大,晶须的表面活化能过大,大量晶须团聚而成。考虑到成本问题,将溶剂中丙三醇浓度控制在60%。
图4为不同丙三醇浓度下样品的XRD图谱。
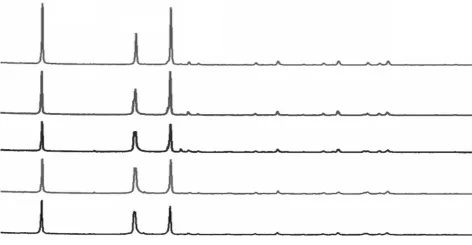
图4 不同丙三醇浓度下样品发的XRD图谱
由图4可以看出,不同丙三醇浓度下得到的样品具有类似的XRD图谱,特征衍射峰对应的物相均为CaSO4·0.5H2O,未发现其它杂质;XRD图谱中特征衍射峰的强度和晶体形貌有关[12]。随着丙三醇浓度的增加,(200)晶面与(400)晶面相关的衍射峰强度逐渐增大,(020)晶面与(204)晶面的衍射峰强度保持基本不变,这说明硫酸钙晶须沿着C轴生长。
3.3 不同脱硫石膏原料粒度对晶须形貌的影响
为了获得不同粒度的脱硫石膏原料,将脱硫石膏原料与水按一定的质量分数混合,用球磨机对原料进行湿磨,转速为300 r/min,球磨时间分别为0、15、30 min。料浆干燥后所得的原料粒径分布如图5所示。

图5 原料粒径分布
由图5可知,未球磨的原料粒径分布集中在10~100 μm之间,其中44.39 μm的含量最高,区间含量达到8.82%,粒径为33.48 μm的累积含量达44.62%,中位径为35.95 μm;在料浆的质量分数一定时,随着球磨时间的延长,原料的粒度逐渐减小,当球磨时间为15 min时,原料在40 μm以下的粒径分布增加,粒径为30.06 μm的累积含量达71.37%,中位径为16.35 μm;当球磨时间为30 min时,原料在40 μm以上的粒径分布大幅度减少,粒径为23.32 μm的累积含量达80.56%,中位径为9.81 μm。
保持不变的试验条件:反应温度为110℃,丙三醇浓度为40%,未添加晶种,不同原料粒度对晶须形貌的影响见图6。
由图6可见,原料未球磨时,生成的晶须直径较粗,为728.13~856.20 nm,平均长径比较小,为 65.86~93.12;当原料球磨15min后,生成晶须的直径变细,为625.43~708.96 nm,平均长径比增加,为92.10~125.51;随着球磨时间的进一步延长,当球磨时间为30 min时,生成的晶须平均直径为365.43~419.66 nm,平均长径比达到158.79~200.12。原因是,原料的粒度也影响反应体系中半水硫酸钙的过饱和度。随着原料的粒度减小,原料的比表面积增大,溶解速度增加,由式(4)可知,溶液体系中Ca2+和SO42-的浓度也随之增加,在温度相同的情况下,半水硫酸钙的过饱和度增大。随着体系过饱和度的增大,硫酸钙晶须的生长速度也随着增大,生成的硫酸钙晶须长径比也就越大,直径越小。

图6 不同原料粒度对晶须形貌的影响
3.4 晶种对石膏晶须形貌的影响
保持不变的试验条件:反应温度为95℃,丙三醇浓度为60%,原料粒度中位径为35.95 μm,晶种数量对晶须形貌的影响见图7。

图7 晶种数量对晶须形貌的影响
由图7可知,未添加晶种时,生成的硫酸钙晶须长度较短,但直径较细,平均直径为386.65~423.14 nm,平均长径比为133.82~155.43;随着晶种数量的增加,硫酸钙晶须的直径逐渐变粗,长度变长,但长径比有所增大。当晶种数量为16.67%时,晶须平均直径为453.85~521.68 nm,平均长径比为146.43~161.20;当晶种数量为33.33%时,晶须平均直径为547.54~669.59 nm,平均长径比为 155.95~166.36;当晶种数量为50.00%时,晶须平均直径为693.42~789.64 nm,平均长径比为145.37~179.50。这是因为,随着晶种数量的增加,二次成核减少,当原料加入反应体系中,原料颗粒与晶种结合,继续开始成核结晶,晶体生长在原来的晶种上。
4 结论
(1)以丙三醇水溶液为溶剂,成功制备出高长径比的半水硫酸钙晶须,试验得出最优的反应温度为130℃,丙三醇溶剂的浓度为60%,获得的硫酸钙晶须平均直径为176.40~248.98 nm,长径比为206.50~311.08,晶须表面光滑,结构完整,尺寸均匀,达到纳米级别。
(2)半水硫酸钙晶须受原料粒度与晶种的影响较大,随着原料粒度脱硫石膏减小,原料的比表面积增大,溶解速度增加,生成的硫酸钙晶须长径比越大,直径越小。
(3)晶种数量的增加使得硫酸钙晶须的直径逐渐变粗,但长径比略有增大。
[1] 潘荔,毛专建,杨帆.中国燃煤电厂脱硫石膏综合利用研究(下)[J].设备监理,2015(4):19-21.
[2] Zhu X F,Wang Y B,Wang X,et al.Integration of preparation and stabilization for hemihydrate calcium sulfate whiskers[J].Advanced Materials Research,2011,239-242:3074-3077.
[3] 王舒州,陈德玉,何玉龙,等.磷石膏制备硫酸钙晶须及其应用的研究[J].新型建筑材料,2016,43(3):5-9.
[4] 蒋慧媛.石膏晶须的制备及应用[J].上海建材,2014(2):19-20.
[5]Yang L C,Guan B H,Wu Z B.Characterization and precipitation mechanism of α-calcium sulfate hemihydrate growing out of FGD gypsum in salt solution[J].Science China Technological Sciences,2009,52(9):2688-2694.
[6] Guan B H,Yang L.Preparation of α-calcium sulfate hemihydrate from FGD gypsum in K,Mg-containing concentrated CaCl2,solution under mild conditions[J].Fuel,2009,88(7):1286-1293.
[7] Guan B H,Jiang G.Thermodynamic preparation window of alpha calcium sulfate hemihydrate from calcium sulfate dihydrate in non-electrolyte glycerol–water solution under mild conditions[J].Industrial & Engineering Chemistry Research,2013,50(23):13561-13567.
[8] He Hua.Effect of glycerol on the preparation of phosphogypsubased CaSO4·0.5H2O whiskers[J].Journal of Materials Science,2014,49(5):1957-1963.
[9] Sandhya S.Nucleation kinetics of the formation of low dimensionalcalcium sulfate dihydrate crystals in isopropyl alcohol medium[J].Crystal Research & Technology,2012,47(7):780-792.
[10] Mullin J W.Crystallization Fourth Edition[M].London:Butterworth Heinemann,2001:189-200.
[11] Bao Z,Li J,Wang W.Solubility of calcium sulfate in distiller liquor[J].Chemical Engineering,1995,23(5):21-25.
[12] Wang P,Lee E J,Park C S,et al.Calcium sulfate hemihydrate powders with a controlled morphology for use as bone cement[J].JournaloftheAmerican CeramicSociety,2008,91(6):2039-2042.
