打顶对烟草叶片多酚代谢及其关键酶的影响
2018-03-09杨银菊张彦王树声刘光亮许娜王程栋周培禄陈爱国
杨银菊,张彦,王树声,刘光亮,许娜,王程栋,周培禄,陈爱国
1 中国农业科学院烟草研究所/农业部烟草生物学与加工重点实验室,青岛 266101;
2 中国农业科学院研究生院,北京 100081
多酚类物质是植物中苯丙烷代谢途径重要的代谢产物。烟草叶片中主要的多酚类化合物为绿原酸、芸香苷和莨菪亭,其中绿原酸和芸香苷含量较高,可占总酚含量的75%~95%[1-2],其含量与烟草品质形成密切相关[3-4],可提高烟草植株应对逆境胁迫时的抗逆性和抗氧化性[5-6]。
打顶是烟草栽培过程中一项重要的农艺措施,对于烤烟产量和品质形成具有重要作用[7]。由于打顶去除了烟株顶端生长点,改变了烟株的源库关系,因此次生代谢和激素代谢等多个生物学过程都会发生变化[8]。打顶可以显著提高烟碱[9]和芳香胺[10]等次生代谢物的含量,同时也导致与激素代谢和机体防御有关的基因上调表达[11]。前人研究表明,红花大金元品种的多酚类物质含量高[12],是研究打顶诱导多酚积累的理想材料。前人研究了绿原酸等多酚类物质含量在打顶后的变化[13-14],但目前打顶对烟草多酚类物质合成及调控机制未见报道。本研究以红花大金元为试验材料,探讨不同时期打顶对烟叶中多酚类物质合成及其关键酶活性的影响,同时结合qRT-PCR分析了多酚类物质合成关键酶基因的表达量差异,旨在揭示打顶诱导多酚类化合物生物合成的调控机制,以期为定向提高烤烟品质提供参考。
1 材料与方法
1.1 供试材料
供试品种为红花大金元。红花大金元种子由中国农业科学院烟草研究所国家烟草种质资源中期库提供,经浸泡、灭菌、消毒后于28℃黑暗条件下催芽,沙培45d后进行移栽。盆栽试验于2016年9月20日至12月29日在中国农业科学院烟草研究所温室内进行,苗期日平均温度为25±1℃,现蕾到打顶期日平均气温25±1℃,盆高20cm,直径25cm,每盆装土8kg,基质(腐殖酸含量≥5.0%,有机质含量≥25.0%)与土(棕壤,有效氮、磷、钾含量分别为97.29mg/kg、8.84mg/kg、216.98mg/kg)1:1(v/v)混匀后装盆,每盆种植1株烟。
1.2 试验处理
分别在苗期(八叶一心期)和现蕾后10d(移栽后85d)设置打顶处理和不打顶处理,分别以同期不打顶处理为对照。每个处理种植25株;苗期打顶处理采用刀片将幼嫩的未展开叶片及以上茎顶端组织切除,现蕾后打顶处理于50%第一中心花开放时切除茎顶端(留叶18片)。
打顶后第1、3、6、9和12d,每处理分别选取3株生长正常一致的中部叶(苗期第4叶位,现蕾后10d第8叶位),作为3个生物学重复;去除主脉后烟叶置于液氮中速冻,保存于-80℃超低温冰箱中。基因定量分析采用打顶后第1d样品,酶活检测采用打顶后第1、3d的样品,多酚检测采用打顶后第1、3、6、9、12d 的样品。
1.3 测定方法
1.3.1 多酚类物质含量测定
参照YC/T 202-2006行业标准[15],用高效液相色谱法(HPLC)测定绿原酸、新绿原酸、隐绿原酸和芸香苷含量。
1.3.2 酶活性测定
采用紫外分光光度法利用PAL活性测定试剂盒(苏州科铭生物技术有限公司)测定苯丙氨酸解氨酶(phenylalanine ammonia-lyase,PAL)活性,参照Kong[16]的方法利用酶标仪测定肉桂酸4-羟化酶(cinnamic acid 4-hydroxylase,C4H)和4-香豆酸连接酶(4-coumarate-CoA ligase,4CL)活性。采用酶联免疫法(江苏科晶生物技术有限公司)测定多酚氧化酶(polyphenol oxidase,PPO)和过氧化物酶(peroxidase,POD)活性。
1.3.3 引物设计及表达量测定
根据qRT-PCR引物设计的要求,采用Primer 5.0软件进行引物设计(表1)。以Actin为内参基因[17],采用2-ΔΔCT法进行基因相对定量分析[18]。

表1 目的基因的引物序列Tab.1 Primer sequences of target genes
1.4 数据处理
采用SAS 9.1软件进行LSD多重比较法方差分析(P<0.05),Excel和Origin 9.1软件制作图表。
2 结果与分析
2.1 不同时期打顶对烟叶多酚类物质含量的影响
2.1.1 苗期打顶对烟叶多酚类物质含量的影响
由图1可知,打顶处理后1~12d内,打顶处理后烟叶中绿原酸、新绿原酸、隐绿原酸和芸香苷含量均呈现先增加后降低的趋势。除新绿原酸含量在打顶后第9d高于对照外,其余同期打顶处理后烟叶中多酚类物质含量均低于对照。
在打顶后第1d时,打顶处理烟叶多酚类物质含量与对照无显著差异,在打顶后第3d,打顶处理烟叶中多酚类物质含量除芸香苷外均显著低于对照,依次降低20.89%、16.56%和19.23%;在打顶后第6d,打顶处理的烟叶中4种酚类化合物与对照相比依次降低31.6%、13.24%、13.96%和10.75%,但除绿原酸外差异均不显著;在打顶后第9d,打顶处理的烟叶中新绿原酸含量显著高于对照,其它多酚类物质含量没有差异;在打顶后第12d,打顶处理烟叶中绿原酸、新绿原酸、隐绿原酸和芸香苷含量均显著低于对照,依次降低12.24%、17.07%、14.42%和14.67%。

图1 苗期打顶对烟叶多酚类物质含量的影响Fig.1 Effects of topping on the content of polyphenols in tobacco leaves at the seedling stage
2.1.2 现蕾后打顶对烟叶多酚类物质含量的影响
由图2可知,打顶处理后1~12d内,烟叶中4种多酚类物质含量变化表现出相似的规律,呈现先升高后降低的趋势,其中在打顶后第1d时,打顶处理烟叶多酚类物质含量与对照无显著差异,在打顶后第3d时,烟叶多酚类物质含量均最高,在打顶后3~9d急剧下降,在打顶后第9~12d时略微升高。同时,打顶处理的烟叶中4种多酚类物质含量在整个取样时间内均高于对照。
在打顶后第3d时,打顶处理烟叶中4种多酚类物质含量与对照相比均呈现显著性差异,依次升高60.79%、24.28%、59.27%和33.39%;在打顶后第6d时,打顶处理烟叶中绿原酸含量与对照相比呈现显著差异,升高37.61%,其他3种物质含量与对照相比差异均不显著;打顶后第9d时,打顶处理烟叶中绿原酸、隐绿原酸含量与对照无显著差异,其他3种酚类化合物含量均高于对照,但隐绿原酸含量未达到显著差异水平。

图2 现蕾后打顶对烟叶多酚类物质含量的影响Fig.2 Effects of topping on the content of polyphenols in tobacco leaves after the flower-bud appeared
2.2 不同时期打顶对烟叶多酚生物合成关键酶活性的影响
2.2.1 苗期打顶对烟叶多酚生物合成关键酶活性的影响
由图3可知,打顶后第1d时,打顶处理的烟株叶片中PAL活性显著高于对照,C4H略高于对照,但差异不显著,4CL活性显著低于对照;打顶后第3d时,打顶处理烟株叶片中4CL活性显著高于对照,PAL和C4H活性与对照无显著差异。

图3 苗期打顶对烟叶多酚合成关键酶活性的影响Fig.3 Effects of topping on the activity of key enzymes on the process of polyphenols synthesis in tobacco leaves at the seedling stage
2.2.2 现蕾后打顶对烟叶多酚生物合成关键酶活性的影响
由图4可知,打顶处理后1~3d内,烟株叶片中C4H和4CL活性呈现升高趋势,并且在打顶后第3d时,打顶处理烟株叶片中二者的活性均显著高于对照。打顶处理烟株叶片中PAL活性在打顶后第1d和第3d均显著高于对照,但随打顶时间的推进呈现下降趋势。

图4 现蕾后打顶对烟叶多酚合成关键酶活性的影响Fig.4 Effects of topping on the activity of key enzymes on the process of polyphenols synthesis in tobacco leaves after the flower-bud appeared
2.3 不同时期打顶对烟叶多酚降解关键酶活性的影响
2.3.1 苗期打顶对烟叶多酚降解关键酶活性的影响
由图5可知,打顶后1~3d内,烟株叶片PPO活性呈现升高的趋势,其中打顶后第3d出现显著增加,而POD活性则在打顶后1d出现显著增加。
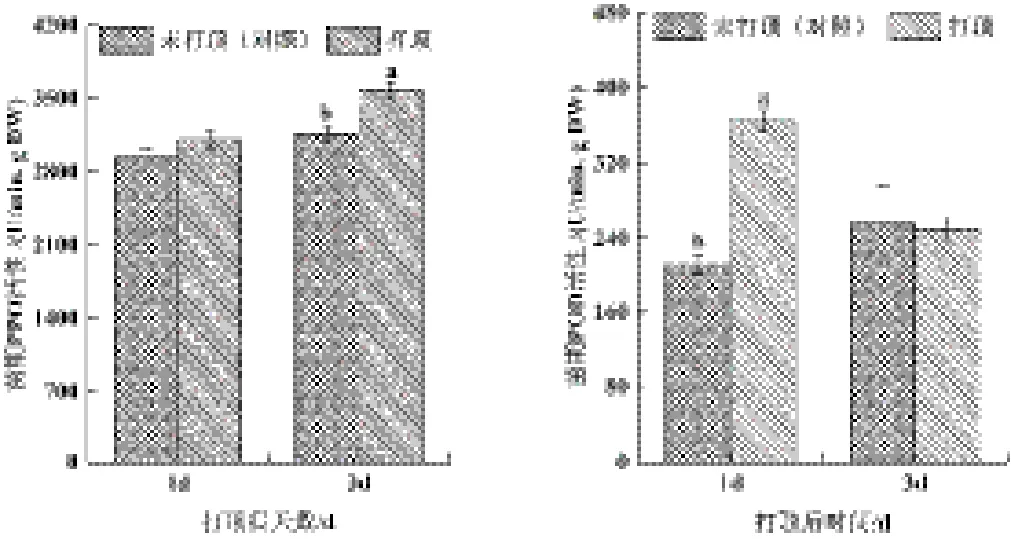
图5 苗期打顶对烟叶多酚降解关键酶活性的影响Fig.5 Effects of topping on the activity of key enzymes on the process of polyphenols degradation in tobacco leaves at the seedling stage
2.3.2 现蕾后打顶对烟叶多酚降解关键酶活性的影响
由图6可知,打顶后1~3d内,烟株叶片PPO活性呈现下降趋势,其中打顶后第3d出现显著降低,而POD活性则在打顶后1d出现显著增加。

图6 现蕾后打顶对烟草叶片多酚降解关键酶活性的影响Fig.6 Effects of topping on the activity of key enzymes on the process of polyphenols degradation in tobacco leaves after the flower-bud appeared
2.4 烟叶多酚生物合成关键酶基因表达分析
2.4.1 苗期打顶对烟叶多酚生物合成关键酶基因表达的影响
由图7可知,打顶后1d内,打顶处理烟叶中PAL家族4个成员均上调表达,其中,与不打顶处理相比PAL1、PAL2、PAL3和PAL4表达量显著上调,分别上调2.6倍、2.6倍、2.7和1.8倍。打顶处理烟株叶片C4H、4CL1、HCT(hydroxycinnamoyl CoA shikimate/quinate hydroxycinnamoyltransferase,羟基肉桂酰辅酶A编码基因)和HQT(hydroxycinnamoyl-CoA:quinate hydroxycinnamoyl transferase,羟基肉桂酰辅酶A:奎尼酸羟基肉桂酰转移酶编码基因)表达量上调幅度比较大,分别上调3.9、4.7、5.4、4.6倍。

图7 苗期打顶对烟叶多酚生物合成关键酶基因相对表达量的影响Fig.7 Effects of topping on the expression of polyphenols biosynthetic key enzyme genes in tobacco leaves at the seedling stage
2.4.2 现蕾后打顶对烟叶多酚生物合成关键酶基因表达的影响
由图8可知,打顶后1d内,打顶显著上调PAL2、PAL3、C4H、4CL1和C3H基因的表达,其中PAL2和PAL3上调幅度最大;打顶处理的烟株叶片PAL4、4CL2和HQT基因表达水平与对照相当;PAL1表达显著下调。
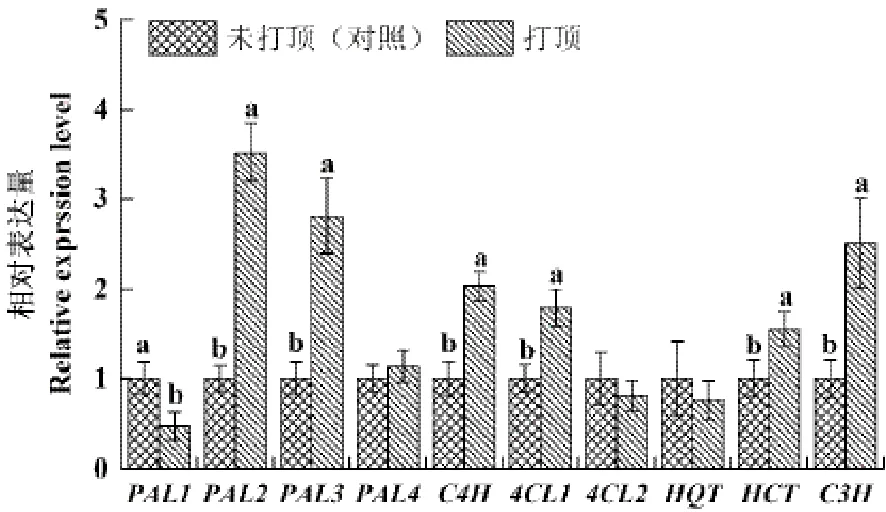
图8 现蕾后打顶对烟叶多酚生物合成关键酶基因相对表达量的影响Fig.8 Effects of topping on the expression of polyphenolsbiosynthetic key enzyme genes in tobacco leaves after the flowerbud appeared
3 讨论
3.1 不同时期打顶对烟叶多酚合成的影响
低温、机械损伤、紫外线、光照等环境胁迫诱导了植物体内多酚类物质的生物合成[12,19-21]。在烟草上,打顶是多酚快速积累的重要诱导因素之一,然而,从打顶的角度来研究多酚合成代谢未见报道。本研究探讨了不同时期打顶后多酚的动态变化趋势,同时对多酚合成和降解关键酶活性和基因表达进行分析,结果表明苗期打顶后,烟叶中多酚类物质含量在打顶后第3d时显著低于对照,之后呈逐渐上升的趋势;现蕾后打顶处理可以短暂的提高烟叶多酚类物质含量,之后随生育期的推进多酚呈现先下降后升高的趋势,这与袁卫瑜等[13]的研究结果一致。不同时期打顶后烟叶多酚含量表现出相反的规律,其中除了打顶这一主要影响因素外,还涉及烟株自身生长发育的影响、外界环境因素的影响。本实验是在温室条件下进行的,实验条件相对稳定。但是由于实验周期长,因此不能排除打顶与温度等其他因素互作。杨慧芹等[22]研究发现在移栽-团棵期,处理的前20d内均温20℃和均温16℃处理的总酚含量均显著低于均温18℃的处理,而团棵-现蕾期,温度越低多酚积累量越少,说明不同时期烟叶多酚积累的最适温度具有差异性,但是杨慧芹等[22]研究中不同生育期所设定温度不一样(移栽-团棵期为20、18和16℃,团棵-现蕾期为21、23和25℃),不能说明不同时期烟叶多酚含量对温度的响应具有差异性。而目前还没有苗期打顶方面的文献报导,因此在后续研究中还应深入研究温度、生育期等影响因素是否与打顶互作从而造成不同时期烟叶多酚含量对打顶的差异响应,最终锁定关键因子,解析不同时期打顶后烟叶多酚含量差异响应的影响机制。
3.2 打顶对烟叶多酚合成的调控机制
PAL是苯丙烷代谢的第一个关键酶。各种环境因素包括病原物侵染、组织损伤、紫外线照射、重金属污染、低温和低氮、低磷都会使PAL活性上升[23]。杨慧芹等[24]研究发现干旱处理下PAL活性与总酚含量的变化保持一致,低温处理后虽然总酚含量持续下降,但PAL活性升高,其基因表达量在胁迫初期也快速上调。本研究发现与对照相比,苗期打顶处理烟叶中多酚类物质含量下降,PAL活性升高,PPO和POD活性显著增加;现蕾后打顶处理多酚类物质含量升高,PAL活性升高,POD活性增加低于苗期打顶处理,PPO活性在不打顶处理中活性显著增加。因此,多酚类物质含量在不同时期打顶后的相反的表现,与多酚降解酶的调控密切相关。
4CL是苯丙烷代谢的关键酶,调控苯丙烷途径碳代谢流的方向,对植物生长发育起重要作用[25]。研究发现低温[22]和干旱[24]胁迫下4CL活性达到最高时,多酚类物质含量也达到最高。本研究结果也表明,打顶后4CL的活性与多酚类物质含量变化趋势一致,苗期打顶后4CL活性降低,多酚类物质含量也降低,现蕾后打顶处理4CL活性较高,多酚类物质含量也较高。
烟株在正常生长发育过程中叶片多酚类物质含量随生长和成熟度的增加而增加,在烟叶达到生理成熟后开始下降,并且受打顶措施调控[13,26-28]。本研究不同时期打顶的实验结果也证明了此现象。苗期打顶处理能显著降低烟叶中绿原酸等多酚的含量,而现蕾后打顶处理能显著提高烟叶多酚类物质含量,说明打顶诱导多酚生物合成与应激反应无关,除了受机械损伤诱导外,还与生育期有关。
烟草PAL基因家族由4个成员组成,其中PAL1和PAL4分为一个亚家族,PAL2和PAL3分为一个亚家族[29]。本研究表明,PAL2、PAL3在不同时期打顶均表达上调,与PAL活性变化一致,说明打顶诱导了PAL2、PAL3基因表达,从而增强了PAL活性。烟草4CL家族有两个成员[24],苗期打顶后,4CL1和4CL2表达均显著上调,其中4CL1上调幅度较大;现蕾后打顶,仅4CL1表达显著上调,说明打顶诱导了4CL1的上调表达,但多酚类物质含量的变化及4CL的活性并不与4CL1的基因表达水平一致,其调控机理有待进一步研究。
4 结论
苗期和现蕾后两个时期打顶后烟叶PAL、POD活性均升高,其中现蕾后打顶处理烟叶POD活性增加低于苗期打顶处理,而烟叶多酚类物质含量和PPO活性在两个时期打顶后呈现相反的变化。因此,打顶诱导烟叶多酚合成与生育期及多酚降解酶的调控密切相关。
[1] 李力,杨涓,戴亚,等.烤烟中绿原酸、莨菪亭和芸香苷的分布研究[J].中国烟草学报,2008,14(4):13-17.LI Li,YANG Juan,DAI Ya,et al.Study on distribution of chlorogenic acid,scopletin,and rutin in flue-cured tobacco[J].Acta Tabacaria Sinica,2008,14(4):13-17.
[2] 赵铭钦,陈红华,陈秋会,等.不同陈化条件下烤烟多酚类物质的动态变化及其与化学成分的相关分析[J].中国烟草学报,2007,13(4):16-18.ZHAO Mingqin,CHEN Honghua,CHEN Qiuhui,et al.Dynamic changes of polyphenols and its correlation with other chemical components in flue-cured tobacco leaves under different aging conditions[J].Acta Tabacaria Sinica,2007,13(4):16-18.
[3] 龙章德,林顺顺,田兆福,等.烟草多酚类化合物对卷烟品质的影响[J].食品与机械,2013,(6):41-44.LONG Zhangde,LIN Shunshun,TIAN Zhaofu,et al.Study on the influence of polyphenol compounds on the tobacco quality [J].Food &Machinery,2013,(6):41-44.
[4] 周恒,许自成,赵会纳,等.烟草多酚类物质的研究进展[J].浙江农业科学,2009,(5):949-953,955.ZHOU Heng,XU Zicheng,ZHAO Huina,et al.Advances in study on polyphenol compounds in tobacco[J].Journal of Zhejiang Agricultural Sciences,2009,(5):949-953,955.
[5] TAMAGNONE L,MERRIDA A,STACEY N,et al.Inhibition of phenolic acid metabolism results in precocious cell death and altered cell morphology in leaves of transgenic tobacco plants[J].Plant Cell,1998,10(11):1801-1816.
[6] SAWA T,NAKAO M,AKAIKE T,et al.Alkylperoxyl radicalscavenging activity of various flavonoids and other phenolic compounds:Implications for the anti-tumor-promoter effect of vegetables[J].Agric Food Chem.1999,47(2):397-402.
[7] 葛龙,易克,韩定国,等.打顶留叶数对烤烟品质的影响[J].湖南农业科学,2009,(8):21-23.GE Long,YI Ke,HAN Dingguo,et al.Eff ects of Topping and the number of leaves remained on partial carbohydrate content and quality of flue-cured tobacco[J].Hunan Agricultural Sciences,2009(8):21-23.
[8] YANG H,SU F,WANG J,et al.Comparative shotgun proteomic profiles for identification of differentially expressed proteins in response to topping in Nicotiana tabacum leaves[J].Acta Physiologiae Plantarum,2017,39(1):13.
[9] WANG S,SHI Q,Li W,et al.Nicotine Concentration in Leaves of Flue-cured Tobacco Plants as Aff ected by Removal of the Shoot Apex and Lateral Buds[J].Chinese Bulletin of Botany,2008,50(8):958.
[10] GEUNS J M,SMETS R,STRUYF T,et al.Apical dominance in Pssuipt-transformed tobacco[J].Phytochemistry,2001,58(6):911-921.
[11] Qi Y C,Lei M,Wang F F,et al.Identification and characterization of diff erentially expressed genes from tobacco roots after decapitation[J].Acta Physiologiae Plantarum,2012,34(2):479-493.
[12] 彭东.光质、光强对烤烟苯丙烷代谢关键酶及多酚产物的影响[D].中国农业科学院,2013.PENG Dong.The effect of light quality and light intensity on related enzyme activities and polyphenol products of phenylpropanoid metabolic pathway in flue-cured tobacco[D].Chinese Academy of Agricultural Sciences,2013.
[13] 袁卫瑜,王兴德,李军营,等.烤烟生长过程中多酚类物质及其相关酶活性的变化[J].西南农业学报,2017,30(7):1528-1532.YUAN Weiyu,WANG Xingde,LI Junying,et al.Changes of polyphenols and Related enzyme activities during flue-cured tobacco growth[J].Southwest China Journal of Agricultural Sciences,2017,30(7):1528-1532.
[14] 陈爱国,彭东,陈向东,等.烤烟苯丙烷代谢中相关酶活性和多酚产物的关系研究[C].山东植物生理学会第七次代表大会暨植物生物学与现代农业研讨会论文集.2012:235-241.CHEN Aiguo,PENG Dong,CHEN Xiangdong,et al.Studies on relationships of related enyzme activities and polypenol products of phenylpropanoid metabolic pathway in flue-cured tobcco[C].The 7th Congress and Proceedings of the Symposium on Plant Biology and Modern Agriculture of Chinese Association for Physiological Sciences.2012:235-241.
[15] 国家烟草专卖局.YC/T 202-2006,烟草及烟草制品 多酚类化合物绿原酸、莨菪亭和芸香苷的测定[S].北京:中国标准出版社,2006:1-12.State Tobacco Monopoly Administration.YC/T 202-2006,Determination of polyphenols chlorogenic acid,scopoletin and rutin of tobacco and tobacco products[S].Beijing:Standards Press of China,2006:1-12.
[16] KONG D X,LI Y Q,BAI M,et al.Correlation between the dynamic accumulation of the main eff ective components and their associated regulatory enzyme activities at different growth stages in Lonicera japonica,Thunb[J].Industrial Crops &Products,2017,96:16-22.
[17] LI R,ISLAM S U,WU Z,et al.Bensulfuron-methyl treatment of soil sffects the infestation of whitefly,aphid,and tobacco mosaic viruson Nicotiana tabacum:[J].Frontiers in Plant Science,2016,7(2):1954-1970.
[18] KENNETH J,THOMAS D S.Analysis of relative gene expression data using real-time quantitative PCR and the 2-△△Ctmethod.Methods,2001,25:402-408.
[19] LEWIS C E,WALER J R L,Lancaster J E.Changes in anthocyanin,flavonoid and phenolic acid concentrations during development and storage of coloured potato(Solanum tuberosum L.)tubers [J].Journal of the Science of Food and Agriculture,1999,79(2):311-316.
[20] REYES L F,Cisneros-Zevallos L.Wounding stress increases the phenolic content and antioxidant capacity of purple-flesh potatoes(Solanum tuberosum L.)[J].Journal of Agricultural &Food Chemistry,2003,51(18):5296-5300.
[21] ClE C,HILL L M,NIGGEWEG R,et al.Modulation of chlorogenic acid biosynthesis in Solanum lycopersicum;consequences for phenolic accumulation and UV-tolerance[J].Phytochemistry,2008,69(11):2149-2156.
[22] 杨慧芹,王莎莎,金云峰,等.生长温度对不同生育期烟草多酚物质代谢的影响[J].基因组学与应用生物学,2015,34(09):2225-2244.YANG Huiqin,WANG Shasha,JIN Yunfeng,et al.Effects of Different Growth Temperature on Polyphenols Metabolism in Tobacco(Nicotiana tobacum L.)Leaves at Diff erent Growth Stages[J].Genomics and Applied Biology,2015,34(09):2225-2244.
[23] ZHANG X,LIU C J.Multifaceted regulations of gateway enzyme phenylalanine ammonia-lyase in the biosynthesis of phenylpropanoids[J].Molecular plant,2015,8(1):17-27.
[24] 杨慧芹,王莎莎,张建波,等.烟草多酚代谢对干旱和低温胁迫的响应差异及其比较[J].基因组学与应用生物学,2015,34(03):645-654.YANG Huiqin,WANG Shasha,ZHANG Jianbo,et al.Diff erential Response and Comparison of Polyphenols Metabolism in Tobacco Seedling under the Stresses of Drought and Low Temperature [J].Genomics and Applied Biology,2015,34(03):645-654.
[25] LEE D,DOUGLAS C J.Two Divergent Members of a Tobacco 4-Coumarate:Coenzyme A Ligase(4CL)Gene Family:cDNA Structure,Gene Inheritance and Expression,and Properties of Recombinant Proteins[J].Plant Physiology,1996,112(1):193-205.
[26] 张秋芳,唐莉娜,邓启明,等.烟草生长过程中多酚类物质累积及相关酶活性变化研究[C].华东六省一市生物化学与分子生物学学会2006年学术交流会论文集.2006.ZHANG Qiufang,TANG Lina,DENG Qiming,et al.Study on the A Proceedings of the 2006 Symposium on Biochemistry and Molecular Biology in East China ccumulation of polyphenols and the activities of related enzymes during tobacco growth[C].A Proceedings of the 2006 Symposium on Biochemistry and Molecular Biology in East China.2006.
[27] 闻刚,赵铭钦,李小勇,等.烤烟生长过程中多酚及相关酶活性的动态变化[J].江西农业学报,2013,25(2):98-100.WEN Gang,ZHAO Mingqin,LI Xiaoyong,et al.Dynamic changes of polyphenols and related enzyme activities during tobacco growth[J].Acta Agriculturae Jiangxi,2013,25(2):98-100.
[28] 刘阳,高丽君,蔡宪杰,等.采收成熟度对烤烟多酚含量和组成的影响[J].烟草科技,2011,(8):73-78.LIU Yang,GAO Lijun,CAI Xianjie,et al.Effects of Maturity of Harvested Flue cured Tobacco on its Polyphenol Content and Composition[J].Tobacco Science &Technology,2011,(8):73-78.
[29] REICHERT A I,HE X Z,DIXON R A.Phenylalanine ammonialyase(PAL)from tobacco(Nicotiana tabacum):characterization of the four tobacco PAL genes and active heterotetrameric enzymes[J].Biochemical Journal,2009,424(2):233-242.
