氯化血红素诱导烟草抵御碱胁迫的初步研究
2018-03-09刘紫薇杨庆根张朝高琴肖先仪尤本武陈学平
刘紫薇,杨庆根,张朝,高琴,肖先仪,尤本武,陈学平
1 中国科学技术大学烟草与健康研究中心,安徽合肥市徽州大道1129号,230051;
2 江西省烟草公司赣州市公司,江西赣州市青年路40号,341000;
3 安徽中烟工业有限责任公司技术中心,安徽合肥市天达路9号,230088;
4 安徽皖南烟叶有限责任公司,宣城市鳌峰中路72号,242000
据不完全统计,全世界6%的陆地和20%的灌溉农用地是盐碱地,预计至2050年将有50%以上的耕地发生盐碱化[1]。土地盐碱化影响生态系统的稳定和生物多样性,已成为世界性的环境问题。盐碱胁迫影响植物生长发育,导致植物产量和品质下降,是主要的非生物逆境因素之一[2]。由碱性盐造成的土壤碱化除渗透胁迫、离子毒害、营养缺失外,还存在高pH危害,比由中性盐造成的土壤盐化问题更加严重[3]。赵楠等[4]研究表明随碱胁迫浓度升高碱蓬种子萌发以及幼苗生长均降低;碱胁迫下枸杞活性氧代谢、离子均衡等方面均遭到比盐胁迫下更大的破坏[5];低浓度盐胁迫可促进虎尾草生物量增加,而相同碱胁迫则会降低其生物量[6]。植物对盐碱胁迫的适应过程复杂,研究植物对碱胁迫的响应机制对改良利用盐碱土地具有重要意义。
血红素加氧酶(heme oxygenase,HO)是催化降解血红素(Heme)的起始酶和限速酶,存在3种不同亚型(HO-1、HO-2和HO-3)。研究表明HO在植物中有多种重要功能,Lin等[7]研究发现HO-1参与黄瓜不定根的伸长。Chen等[8]研究表明,小麦幼苗叶片中H2O2通过诱导HO的表达以提高氧化胁迫适应性。Cui等[9]研究发现苜蓿HO-1参与了水杨酸对重金属镉造成的氧化胁迫的缓解。
氯化血红素(hemin)是天然血红素的体外纯化形式,其化学性质与血红素类似。Hemin既是HO-1的底物,同时又是HO-1的促进剂,能诱导HO-1的活性,提高植物抵抗氧化胁迫的能力并调节植物代谢[10]。研究表明,血红素可诱导番茄侧根形成[11],缓解盐胁迫对小麦幼苗[12]和烟草幼苗[13]的伤害。但目前有关氯化血红素诱导植物抵御碱胁迫的研究尚未见报道。本研究通过向培养液中加入Na2CO3进行烟苗的碱协迫实验,研究不同浓度hemin预处理对烟株抵御碱胁迫的影响,并测定烟株抗氧化酶活力、抗氧化物质和抗渗透物质含量、无机离子吸收和转运以及相关基因表达以探究外源hemin诱导烟株抵御碱胁迫的机理。
1 材料与方法
1.1 材料与试剂
烟草品种“云烟 87”由安徽农业科学院提供;氯化血红素由南京农业大学提供;RNA提取试剂盒和荧光定量PCR试剂盒购于北京天根生物技术有限公司;Taq聚合酶和反转录试剂盒购于大连TaKaRa公司。
1.2 生长条件与处理
将消毒后的烟草种子均匀撒于经霍格兰营养液润湿的灭菌珍珠岩中,发芽后选取生长一致的3~4片真叶龄幼苗移至含有相同体积营养液的育苗盒中。分4组,每组设3盒重复,每盒12株,温度(28±2)℃,16h光照/d。预处理24h后,将碱胁迫组和hemin组烟苗移入含有10mmol/LNa2CO3的营养液中,同时对照组更换营养液。具体操作如表1所示。碱胁迫10d后观察烟株表型,并拍照取样,提取RNA,进行生理指标测定。所有实验均设置3次重复。

表1 水培条件Tab.1 Hydroponics culture
1.3 生理指标测定
1.3.1 生物量及相对含水量测定
取出完整烟株后用去离子水冲洗,滤纸吸干叶片及根部水分,称取鲜重,量取根长。相对含水量测定采用李玲等[14]方法。
1.3.2 丙二醛(MDA)含量及相对电导率测定
相对电导率测定采用张清莉等[15]的方法,MDA测定采用硫代巴比妥酸比色法[16]。
1.3.3 抗氧化酶活力测定
SOD活力测定采用张清莉等[15]的方法;POD活力测定采用李玲等[14]的方法;APX活力测定采用邹琦等[17]的方法;CAT活力测定参照南京建成生物试剂公司CAT测试试剂盒说明书。
1.3.4 光合色素含量和根系活力测定
光合色素含量测定采用丙酮提取法[18],根系活力测定采用氯化三苯基四氮唑(TTC)法[17]。
1.3.5 谷胱甘肽(GSH)和抗坏血酸(AsA)含量测定
GSH含量测定参照南京建成生物工程研究所GSH测试盒说明书;AsA含量测定采用李玲等[14]的方法。
1.3.6 脯氨酸、可溶性糖、可溶性蛋白及有机酸含量测定
脯氨酸、可溶性糖、可溶性蛋白含量测定分别采用酸性茚三酮法[19]、蒽酮法[17]和考马斯亮蓝法[17]。有机酸含量测定采用李玲等[14]的方法。
1.3.7 Na+、K+、Ca2+、Mg2+ 含量测定
用去离子水冲洗植株3次,滤纸吸干后置于105℃烘箱杀青15min,后于80℃烘干至恒重。根和叶分别研磨成粉,利用Optima 7300DV等离子体原子发射光谱仪测定各元素含量。
1.3.8 相对定量PCR
茎叶混合物的总RNA提取参照植物总RNA提取试剂盒说明书。RNA反转录参照TaKaRa反转录试剂盒说明书。相对定量PCR测定参照北京天根公司SuperReal PreMix Plus(SYBR Green)试剂盒说明书。应用LightCycler96并设定两步法PCR反应程序进行反应。内参基因为β-tubulin,目的基因为NtPDR1、NtPDR3、NtNAC和NtGSH1,引物序列见表2。

表2 基因引物序列Tab.2 Gene sequence of primers
1.4 数据分析
实验数据表示为平均值±标准偏差,数据分析采用单因素方差分析,置信区间P<0.05,统计分析软件使用origin 9.1。
2 结果与讨论
2.1 hemin对烟株生长的影响
如图1所示,与对照组相比,碱胁迫组烟株生长受到抑制,叶片变小(图1A,B)、发黄(图1A,B),鲜重(图1C)、根长(图1D)及相对含水量(图1E)较对照组分别降低了59.00%,50.40%,19.60%。而经hemin处理后,烟株鲜重和根长的生长抑制以及叶片发黄都得到明显缓解,且相对含水量得到提高。经1μmol/L hemin处理的烟株鲜重(图1C)和根长(图1D)较碱胁迫组分别增加了64.05%和47.56%,2μmol/L hemin处理的烟株鲜重(图1C)和根长(图1D)较胁迫组分别增加了47.80%和32.91%,经1μmol/L hemin和2μmol/L hemin处理后相对含水量也分别增加了17.01%%,17.28%(图1E)。

图1 碱胁迫下hemin对烟株长势(A,B),鲜重(C),根长(D)及相对含水量(E)的影响Fig.1 Effect of hemin on the growth(A,B),fresh weight(C),root length(D)and relative water content(E)of tobacco seedlings under alkali stress
2.2 hemin对光合色素含量及根系活力的影响
如图2A所示,与对照组相比,碱胁迫下烟株的叶绿素a,叶绿素b,类胡萝卜素含量分别减少了73.49%,67.66%,68.86%。经1μmol/L hemin,2μmol/L hemin处理后较碱胁迫组烟株叶绿素a含量分别增加了20.29%,75.80%,叶绿素b含量分别增加了13.98%,47.81%,类胡萝卜素含量分别增加了23.45%,71.52%。受到碱胁迫后,烟株的根系活力较对照组降低了79.37%,而经1μmol/L hemin,2μmol/L hemin处理后根系活力较碱胁迫组分别升高了132.71%,129.00%(图2B)。

图2 对照组、碱胁迫组、hemin组烟株光合色素含量(A)和根系活力(B)Fig.2 Photosynthetic pigment content(A)and root activity(B)in the control,alkali stress and hemin groups
2.3 hemin对氧化胁迫损伤的影响
受到碱胁迫后,烟株体内MDA含量(图3A)以及相对电导率(图3B)较对照组均有所升高。而经1μmol/L hemin,2μmol/L hemin 处理后,与碱胁迫组相比,MDA含量(图3A)分别减少了9.62%,10.84%,而相对电导率(图3B)分别降低了15.97%和36.76%。
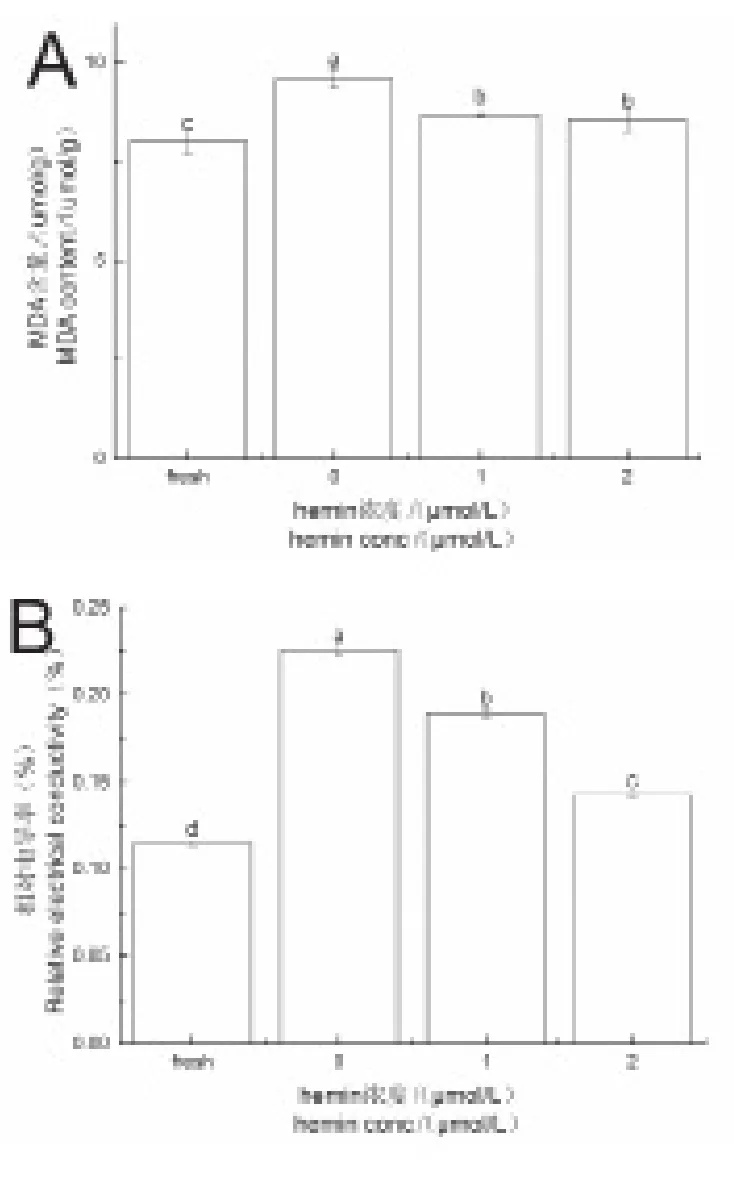
图3 对照组、碱胁迫组、hemin组MDA含量(A)和相对电导率差异(B)Fig.3 MDA content(A)and relative electrical conductivity(B)in the natural,alkali stress and hemin groups
2.4 hemin对抗氧化酶活力的影响
如图4A所示,碱胁迫下烟株SOD活力较对照组降低了 44.22%,经1μmol/L hemin,2μmol/L hemin处理后SOD活力较碱胁迫组分别升高了23.76%,62.96%。如4B所示,受到碱胁迫后烟株POD活力较对照组有小幅度升高(19.07%),而经1μmol/L hemin,2μmol/L hemin处理后POD活力大幅度提升,与碱胁迫组相比,分别升高了221.26%,198.54%。如图4C所示,碱胁迫组烟株CAT活力较对照组降低了 54.99%,而经1μmol/L hemin,2μmol/L hemin处理后CAT活力较碱胁迫组分别升高了71.51%,36.89%。如图4D所示,碱胁迫处理后烟株APX活力较对照组降低了31.90%,经1μmol/L hemin,2μmol/L hemin处理后APX活力较碱胁迫组分别升高了72.89%,67.71%。
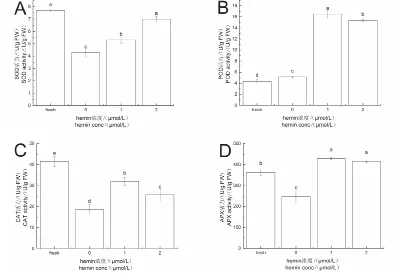
图4 对照组、碱胁迫组、hemin组烟株SOD(A),POD(B),CAT(C)和APX(D)活力Fig.4 Activity of SOD(A),POD(B),CAT(C)and APX(D)in the control,alkali stress and hemin groups
2.5 hemin对抗氧化物质含量的影响
如图5A所示,与对照组相比,碱胁迫组还原型AsA和脱氢AsA含量分别增加了8.99%,38.45%。经1μmol/L hemin预处理后,其还原型AsA含量比碱胁迫组减少了63.08%,脱氢AsA含量增加了16.96%;2μmol/L hemin预处理后,还原型AsA含量减少了40.82%,而脱氢AsA增加了33.18%。如图5B所示,烟株受到碱胁迫后,GSH含量较对照组增加了 26.88%,经1μmol/L hemin,2μmol/L hemin 处理后烟株体内GSH含量较碱胁迫组显著下降,分别下降了50.87%,48.50%。
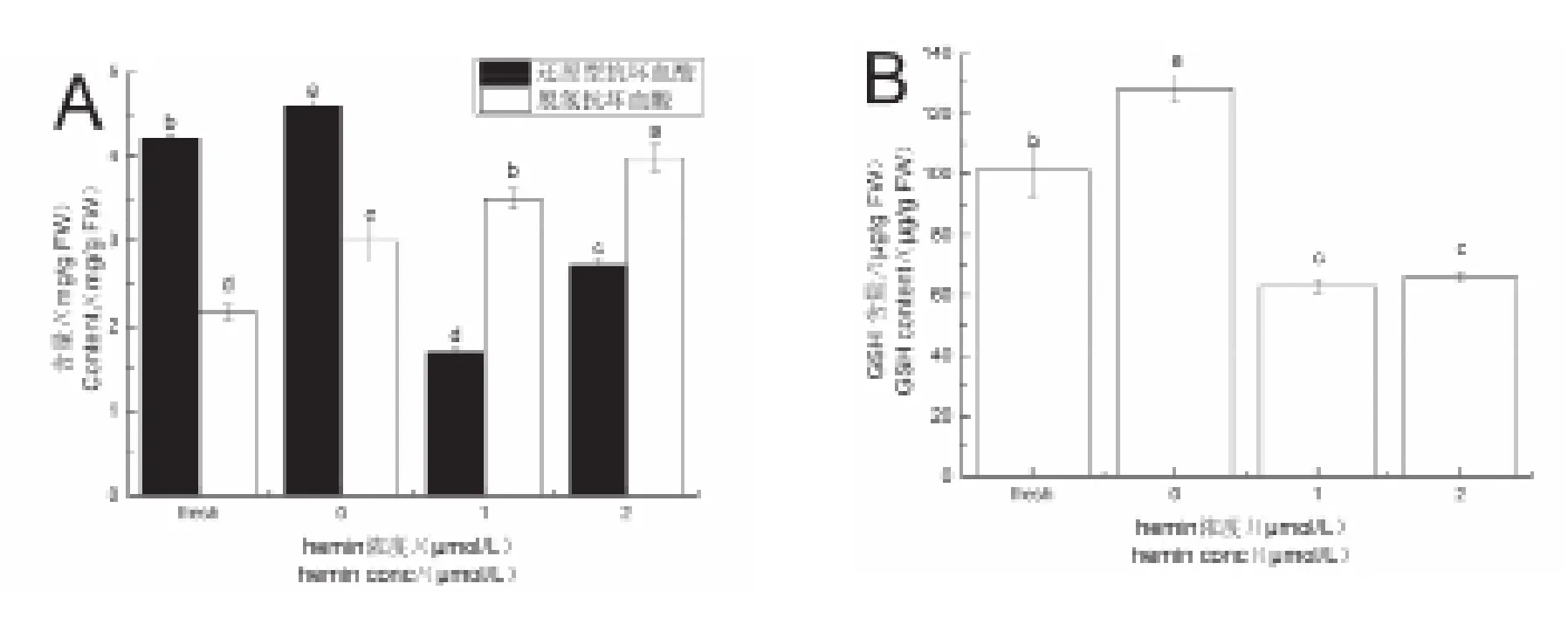
图5 对照组、碱胁迫组、hemin组烟株AsA(A),GSH(B)含量Fig.5 Contents of AsA(A)and GSH(B)in the control,alkali stress and hemin groups
2.6 hemin对渗透调节物质含量的影响
如图6A所示,烟株受到碱胁迫后,脯氨酸含量比对照组增加了271.86%,经1μmol/L hemin处理后烟株体内脯氨酸较碱胁迫组增加了300.54%,2μmol/L hemin处理后脯氨酸含量积累较少,增加了26.37%。如图6B所示,碱胁迫下,烟株体内可溶性糖含量较对照组减少了34.05%,经1μmol/L hemin,2μmol/L hemin处理后可溶性糖含量较碱胁迫组分别增加了49.07%,9.38%。如图6C所示,烟株体内可溶性蛋白含量在受到碱胁迫后较对照组降低了48.95%,而经1μmol/L hemin,2μmol/L hemin处理后,可溶性蛋白含量较碱胁迫组分别增加了30.12%,16.87%。如图6D所示,受到碱胁迫后,烟株叶部有机酸含量较对照组增加了27.78%,而根部有机酸含量则减少了24.81%。经hemin处理后,叶部和根部有机酸含量较碱胁迫组均出现下降。1μmol/L hemin处理后叶部和根部有机酸含量分别减少了15.55%,28.11%,2μmol/L hemin处理后叶部和根部有机酸含量分别减少了13.80%,36.61%。

图6 对照组、碱胁迫组、hemin组烟株脯氨酸含量(A),可溶性糖含量(B)和可溶性蛋白含量(C)及有机酸含量(D)Fig.6 Contents of prolinecontent(A),soluble sugar(B),soluble protein(C)and organic acid(D)in the control,alkali stress and hemin groups
2.7 hemin对离子含量的影响
如图7A所示,受到碱胁迫后烟株体内Na+大量积累,相比于对照组叶部和根部Na+分别增加了133.94%和35.65%。经1μmol/L hemin,2μmol/L hemin处理后,叶部Na+含量较碱胁迫组分别减少了16.56%和21.98%,根部Na+含量分别减少了17.05%和18.94%。如图7B所示,碱胁迫组叶部和根部K+含量较对照组都有所降低,经1μmol/L hemin,2μmol/L hemin 处理后,K+的吸收得以提高,叶部较碱胁迫组分别增加了17.01%和14.41%,根部分别增加了42.46%和28.94%。此外,经hemin处理后,烟株根部和叶部的K+/Na+比均有提高(图7C)。如图7D所示,碱胁迫下烟株体内Ca2+含量大量降低,叶部和根部较对照组分别减少了48.02%和52.45%,而经hemin处理后叶部和根部Ca2+含量较碱胁迫组均得以增加。其中1μmol/L hemin处理后分别增加了50.97%和59.98%,2μmol/L hemin处理后分别增加了37.47%和41.07%。如图7E所示,受到碱胁迫后烟株体内Mg2+含量降低,叶部和根部相比于对照组分别减少了42.86%和43.59%。经1μmol/L hemin,2μmol/L hemin处理后,较碱胁迫组叶部Mg2+含量分别增加了40.99%和24.88%,根部Mg2+含量分别增加了65.04%和49.22%。
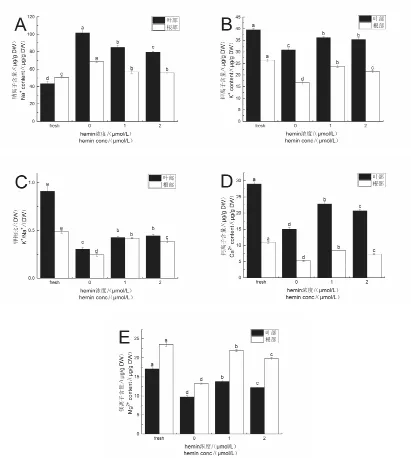
图7 对照组、碱胁迫组、hemin组烟株Na+(A)、K+(B)、K+/Na+(C)、Ca2+(D)和Mg2+(E)含量Fig.7Na+ content(A),K+ content(B),K+/Na+(C),Ca2+ content(D),and Mg2+ content(E)in the control,alkali stress and hemin groups
2.8 hemin对相关基因表达的影响
如图8A所示,NtPDR1和NtPDR3基因在受到碱胁迫后相对表达量均上调,经1μmol/L hemin,2μmol/L hemin处理后上调更加显著。由8B可以看出,经1μmol/L hemin,2μmol/L hemin 处理后,碱胁迫下的烟株NtNAC基因表达大幅上调。如图8B所示,碱胁迫组NtGSH1基因表达下调,而经hemin处理后基因表达上调,2μmol/L hemin处理组上调尤其显著。

图8 对照组组、碱胁迫组、hemin组烟株幼苗NtPDR(A)、NtNAC(B)和NtGSH1(B)基因相对表达量Fig.8 Expression of NtPDR(A),NtNAC(B)and NtGSH1(B)genes in the control,alkali stress and hemin groups
3 讨论
受到碱胁迫后烟株生长受到抑制,叶片减小发黄且根长变短,膜脂质过氧化程度加剧。经外源hemin处理后,上述现象均得到缓解。Han等[20]研究表明,氯化汞导致苜蓿脂质过氧化及根的伸长抑制,加入高铁血红素则有效减少脂质过氧化物含量并促进根的伸长,增加SOD等抗氧化酶活性。本研究中Hemin处理可增加烟株根系活力;诱导烟草体内SOD、POD、CAT和APX等抗氧化酶活力大幅提高,从而消除多余活性氧,将过量H2O2转化为水和分子氧,这与尤本武等[21]的研究结果一致。AsA能与O2-反应并能猝灭O2-和清除H2O2
[22];胁迫条件下,H2O2等活性氧也可被GSH还原。Hemin处理后烟株体内还原型AsA与GSH较碱胁迫组减少,可能是hemin促进了还原型AsA和GSH与活性氧的反应,因而AsA和GSH被大量消耗,同时降低了烟株的氧化损伤。
盐胁迫下植物受到渗透胁迫,可通过积累对细胞无毒的有机渗透调节物质来进行渗透调节以增强其耐盐能力[23]。Hemin诱导脯氨酸、可溶性糖、可溶性蛋白等渗透调节物质大量产生与积累有利于烟株在碱胁迫下对水分的吸收,并维持细胞渗透压,以保证细胞正常生理功能。碱胁迫实验结果预示着有机酸代谢调节可能与植物的抗碱机制密切相关[24-25]。郭立泉[26]等研究表明,碱胁迫引起星星草体内有机酸的特异积累。而本研究中经hemin处理后烟株体内有机酸积累相较碱胁迫组出现减少,具体机理仍有待进一步研究。
盐胁迫下外界高浓度的Na+会取代细胞质膜上的Ca2+,质膜选择透过性被破坏并导致胞内离子外渗,抑制了根系对K+、Ca2+的吸收;同时大量Na+进入细胞影响了部分酶的结构和功能,从而破坏细胞新陈代谢,导致盐害[25];K+、Ca2+、Mg2+是植物生长发育中重要的无机离子[27-28]。Hemin可通过降低烟株体内Na+积累,增加K+、Ca2+和Mg2+的吸收,提高烟株K+/Na+比,从而缓解碱胁迫对烟株造成的渗透胁迫和离子毒害,提高烟株的抗碱能力。胡冰等研究[29]也表明高铁血红素可以维持盐胁迫下小麦幼苗根部的离子稳态。Lee等研究证实拟南芥的AtPDR12所编码的蛋白在金属离子的转运过程中起作用[30]。而NtPDR1是AtPDR12的直系同源基因。本研究中hemin 诱导NtPDR1基因表达上调,NtPDR1蛋白可能参与了金属离子Na+、K+、Ca2+、Mg2+等的转运。Ducos E研究表明NtPDR3转运蛋白可能起到获取铁离子的作用[31]。Hemin诱导NtPDR3基因表达上调可能促使NtPDR3蛋白从外界向胞内转运铁离子,缓解碱胁迫造成的矿质元素缺失。
受到胁迫时植物通过一系列信号传递激发转录因子的产生,转录因子与相应顺式作用元件结合可激活下游逆境相关基因表达[32]。诸多研究也表明了NAC类转录因子参与非生物胁迫应答且发挥重要作用[33-36]。Hemin处理诱导NtNAC基因表达上调,合成NAC转录因子,并通过基因产物对碱胁迫做出适当的调节反应。NtGSH1基因表达上调可促进GSH合成,加强GSH与活性氧反应,清除多余自由基,从而缓解氧化损伤。
4 结论
外源hemin处理可有效改善碱胁迫下烟株的生长抑制。一方面提高SOD、POD、CAT、APX等抗氧化酶活力,促进抗氧化物质AsA和GSH与活性氧反应并消除多余活性氧;增加脯氨酸、可溶性糖、可溶性蛋白等渗透调节物质含量,维持细胞渗透势。另一方面增加根系活力,加强营养物质吸收;降低烟株体内Na+积累,促进K+、Ca2+、Mg2+吸收,维持离子稳态。同时hemin参与诱导NtPDR1、NtPDR3以及转录因子NtNAC基因表达上调,促进金属离子和次生代谢物转运、激素调控和信号转导以及营养元素吸收,从而缓解碱胁迫对烟株造成的伤害。本研究结果表明,外源hemin处理可诱导烟株抵御碱胁迫,可作为新型高效抗逆性物质。关于hemin的其他抗逆性功能还有待更多研究。
[1] Wang W,Vinocur B,Altman A.Plant responses to drought,salinity and extreme temperatures:towards genetic engineering for stress tolerance[J].Planta,2003,218(1):1-14.
[2] Zhu J K.Plant salt tolerance[J].Trends in plant science,2001,6(2):66-71.
[3] Yang C,Shi D,Wang D.Comparative effects of salt and alkali stresses on growth,osmotic adjustment and ionic balance of an alkali-resistant halophyte Suaeda glauca(Bge.)[J].Plant Growth Regulation,2008,56(2):179.
[4] 赵楠,芦艳,左进城,等.碱胁迫对碱蓬种子萌发的影响[J].北方园艺,2012(1):45-47.ZHAO Nan,LU Yan,ZUO Jincheng,et al.Effect of alkali stress on seed germination of Suaeda glauca Bunge[J].Northern Horticulture,2012(1),1:45-47.
[5] 毛桂莲,许兴,杨涓.NaCl 和Na2CO3对枸杞的胁迫效应[J].干旱地区农业研究,2004,22(2):100-104.MAO Guilian,XU Xing,YANG Juan.Eff ects of NaCl andNa2CO3on Lycium Barbarum L.[J].Agricultural Research in the Arid Areas,2004,22(2):100-104.
[6] Yang C W,Jianaer A,Li C Y,et al.Comparison of the eff ects of salt-stress and alkali-stress on photosynthesis and energy storage of an alkali-resistant halophyte Chloris virgata[J].Photosynthetica,2008,46(2):273-278.
[7] Lin Y T,Li M Y,Cui W T,et al.Haem oxygenase-1 is involved in hydrogen sulfide-induced cucumber adventitious root formation[J].Journal of Plant Growth Regulation,2012,31(4):519-528.
[8] Chen X Y,Ding X,Xu S,et al.Endogenous hydrogen peroxide plays a positive role in the upregulation of heme oxygenase and acclimation to oxidative stress in wheat seedling leaves[J].Journal of Integrative Plant Biology,2009,51(10):951-960.
[9] Cui W,Li L,Gao Z,et al.Haem oxygenase-1 is involved in salicylic acid-induced alleviation of oxidative stress due to cadmium stress in Medicago sativa[J].Journal of experimental botany,2012,63(15):5521-5534.
[10] Zilli C G,Balestrasse K B,Yannarelli G G,et al.Heme oxygenase up-regulation under salt stress protects nitrogen metabolism in nodules of soybean plants[J].Environmental and experimental botany,2008,64(1):83-89.
[11] Xu S,Zhang B,Cao Z Y,et al.Heme oxygenase is involved in cobalt chloride-induced lateral root development in tomato[J].Biometals,2011,24(2):181-191.
[12] Huang B K,Xu S,Xuan W,et al.Carbon Monoxide Alleviates Salt‐Induced Oxidative Damage in Wheat Seedling Leaves[J].Journal of Integrative Plant Biology,2006,48(3):249-254.
[13] Zhang J,Yang X,Ren Y,et al.β-Cyclodextrin–hemin enhances tolerance against salinity in tobacco seedlings by reestablishment of ion and redox homeostasis[J].Plant Growth Regulation,2017,81(3):533-542.
[14] 李玲,李娘辉,蒋素梅.植物生理学模块实验指导[M].科学出版社,北京,2009.LI Ling,LI Nianghui,JIANG Sumei.Plant physiology module experiment guidance[M].Beijing:Science press,2009.
[15] 张清莉,刘再强,钟玉德,等.BABA 诱导烟草抵御高盐胁迫的初步研究[J].中国烟草学报,2015,21(3):72-81.ZHANG Qingli,LIU Zaiqiang,ZHONG Yude,et al.A preliminary study on BABA-induced resistance to high salt stress in tobacco[J].Acta Tabacaria Sinica,2015,21(23):72-81.
[16] Stewart R R C,Bewley J D.Lipid peroxidation associated with accelerated aging of soybean axes[J].Plant Physiology,1980,65(2):245-248.
[17] 邹琦.植物生理学实验指导[M].中国农业出版社,北京,2000.ZOU Qi.Plant physiology experimental guidance[M].China Agriculture Press,BeiJing,2000.
[18] 朱广廉,钟诲文,张爱琴.植物生理学实验[M].北京大学出版社,1990.ZHU Guanglian,ZHONG Huiwen,ZHANG Aiqin.Plant physiology experiment[M].Peking University Press,1990.
[19] Michael P I,Krishnaswamy M.The eff ect of zinc stress combined with high irradiance stress on membrane damage and antioxidative response in bean seedlings[J].Environmental and experimental botany,2011,74:171-177.
[20] Han Y,Xuan W,Yu T,et al.Exogenous Hematin Alleviates Mercury‐induced Oxidative Damage in the Roots of Medicago sativa[J].Journal of integrative plant biology,2007,49(12):1703-1713.
[21] 尤本武,董建江,刘紫薇,等.β-氨基丁酸诱导烟草抗碱初步研究[J].中国烟草学报,2017,23(1):86-94.YOU Benwu,DONG Jianjiang,LIU Ziwei,et al.Preliminary study on BABA-induced resistance to alkaline stress in tobacco[J].Acta Tabacaria Sinica,2017,23(1):86-94.
[22] Davey M W,Montagu M V,Inzé D,et al.Plant L‐ascorbic acid:chemistry,function,metabolism,bioavailability and effects of processing[J].Journal of the Science of Food and Agriculture,2000,80(7):825-860.
[23] 许祥明,叶和春,李国凤.植物抗盐机理的研究进展[J].应用与环境生物学报,2000,6(4):379-387.XU Xiangming,YE Hechun,LI Guofeng.Study on salt resistance mechanism of plants[J].Chinese Journal of Applied and Environmental Biology,2000,6(4):379-387.
[24] ZHANG Y,LIN Q,LIU J,et al.Effects of Drought Stress on Photosynthetic Characteristics and Yield of Diff erent Fertilizer and Water Types of Wheat[J].Journal of Triticeae Crops,2011,4:026.
[25] Shi D,Yin S,Yang G,et al.Citric acid accumulation in an alkalitolerant plant Puccinellia tenuiflora under alkali stress[J].Acta Botanica Sinica,2001,44(5):537-540.
[26] 郭立泉,陈建欣,崔景军,等.盐,碱胁迫下星星草有机酸代谢调节的比较研究[J].东北师大学报:自然科学版,2009,41(4):123-128.GUO Liquan,CHEN Jianxin,CUI Jingjun,et al.Comparative study on metabolic regulation of organic acids in Puccinellia tenuiflora under salt and alkaline stress[J].Journal of Northeast Normal University(Natural Science),2009,41(4):123-128.
[27] Knight H,Trewavas A J,Knight M R.Calcium signalling in Arabidopsis thaliana responding to drought and salinity[J].The Plant Journal,1997,12(5):1067-1078.
[28] Parida A K,Das A B,Mittra B.Effects of salt on growth,ion accumulation,photosynthesis and leaf anatomy of the mangrove,Bruguiera parviflora[J].Trees-Structure and Function,2004,18(2):167-174.
[29] 胡冰,贺子义,林国庆,等.高铁血红素对盐胁迫下小麦根部生长受抑的缓解和根尖中离子微域分布的影响[J].植物生理学通讯,2008,44(5):865-868.HU Bing,HE Ziyi,LIN Guoqing,et al.Effects of heme on mitigation of root growth inhibition and ion microdomain distribution in root tip of wheat under salt stress[J].Plant Physiology Communications,2008,44(5):865- 868.
[30] Lee M,Lee K,Lee J,et al.AtPDR12 contributes to lead resistance in Arabidopsis[J].Plant physiology,2005,138(2):827-836.
[31] Ducos E,Fraysse Å S,Boutry M.NtPDR3,an iron‐deficiency inducible ABC transporter in Nicotiana tabacum[J].FEBS letters,2005,579(30):6791-6795.
[32] 戚元成,王菲菲,刘卫群,等.烟草中NAC 类转录因子基因的克隆及分析[J].中国农业科学,2011,44(11):2225-2233.QI Yuancheng,WANG Feifei,LIU Weiqun,et al.Cloning and analysis of NAC transcription factor gene in tobacco[J].Scientia Agricultura Sinica,2011,44(11):2225-2233.
[33] Yokotani N,Ichikawa T,Kondou Y,et al.Tolerance to various environmental stresses conferred by the salt-responsive rice gene ONAC063 in transgenic Arabidopsis[J].Planta,2009,229(5):1065-1075.
[34] Yoshii M,Yamazaki M,Rakwal R,et al.The NAC transcription factor RIM1 of rice is a new regulator of jasmonate signaling[J].The Plant Journal,2010,61(5):804-815.
[35] Yu X,Liu Y,Wang S,et al.CarNAC4,a NAC-type chickpea transcription factor conferring enhanced drought and salt stress tolerances in Arabidopsis[J].Plant cell reports,2016,35(3):613-627.
[36] Xu Z,Wang C,Xue F,et al.Wheat NAC transcription factor TaNAC29 is involved in response to salt stress[J].Plant Physiology and Biochemistry,2015,96:356-363.
