连翘花中连翘苷的超声提取工艺△
2018-03-09高首勤雒慧娟陈芳
高首勤,雒慧娟,陈芳
(1.山西中医学院 中药学院,山西 晋中 030619;2.山西医科大学 基础医学院,山西 太原 030001)
连翘(Forsythia suspense)为木犀科连翘属的落叶灌木,在我国分布广泛,主要产地有山西、陕西、河南、山东等,而且其他各地几乎均有栽培。连翘的传统入药部位是果实,是经常使用的中药[1]。连翘最早记载于《神农本草经》,具有清热解毒、散结消肿之功能,主治痈疽、乳痈、瘰疬、痈疡肿毒、丹毒、高热烦渴、风热感冒、神昏发斑以及热淋尿闭等症[2]。近些年来,关于连翘果实与连翘叶的研究很多,包括有效成分和药理作用等方面。研究表明,连翘果实与连翘叶所含的化合物非常相似,均含有苯乙醇苷类、木脂素类、黄酮类以及三萜类等化学成分[3],而且都具有降血脂、保肝、抗氧化、抗疲劳和抗肿瘤等作用[4]。然而相比之下,对连翘花的研究文献却甚少,连翘每年的花期为3—4月份,花期长、花量大,花色鲜黄且长时间不褪色,是一类及其丰富的资源,可以将其收集起来加以开发和利用。连翘苷是从连翘中提取分离出的一种活性成分,难溶于水,易溶于甲醇等有机溶剂[5],具有良好的抗菌、抗炎、保肝、抗病毒和降血脂等功能[6-8]。根据宋小俊等[9]的报道,连翘花中也含有连翘苷且含量高于传统入药部位。但是目前关于连翘花中连翘苷的提取工艺研究报道却很少。
超声波提取法由于其具有费时短、低耗能、高效率、不破坏有效成分等优点,在中药化学成分的提取中表现出显著的优势。为了更加全面地开发和利用连翘花资源,本文采用正交试验法对连翘花中连翘苷的超声提取工艺展开了研究,为更有效地开发和合理利用连翘花资源提供依据。文献中提取的溶剂常用的有水、甲醇、乙醇等,其中对连翘花和叶的提取用甲醇的比较多,所以本文选取甲醇作为提取剂,当然提取成分用于药用要考虑到甲醇的毒性。
1 仪器和试剂
1.1 仪器
CP214电子天平(奥豪斯仪器有限公司);UV-61005紫外可见分光光度计(上海元析仪器有限公司);SB-5200DTDN型超声清洗机(宁波新芝生物科技股份有限公司);DE-200g万能高速粉碎机﹙浙江红景天工贸有限公司﹚。
1.2 试剂与药品
连翘花采于山西中医学院榆次校区本草园内,洗净,40 ℃烘干,粉碎备用;连翘苷对照品(上海融禾医药科技有限公司,批号:160403);无水甲醇为国产分析纯试剂。
2 方法与结果
2.1 连翘花中连翘苷的提取
取新鲜连翘花,洗净,40 ℃烘干,粉碎,备用。准确称取连翘花粉末1.0 g,置于100 mL锥形瓶中,加入20 mL甲醇,浸泡1 h,超声波提取30 min,过滤,将滤液置于100 mL容量瓶中,定容,摇匀,作为样品溶液,备用。
2.2 连翘花中连翘苷的测定
2.2.1 对照品溶液的制备 精密称取干燥至恒重的连翘苷对照品5.00 mg,置于10 mL容量瓶中,加适量甲醇溶解,定容,摇匀,得质量浓度为0.500 mg·mL-1的连翘苷对照品溶液。
2.2.2 检测波长的选择 取2.2.1项中制备好的对照品溶液,在200~400 nm波长范围内进行扫描,在290 nm波长处有最大吸收且干扰小,故选择290 nm为测定波长。
2.2.3 标准曲线的绘制 精密吸取对照品溶液0.2、0.4、0.6、0.8、1.0、1.2、1.4 mL置于10 mL容量瓶中,定容,摇匀,以甲醇为空白对照溶液,在290 nm波长处测定吸光度,以连翘苷对照品浓度(X)为横坐标,吸光度(A)为纵坐标得到回归方程:Y=8.476 2X+0.002 1,r=0.996 9,表明连翘苷对照品在0.01~0.07 mg·mL-1呈良好的线性关系。
2.2.4 精密度试验 取配置好的对照品溶液在290 nm波长处测定吸光度值,平行操作6次,算得RSD值为1.05%,说明此仪器精密度良好。
2.2.5 稳定性试验 精密吸取连翘花供试品溶液2 mL,定容到10 mL容量瓶中,在290 nm波长下分别间隔0、10、20、30、40、50、60 min测定吸光度值,计算得RSD值为1.28%,说明供试品溶液在1 h内稳定,所得连翘苷的稳定性良好。
2.2.6 重复性试验 称取同一批药材样品,依据连翘花供试品溶液的制备方法制备6份供试品溶液,然后分别在290 nm处测定吸光度值,计算得RSD值为1.56%,说明此方法重复性良好。
2.2.7 加样回收率试验 分别在6份已知含量的重复性样品中,精密移取连翘苷对照品溶液1.500 mg加入样品中,在290 nm波长处测吸光度值,结果见表1。

表1 加样回收率结果(n=6)
2.3 单因素试验
在其他条件相同时,分别选取甲醇浓度、超声时间和料液比3个影响提取效果的因素进行单因素试验,以期为正交试验中因素水平的设定提供参考。
2.3.1 不同甲醇浓度提取 准确称取1.0 g连翘花粉末5份,以1∶20的料液比分别加入50%、60%、70%、80%、90%的甲醇,分别超声提取30 min。提取液过滤后,取2 mL滤液置于10 mL容量瓶中,定容,摇匀,在290 nm处测定吸光度值并计算提取率,见图1,使用70%的甲醇提取率最高。
2.3.2 不同时间提取 准确称取1.0 g连翘花粉末5份,以1∶20的料液比分别加入70%的甲醇,分别超声提取20、30、40、50、60 min。提取液过滤后,取2 mL滤液置于10 mL容量瓶中,定容,摇匀,在290 nm处测定吸光度值并计算提取率,见图2,超声提取30 min时,提取率最高。
2.3.3 不同料液比提取 准确称取1.0 g连翘花粉末5份,分别以1∶5、1∶10、1∶15、1∶20、1∶25、1∶30的料液比加入70%的甲醇,分别超声提取30 min。提取液过滤后,取2 mL滤液置于10 mL容量瓶中,定容,摇匀,在290 nm处测定吸光度值并计算提取率,见图3,料液比1∶25时提取率最高。

图1 甲醇浓度与连翘苷得率的关系
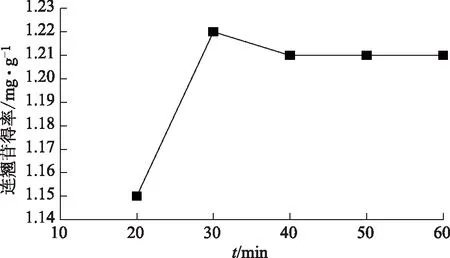
图2 时间与连翘苷得率的关系

图3 料液比与连翘苷得率的关系
2.4 正交试验设计
为系统考察超声波提取连翘花中连翘苷的提取工艺,在单因素试验与所查文献的基础上,选取提取时间、甲醇浓度和料液比作为考察因素,以连翘苷提取率为指标进行正交试验,确定连翘花中连翘苷的最佳超声提取工艺条件,因素水平见表2。
按表2所列的工艺组合制备样品,加甲醇后均浸泡1 h后超声提取,提取物取2 mL置于10mL容量瓶中,定容,摇匀。在290 nm下测定吸光度值,计算连翘苷的提取率。

表2 正交试验因素水平表
2.5 正交试验结果
按表3所列的工艺组合制备样品,加甲醇后均浸泡1 h后超声提取,提取物取2 mL置于10 mL容量瓶中,定容,摇匀。在290 nm下测定吸光度值,计算连翘苷的得率。正交试验结果与直观分析见表3,方差分析见表4。

表3 正交试验结果和直观分析

表4 方差分析
由结果分析可知,影响连翘苷得率的主次因素为:料液比>提取时间>甲醇浓度,其中最显著的影响因素为料液比,并且确定最佳提取方案为A2B2C3,即用25倍量的70%甲醇,超声提取40 min,提取的质量分数为4.822 mg·g-1。
3 讨论
采用超声提取法对连翘花中连翘苷的提取工艺进行研究,并通过正交试验确定了最佳的超声波提取工艺,即用25倍量70%的甲醇,超声提取40 min,提取率为4.822 mg·g-1。这个提取工艺的确定不但为连翘花资源的合理开发和利用提供了可靠的参考,而且扩大了连翘苷的药用来源。
[1] 胡静,马琳,张坚,等.连翘的研究进展[J].中南药学,2012,10(10):760-764.
[2] 张海燕.连翘化学成分及药理活性的研究进展[J].中药材,2000,23(10):657-660.
[3] 李倩,冯卫生.连翘的化学成分研究进展[J].河南中医学院学报,2005,20(117):78-80.
[4] 曹晓燕,王东浩,思培峰,等.连翘不同部位连翘苷含量的比较[J].中成药,2009,31(4):642-644.
[5] 姚新生.天然药物化学[M].3版.北京:北京人民卫生出版社,2003.
[6] 魏晋宝,杨光义,陈欢,等.连翘苷的提取方法、药理毒理及药动学研究进展[J].中国药师,2015,18(12):2144-2148.
[7] 杨建雄,朱淑云,李发荣.连翘叶茶的体外抗氧化活性[J].食品科学.2002,23(12):120-123.
[8] 杨建雄,刘静,李发荣,等.连翘叶茶抗氧化抗衰老作用的实验研究[J].营养学报,2004,26(1):65-67.
[9] 杨建雄,刘静.连翘叶茶保肝作用的实验研究[J].陕西师范大学学报(自然科学版),2005,33(3):82-85.
[10] 宋小俊.连翘不同部位化学成分研究进展[J].西北药学杂志.2014,29(2):220-222.
