不同采收期龙葵药材质量研究
2018-03-09王珏金一宝王铁杰李晓帆
王珏,金一宝,王铁杰*,李晓帆
(1.深圳市药品检验研究院 深圳药品质量标准研究重点实验室,广东 深圳 518057 2.深圳大学 深圳市微生物基因工程重点实验室,广东 深圳 518060)
龙葵,茄科植物龙葵SolanumnigrumL.的干燥地上部分[1],具有清热解毒、消肿散结、活血化瘀、利水消肿、止咳祛痰的功效[2]。近期研究证实其具有较好的抗肿瘤活性[3]。目前对其抗肿瘤活性成分的研究集中在皂苷类成分[4]和甾体生物碱类成分[5]等。龙葵是一年生草本植物,一年四季都可在栽培,但是其采收期对药材的质量有较大影响。因此,为获得具有最佳治疗效果的药材,需要对龙葵的采收期进行研究。中药材采收期的研究,以中药所含化学成分作为质量控制依据,并与药理学紧密结合。高效液相色谱法(HPLC)先分离后分析的特点也特别适用于中药成分的含量测定及指纹图谱研究。本实验旨在对不同生长周期的龙葵中的龙葵中的主要活性成分进行分析,以便更好的控制龙葵药材的最佳采收期,为龙葵药材的质量控制提供依据。
1 材料
1.1 药材
共采集到不同采收期(6月至10月)的样品共8批。龙葵药材由沈阳药科大学吴维春老师鉴定为SolanumnigrumL.。
1.2 仪器与试剂
高效液相色谱仪(日本岛津株式会社,SEDEX MODEL 75,二元梯度泵LC-10ATVP),色谱柱选用Phenomendex C18(4.6×250 mm,5 μm)。色谱级甲醇(天津科密欧化学试剂有限公司),色谱级乙腈(迪马公司),色谱级三乙胺(Fisher Scientific),蒸馏水,无水乙醇(分析纯,天津市永大化学试剂有限公司),DPBS、PMS、MTS(含Ca2+、Mg2+,德国赛默飞公司)。去氢表雄酮-β-石蒜四糖苷、澳洲茄碱、澳洲茄边碱和去半乳糖替告皂苷由龙葵提取物中分离得到[6-7],并经 IR、NMR、HPLC等技术鉴定其结构和含量,质量分数均大于 99.0%。
2 方法
2.1 细胞毒活性筛选
2.1.1 试剂的配制 PMS,将PMS溶解于DPBS中,配制成0.92 g·mL-1,过滤除菌。MTS,取250 g溶于125 mL的DPBS,混匀15 min,过滤除菌。
龙葵溶液,干燥的龙葵粉碎后过2号筛,再真空干燥12 h,取药材粉末加60%乙醇超声提取,微孔滤膜(0.22 μm)过滤,取续滤液使用,最终给药浓度为100 μg·mL-1。
2.1.2 细胞培养 人肝癌细胞株HepG2培养于10%胎牛血清的DMEM培养液(v/v)中,置5% CO2的培养箱中37 ℃培养。取对数生长期细胞接种于96孔板中,每孔细胞数约为1×104,待贴壁后,每孔加入药物作用于细胞48 h,设6个复孔。采用MTS法,利用[3-(4,5-dimethylthiazol-2-yl)-5(3-carbosym-ethoxyphenyl)-2-(4-sulfopheny)-2H-tetrazolium,innersalt]形成的水溶性甲臢产物。吸出所有培养液,加入50 μL新鲜培养基和10 μL MTS-PMS(20∶1,临用现配),继续培养3 h,于490 nm波长处读取数据,扣除背景值后。
比较按2.11所制备的不同采收期的龙葵溶液对HepG2细胞的抑制率。同时对从龙葵中分离得到的化合物去氢表雄酮-β-石蒜四糖苷(allopregnenolone β-lycotetraoside)、澳洲茄碱(solasonine)、澳洲茄边碱(solamarging),去半乳糖替告皂苷,测定单体化合物对HepG2细胞抑制率,用Logit法以药理学统计软件计算半数抑制浓度IC50值。
2.2 活性成分含量分析
2.2.1 色谱条件 Phenomendex C18(4.6 mm × 250 mm,5 μm),流速1.0 mL·min-1,流动相A 相为乙腈(含0.03%三乙胺),B 相为水/甲醇=8∶2(含0.03%三乙胺),二元线性梯度洗脱(洗脱程序:0~10 min,A相10%至15%;10~15 min,A相15%至30%;15~30 min,A相30%至34%;30~52 min,A相34%至50%;52~55 min,A相50%至55%),柱温25 ℃,蒸发光检测器蒸发管温度设置40 ℃,进样量20 μL[8]。
2.2.2 龙葵溶液的制备 干燥的龙葵药材,粉碎后过2号筛,再真空干燥12 h,取药材粉末,每份2.0 g,精密称定。加60%乙醇20 mL,超声提取2次,每次20 min。过滤,合并滤液,滤液减压浓缩至近干,用60%乙醇转移至25 mL量瓶中,加60%乙醇定容,摇匀,微孔滤膜过滤,取续滤液作为供试品溶液。
2.2.3 对照品溶液 取减压干燥至恒重的从龙葵中提取分离的去半乳糖替告皂苷对照品适量,去半乳糖替告皂苷对照品由前期实验室内分离制得,经HPLC-ELSD测定,通过峰面积计算其纯度为99.2%。精密称定去半乳糖替告皂苷对照品,加甲醇定溶至50 mL容量瓶中,制成1.001 mg·mL-1的去半乳糖替告皂甙溶液。
2.2.4 方法学验证 标准曲线,精密吸取2.2项下的对照品溶液0.10、0.20、0.50、1.00、2.00 mL至10 mL量瓶中,以起始流动相溶液定容至10 mL,进样体积20 μL,测定峰面积Y。以对照品浓度X为横坐标,计算回归方程。精密度试验,取50.05 μg·mL-1的对照品溶液,重复进样6次,在上述色谱条件测定峰面积计算RSD值。重现性试验,取8月19日采集的同一批样品,精密称取6份,按2.2.2项下操作,在上述色谱条件测定去半乳糖替告皂苷的含量,计算RSD值。稳定性试验,精密吸取同一供试品试液,在室温下放置,分别于0、2、4、8、24、48 h时测定去半乳糖替告皂苷的含量计算RSD值。回收率试验,精密称取6份8月19日的龙葵药材,分别加入50.05 μg·mL-1浓度的对照品溶液混合,按2.2.2项下操作,测定去半乳糖替告皂苷的回收率。
2.2.5 样品测定 按2.2.2制备不同采收期龙葵药材供试品溶液,每个采收期各制备3份。分别取供试品溶液和对照品溶液,在上述色谱条件下测定,以外标法计算不同采收期龙葵药材中去半乳糖替告皂苷的量。
2.2.6 指纹图谱相似度评价 通过提取各色谱图,导入至“中药色谱指纹图谱相似度评价系统(2012.1版本)”,进行相似度计算。
3 结果
3.1 细胞毒活性测试
3.1.1 不同采收期龙葵药材活性评价 对6~10月期间不同采收期的龙葵药材进行细胞毒活性测试,发现植物生长周期的不同对龙葵的细胞毒活性有较大的影响,且随着生长周期的变化,细胞毒活性呈现出一定的趋势性,即从7月开始出现明显增强的细胞毒活性,活性水平维持一定水平直到9月初,结果见图1。
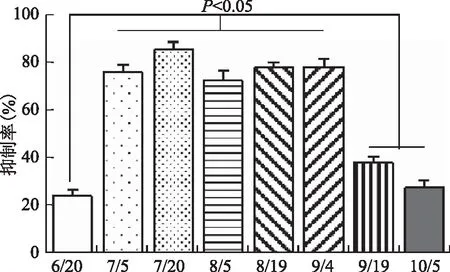
图1 不同采收期的龙葵药材对HepG2细胞的抑制率
3.1.3 龙葵抗癌活性成分 比较龙葵中活性化合物去氢表雄酮-β-石蒜四糖苷(allopregnenolone β-lycotetraoside)、澳洲茄碱(solasonine)、澳洲茄边碱(solamarging)和去半乳糖替告皂苷(degalactotionin)的IC50值,结果见表1,去半乳糖替告皂苷的IC50值最小(IC50=0.245±0.59 μmol·L-1),即对龙葵的细胞毒活性影响最显著。

表1 活性化合物的IC50值
3.2 不同采收期活性成分量值差异
3.2.1 测定成分的选择 龙葵全草乙醇提取物具有较好的活性,其中化合物1、2、3、4为药材中含有的细胞毒活性成分[3],其中化合物4(去半乳糖替告皂苷)的活性最强。因此选择其进行含量测定,作为控制该药材质量的定量指标。
3.2.2 系统适应性考察 吸取去半乳糖替告皂甙对照品溶液和龙葵药材供试品溶液,分别注入液相色谱仪,绘制色谱图,此条件下各对照品及其它组分达到良好分离,分离度R值大于1.5,理论板数按去半乳糖替告皂甙计算不低于6000,进行含量测定。
3.2.3 线性关系考察 分别精密吸取混合对照品溶液 0.10、0.20、0.50、1.00、2.00 mL至10 mL量瓶中,以起始流动相溶液定容至10 mL,分别取20 μL注入液相色谱仪,记录峰面积。以去半乳糖替告皂甙的峰面积积分值为纵坐标(Y)、进样溶度μg·mL-1为横坐标(X),绘制标准曲线,去半乳糖替告皂甙回归方程为 Y=1.252X+12.68,r=0.999 6。结果表明,去半乳糖替告皂甙在 10.01~200.2 μg·mL-1呈良好线性。
3.2.4 精密度试验 取对照品溶液,重复进样6次,计算去半乳糖替告皂甙的RSD,结果见表2,RSD为1.44%,符合精密度要求。
3.2.5 重复性试验 称取沈阳产龙葵药材(8月19日采摘)6份,制备供试品溶液,计算化合物去半乳糖替告皂甙的RSD为2.42%(见表2),表明方法重复性较好。
3.2.6 稳定性试验 室温下分别放置0、1、4、8、12、24 h后,计算其中去半乳糖替告皂苷面积的RSD为1.95%(见表2),表明稳定性较好。
3.2.7 加样回收率试验 精密称取已测8月19日样品6份,每个样品分别精密加入另配制的去半乳糖替告皂苷对照品溶液5.0 mL,按样品测定项下操作,依法测定,计算回收率为98.8%(见表2),表明方法回收率较好。

表2 去半乳糖替告皂苷测定的方法学验证
3.3 不同采收季节对药材的影响
3.3.1 指纹图谱相似度比较 为了考察不同的采收季节对龙葵药材次生代谢的影响,收集不同时期的8批龙葵药材,分别扫描HPLC指纹图谱,见图3。

图3 不同采收期龙葵药材色谱图(箭头所指为去半乳糖替告皂苷)
将以上不同采收期的8批药材,通过提取各色谱图,导入至“中药色谱指纹图谱相似度评价系统(2012.1版本)”,进行相似度计算(见表3),并建立指纹图谱进行比较。经过相似度软件处理可以看出不同采收期的龙葵药材之间化学成分存在较大的差异,即从7月下旬至9月,龙葵药材的相似度较好,在90%以上,而采收时间较早或较晚的相似度较差(见表3)。
3.3.2 去半乳糖替告皂苷含量比较 活性化合物去半乳糖替告皂苷的IC50值最小,即对龙葵的细胞毒活性影响最显著。通过测定不同采收期的龙葵药材化合物去半乳糖替告皂苷含量的结果见表3。从7月开始,龙葵药材内的去半乳糖替告皂苷含量开始升高,在7月下旬达到峰值后,缓慢下降。

表3 不同采收期龙葵的指纹图谱相似度和去半乳糖替告皂苷含量
4 讨论
Oween[9]等设计的MTT类似物——MTS,与MTT法相比,操作简便,易于配制和储存,相比MTT法敏感性高、特异性强、重复性好[10]。经过对不同采收期的龙葵药材的细胞毒活性测试,发现植物生长周期的不同对龙葵的细胞毒活性有较大的影响,并且随着生长周期的变化,细胞毒活性呈现出一定的趋势性。为了阐明其中的细胞毒活性成分,对龙葵药材的化学成分进行研究,确定去半乳糖替告皂苷的细胞毒活性最强,为后续含量测定奠定基础利用HPLC技术对龙葵药材进行分析,方法学考察证明本方法的各项指标良好。通过指纹图谱的相似性可明显看出不同采收期的龙葵药材具有显著差异。同时利用HPLC对龙葵的中的主要细胞毒活性化合物去半乳糖替告皂苷进行含量分析,发现去半乳糖替告皂苷的含量随生长时间而发生变化,因此,推测龙葵药材的细胞毒活性随采收期的时间变化的原因就是其药效成分量值变化所导致的。
为了比较不同采收期对药材的影响,将不同采收期药材相似度,活性化合物去半乳糖替告皂苷的含量与抑制率拟合成的相关趋势线如图4。如图所示,龙葵药材随采收日期的变化其相似度值呈规律性变化。这种规律性的变化揭示了药材的生长周期。从图4可以看出,在6月下旬至7月上旬采集的药材相似度很低,相似度值在0.5以下,7月中旬至8月初采集的药材相似度攀升,8月5日采集的药材相似度达到0.994。从8月初至9月中旬,均有较高的相似度,相似度位于0.95以上。到了9月末相似度呈下降的趋势,10月5日采集的药材相似度为0.814,已经低于0.85。根据药材相似度结合不同采收期药材的活性变化趋势线,基本上可以确定药材的采收期为7月上旬至9月初。然而通过观察活性化合物去半乳糖替告皂苷的含量变化,发现去半乳糖替告皂苷的含量高低对药材活性也有较大的影响,但是随着进入8月后,龙葵药材中的去半乳糖替告皂苷的含量开始逐渐减少,但其药效作用依然保持至9月初,说明在龙葵药材中其它皂苷类、茄碱类成分虽然不具备最强的细胞毒性,但可能由于后续的含量累计维持了龙葵的抗癌活性。

图4 不同采收期龙葵药材的相关趋势比较
通过细胞毒活性测试,指纹图谱相似度评价和最强活性成分的含量测定三个方面相结合对固定产地不同采收期的龙葵药材进行研究,发现了不同采收期对药材的品质具有影响,为今后龙葵的研究与开发提供实验依据。
[1] 国家药典委员会.中华人民共和国药典:一部[S].北京:中国医药科技出版社,2010:附录23.
[2] 李志辉,孟军华,肖晖.龙葵的质量分析研究[J].中药新药与临床药理,2012,23(6):661-664.
[3] 罗文娟,王光辉,周新兰,等.螺甾皂苷类化合物的体外抗人肝癌细胞增殖作用[J].现代肿瘤医学,2007,15(3):307-308.
[4] Loganayaki N,Siddhuraju P,Manian S.Antioxidant Activity of Two Traditional Indian Vegetables:SolanumnigrumL.andSolanumtorvumL[J].Food Sci.Biotechnol,2010,19(1):121-127.
[5] Wang H C,Chung P J,Wu C H,et al.SolanumnigrumL.polyphenolic extract inhibits hepatocarcinoma cell growth by inducing G2/M phase arrest and apoptosis[J].J Sci Food Agric,2011,91(1):178-185.
[6] 王立业,王乃利,姚新生.龙葵中的非皂苷类成分[J].中药材,2007,30(7):792-794.
[7] 周新兰,何祥久,周光雄,等.龙葵全草皂苷类化学成分研究[J].中草药,2006,37(11):1618-1621.
[8] 王珏,金一宝,王铁杰,等.不同产地龙葵药材的高效液相色谱-蒸发光散射检测指纹图谱[J].色谱,2015,33(8):809-815.
[9] Brttke T M,McCubrey J A,Owen T C.Use of aqueous soluble tetrazolium/formazan assay to measure viability and prolifeation of lymphokine-dependent cell lines[J].J Immunol Methods,1993;15(7):233-240.
[10] 叶萍,李燕,谷淑燕.MTS和MTT法检测小鼠NK及特异性细胞毒性T细胞活性的比较[J].中华实验和临床病毒学杂志,1998,12(1):85-86.
