盐胁迫对东北薄荷种子萌发的影响1)
2018-03-07李玉梅姜云天董雪松
李玉梅 姜云天 董雪松
(吉林师范大学,四平,136000) (通化师范学院)
药用植物的生长发育、产量品质及其药理药效与其生长的地域环境密切相关[1]。近年来,随着传统医药和制药工业对中药材需求的日益增加,部分药用植物逐渐进入规范化人工种植模式,但人们在栽培过程中不合理灌溉、施肥以及高温高湿的特殊环境,导致土壤次生盐渍化程度日益加重,已成为制约中药材发展的瓶颈问题。据报道,一些药用植物和芳香植物对盐胁迫具有一定的耐受性,并且在胁迫临界值内有利于药材品质的提高[2-3],这表明在盐渍化土壤上发展药用植物栽培产业具有一定的潜力。因此,深入开展道地药材的耐盐性研究,了解植物从种子萌发到苗期生长等各个生长发育阶段对盐碱逆境的响应特征,明确其对不同盐种类的耐受范围,这对盐碱地区道地药材的引种栽培和指导生产实践具有重要现实意义。
东北薄荷(Menthasachalinensis(Briq.) Kudo.)为唇形科(Labiatae)薄荷属(Mentha)多年生草本植物,自然生长在海拔170~1 100 m的河边、湖畔、潮湿草地,主产于黑龙江、吉林、辽宁、内蒙古等地。以全草入药,具有散风热、解表、通窍、疏肝、利胆、清咽之功效[4];其鲜茎叶经蒸馏而得的薄荷油作为重要的原材料广泛应用于香料、食品、医药等行业,现已成为一种药香兼用植物。但是随着湿地的减少和人为无节制的采挖,东北薄荷野生资源受到严重破坏,甚至在一些地区已面临灭绝。因此,熟知该野生资源对外部生态环境因子的生存适应性,开展东北薄荷的人工种植已成为当务之急。目前国内外对东北薄荷的研究甚少,仅见化学型分析[5]、种子繁育技术[6]方面的报道,而有关其逆境生理尤其是耐盐性方面的研究尚未见报道。近年来,国内外学者对同属的椒样薄荷(MenthapiperitaL.)[7-9]、唇萼薄荷(MenthapulegiumL.)[10]、亚洲薄荷(MenthaarvensisL.)[11]、留兰香(MenthaspicataL.)[12]、水薄荷(MenthaaquaticaL.)[13]等栽培品种幼苗期的耐盐性展开了系列研究,但仅涉及NaCl单一盐胁迫,而有关其种子萌发期耐盐性方面的研究鲜见报道。东北地区是我国土壤盐碱化最为严重的区域之一,盐碱土面积达3.84×107hm2,约占全区土地总面积的3.1%,盐碱土耕地面积达1.28×107hm2[14],且其所含盐分复杂多样,既含有中性盐(NaCl、Na2SO4),也含有碱性盐(NaHCO3、Na2CO3)[15],土壤盐渍化已给当地农林牧业发展带来严重影响。东北薄荷作为道地药材对不同类型盐胁迫的耐受性如何?能否在盐碱地上成功建植?能否利用盐碱弃耕地来发展东北薄荷的人工种植,以实现生态恢复?系列问题尚未知晓。种子萌发阶段是植物生活史中最为敏感的时期[16],种子萌发期对逆境的适应能力是决定该种群能否成功建植的关键因素[17]。因此,本研究以野生东北薄荷种子为试材,探讨NaCl、Na2SO4、NaHCO3、Na2CO34种盐胁迫对其种子萌发时间和发芽率、发芽势、活力指数等萌发指标的影响,并通过建立的函数方程确定东北薄荷种子萌发期对4种盐胁迫的耐盐适宜浓度、耐盐半致死浓度和耐盐极限浓度,为选择适宜的盐碱土地资源发展野生东北薄荷的引种、驯化栽培提供理论依据,也为其它道地药材的耐盐性研究提供参考。
1 材料与方法
供试的薄荷种子采自辽宁省鞍山市千山风景区,经吉林师范大学生命科学学院姜恩来教授鉴定为东北薄荷(Menthasachalinensis(Briq.) Kudo.)的干燥成熟种子。
试验设计:根据东北地区盐碱化土地的盐分组成[15],以NaCl、Na2SO4、NaHCO3、Na2CO34种盐为胁迫因子,根据预实验所得结果将其浓度分别设置为NaCl浓度50、110、170 mmol·L-1;Na2SO4浓度50、70、90 mmol·L-1;NaHCO3浓度20、60、100 mmol·L-1;Na2CO3浓度15、20、25 mmol·L-1,以蒸馏水为对照0(CK),每个处理浓度3次重复。
薄荷种子处理及相关指标的测定:选取饱满、大小均匀一致的东北薄荷种子用0.05%的KMnO4溶液消毒5 min,蒸馏水冲洗5次。按照《国际种子检验规程》将消毒后的种子置于铺有双层滤纸的培养皿(Φ=12 cm)中,分别加入对应浓度的盐溶液10 mL,每个培养皿内均匀摆放30粒种子。将所有处理后的种子置于恒温培养箱内进行培养,箱内温度设定为25 ℃,光照时间12 h/d,光照强度2 000 lx,每隔24 h观察种子发芽情况并予以记录,以胚芽长度达到种子长度一半时作为种子发芽标准[18]。分别于日发芽种子数达到最高峰时计算发芽势,第7天计算种子发芽率、发芽指数、活力指数。连续培养7 d后,移走已萌发的种子,并将未萌发的种子置于蒸馏水中进行复水发芽试验,观察记录解除4种盐胁迫后种子恢复萌发情况。相关指标的计算公式如下:
初始发芽率=(处理液中萌发种子数/供试种子总数)×100%,恢复发芽率=(复水后发芽种子数/复水种子数)×100%[19];平均发芽时间=∑(ti×ni)/∑ni,式中ti为实验开始的时间,ni为每天发芽的种子数[20];发芽势=(日发芽种子数达到高峰期时的发芽种子总数/供试种子总数)×100%;发芽指数(Gi)=∑Gt/Dt,式中Gt为不同时间(t)的发芽数,Dt为相应的发芽时间[21];活力指数(Vi)=Gi×S,Gi为发芽指数,S为幼苗鲜质量;相对盐害率=((对照发芽率-处理发芽率)/对照发芽率)×100%。
耐盐性评价[22]:分别以NaCl、Na2SO4、NaHCO3和Na2CO3处理7 d后的相对发芽率为因变量(y)、以盐浓度为自变量(x)建立函数方程,以相对发芽率下降75%、50%和10%时所对应的盐浓度作为东北薄荷种子对4种盐胁迫的耐盐适宜浓度、耐盐半致死浓度和耐盐极限浓度。
数据处理:用Excel 2007录入数据并制图,采用SPSS20.0统计软件对数据进行方差分析和曲线回归分析,以Duncan’s新复极差法进行多重比较。
2 结果与分析
2.1 盐胁迫对东北薄荷种子萌发进程的影响
由表1可以看出,NaCl和Na2SO4胁迫处理下的种子平均发芽时间变化规律相似。胁迫浓度为50 mmol·L-1时,种子的平均发芽时间变化不大,分别较对照增加6.52%和0.86%;随着胁迫浓度的继续升高,平均发芽时间均较对照显著增加,110和170 mmol·L-1NaCl处理的平均发芽时间分别增加39.56%和78.70%,而70和90 mmol·L-1Na2SO4处理的平均发芽时间分别增加47.83%和241.30%。不同浓度的NaHCO3和Na2CO3胁迫处理对平均发芽时间影响各异。与对照相比,20 mmol·L-1NaHCO3处理的平均发芽时间差异不显著(P>0.05),增加9.56%,而60、100 mmol·L-1NaHCO3处理的平均发芽时间分别较对照显著增加54.78%和68.70%,且二者之间差异不显著(P>0.05);15、20、25 mmol·L-1Na2CO3处理的平均发芽时间均与对照差异显著(P<0.05),且各处理浓度之间差异亦显著(P<0.05),其分别较对照增加31.30%、62.61%和204.35%。以上结果说明,NaCl、Na2SO4、NaHCO3和Na2CO3胁迫处理均不同程度的延长了东北薄荷种子平均发芽时间,且高浓度二价盐(Na2SO4、Na2CO3)对种子平均发芽时间的影响作用要大于一价盐(NaCl、NaHCO3)。
由图1和图2可见,播种后第1天,仅对照组的种子开始萌发,其发芽率达到18.89%;第2天,不同浓度NaCl、Na2SO4和NaHCO3胁迫处理的种子均已开始萌发,而Na2CO3胁迫处理下的种子除25 mmol·L-1未萌发外,其它胁迫浓度下的种子均已萌发。从整个种子萌发历程来看,NaCl处理组,0~110 mmol·L-1处理的日发芽率均在第2天达到峰值,且50 mmol·L-1处理下的日发芽率较对照增加41.68%;而170 mmol·L-1处理下的日发芽率则在第5天达到峰值,且其日发芽率仅为11.11%。Na2SO4处理组,0~90 mmol·L-1处理下的日发芽率均在第2天达到峰值,且50 mmol·L-1处理下的日发芽率较对照增加25.01%,而其它胁迫浓度下的日发芽率均低于对照(53.33%)。

表1 盐胁迫对东北薄荷种子平均发芽时间的影响
注:表中数据为“平均值±标准误”;同列不同字母表示同种盐处理间差异显著(P<0.05)。

图1 中性盐胁迫下东北薄荷种子萌发的动态变化
NaHCO3处理组中对照和20 mmol·L-1处理下的日发芽率均在第2天达到峰值,且20 mmol·L-1处理下的日发芽率较对照增加31.26%;而60 mmol·L-1处理下的日发芽率则在第3天达到峰值,其日发芽率为31.11%;100 mmol·L-1处理下的日发芽率则无明显的萌发高峰。Na2CO3处理组中15 mmol·L-1处理下的日发芽率在第2天达到峰值,且其日发芽率较对照下降10.41%;而20 mmol·L-1处理下的日发芽率则出现双峰值,分别出现在第2天和第5天,其日发芽率分别为24.44%和20.00%;25 mmol·L-1处理下的种子几乎未萌发。
2.2 盐胁迫对东北薄荷种子发芽率的影响
由表2可见,4种单盐胁迫处理下的东北薄荷种子发芽率均随其盐浓度的升高而呈逐渐下降趋势。其中,低浓度NaCl(50 mmol·L-1)和NaHCO3(20 mmol·L-1)处理下的发芽率均与对照差异不显著(P>0.05),仅较对照下降1.17%和4.66%;而高浓度NaCl(≥110 mmol·L-1)和NaHCO3(≥60 mmol·L-1)胁迫处理则显著抑制了东北薄荷种子萌发,其发芽率较对照分别下降23.26%、74.42%和20.93%、70.93%。Na2SO4和Na2CO3处理下的发芽率均显著低于对照(P<0.05),且各胁迫浓度之间的发芽率差异均显著(P<0.05);低浓度Na2SO4(50 mmol·L-1)和Na2CO3(15 mmol·L-1)处理下的发芽率均较对照下降11.64%,而较高浓度Na2SO4(70、90 mmol·L-1)和Na2CO3(20、25 mmol·L-1)处理下的发芽率较对照分别下降61.63%、82.56%和31.39%、91.86%。
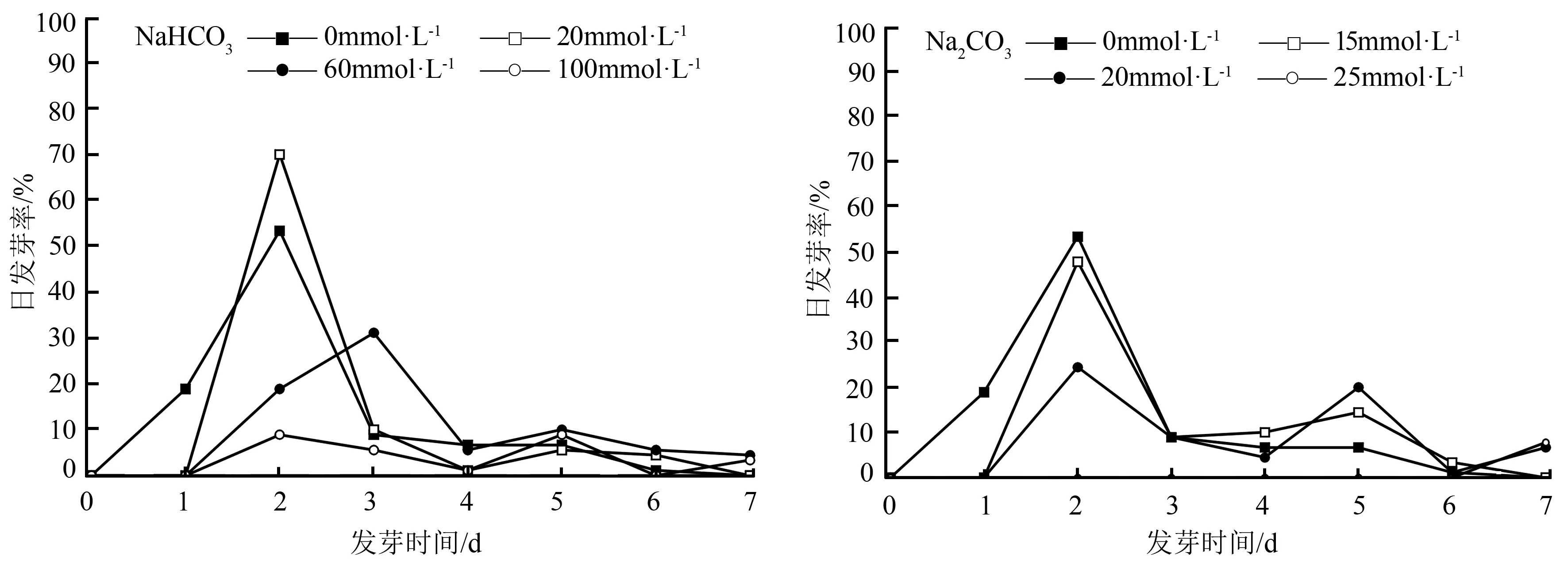
图2 碱性盐胁迫下东北薄荷种子萌发的动态变化

盐处理盐浓度/mmol·L-1发芽率/%发芽势/%发芽指数活力指数相对盐害率/%NaCl 0(95.56±1.94)a(53.33±1.85)b(45.74±1.06)a(2.18±0.09)a0d 50(94.44±1.11)a(75.56±1.11)a(40.29±0.83)b(0.92±0.11)b(1.03±0.96)c110(73.33±1.39)b(35.56±1.88)c(24.84±1.54)c(0.11±0)c(22.93±1.91)b170(24.44±2.94)c(3.33±1.92)d(5.75±0.65)d(0.01±0)d(74.18±1.94)aNa2SO40(95.56±1.94)a(53.33±1.85)b(45.74±1.06)a(2.19±0.09)a0d50(84.44±2.94)b(66.67±2.09)a(36.87±2.00)b(0.61±0.12)b(11.30±1.65)c70(36.67±1.92)c(17.78±2.94)c(12.10±1.22)c(0.06±0.02)c(61.59±1.98)b90(16.67±2.85)d(11.11±1.01)c(6.27±1.81)d(0.03±0.01)c(82.28±1.60)aNaH-CO30(95.56±1.94)a(53.33±1.85)b(45.74±1.06)a(2.19±0.09)a0d20(91.11±1.88)a(70.00±1.94)a(38.25±2.14)b(1.46±0.10)b(4.11±1.99)c60(75.56±2.94)b(18.89±1.11)c(22.73±2.08)c(0.82±0.07)c(20.69±1.71)b100(27.78±1.11)c(8.89±2.01)d(7.82±1.68)d(0.08±0.01)d(70.93±0.75)aNa2CO30(95.56±1.94)a(53.33±1.85)a(45.74±1.06)a(1.99±0.09)a0d15(84.44±2.84)b(47.78±2.94)a(30.54±2.07)b(0.25±0.05)b(11.40±1.07)c20(65.56±2.76)c(24.44±1.11)b(19.06±1.19)c(0.15±0.04)b(30.84±1.20)b25(7.78±1.11)d0c(0.34±0.05)d0c(91.77±1.44)a
注:表中数据为“平均值±标准误”;同列不同字母表示同种盐处理间差异显著(P<0.05)。
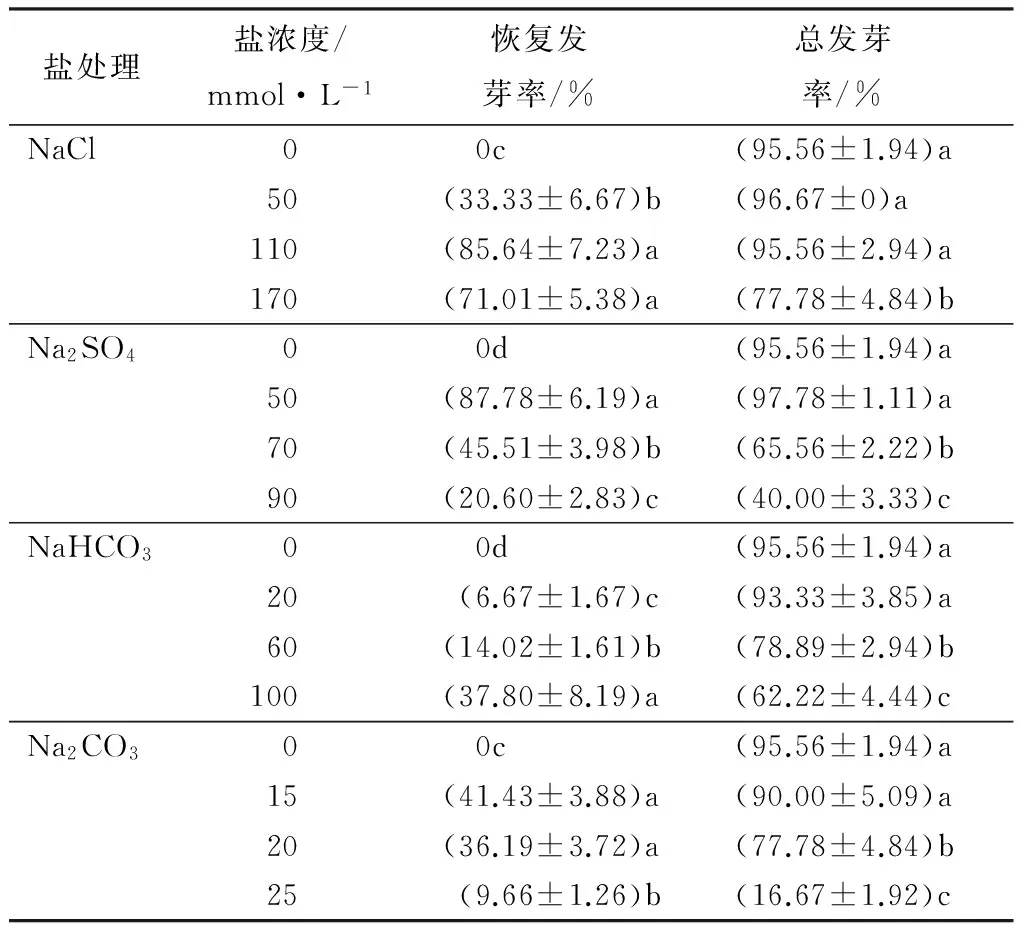
表3 解除盐胁迫后种子恢复萌发情况
注:表中数据为“平均值±标准误”;同列不同字母表示同种盐处理间差异显著(P<0.05)。
解除盐胁迫后发现(表3),各个盐胁迫浓度处理下的东北薄荷种子,复水第1天就有部分种子恢复萌发;复水第4天,低浓度(50 mmol·L-1)NaCl和Na2SO4处理下的种子基本恢复萌发,其总发芽率分别达到96.67%和97.78%,相比对照增加1.16%和2.32%,而高浓度NaCl(170 mmol·L-1)和Na2SO4(90 mmol·L-1)处理下的种子仅部分种子恢复萌发,其恢复发芽率分别为71.01%和20.60%,总发芽率达到77.78%和40.00%,且显著低于对照(P<0.05);较低浓度NaHCO3(20、60 mmol·L-1)和Na2CO3(15、20 mmol·L-1)处理下的种子其总发芽率均在75%以上,但是高浓度(100 mmol·L-1)NaHCO3处理下的种子恢复发芽率为56.68%,其总发芽率为62.22%,而高浓度(25 mmol·L-1)Na2CO3处理下的种子仅有2~3粒种子恢复萌发,且其种胚发黑,总发芽率仅为16.67%。综上所述,低浓度盐胁迫只是暂时抑制了部分东北薄荷种子的萌发,并没有完全使之失活,如果在一定时期内给予适宜的环境条件仍能恢复萌发;而高浓度二价盐(Na2SO4、Na2CO3)胁迫已给部分东北薄荷种子造成了致死伤害,其生活力已完全丧失。
2.3 盐胁迫对东北薄荷种子发芽势的影响
由表2可见,Na2CO3处理下的种子发芽势随着盐浓度的升高而呈逐渐下降趋势,而其它3种盐处理下的种子发芽势则随着盐浓度的升高而呈“先升高后下降”的趋势。与对照相比,低浓度NaCl(50 mmol·L-1)、Na2SO4(50 mmol·L-1)和NaHCO3(20 mmol·L-1)处理下的发芽势差异显著(P<0.05),分别增加41.68%、25.01%和31.26%,而15 mmol·L-1Na2CO3处理下的发芽势则无显著差异(P>0.05),仅下降10.41%;较高浓度NaCl(≥110 mmol·L-1)、Na2SO4(≥70 mmol·L-1)、NaHCO3(≥60 mmol·L-1)和Na2CO3(≥20 mmol·L-1)胁迫处理下的发芽势均显著下降,且分别在170、90、100和25 mmol·L-1处降至最低值,相比对照分别下降93.76%、79.17%、83.33%和100.00%。
2.4 盐胁迫对东北薄荷种子发芽指数的影响
由表2可见,4种单盐胁迫处理下的发芽指数均随盐浓度的升高而呈逐渐下降趋势,且同盐不同浓度处理之间差异均显著(P<0.05)。其中,低浓度NaCl(50 mmol·L-1)、Na2SO4(50 mmol·L-1)、NaHCO3(20 mmol·L-1)和Na2CO3(15 mmol·L-1)处理下的发芽指数较对照分别下降11.92%、19.39%、16.38%和33.23%;而高浓度NaCl(170 mmol·L-1)、Na2SO4(90 mmol·L-1)、NaHCO3(100 mmol·L-1)和Na2CO3(25 mmol·L-1)处理下的发芽指数则较对照分别下降87.43%、86.29%、82.90%和99.26%。以上结果表明,Na2CO3胁迫对东北薄荷种子发芽指数的影响要大于其他3种盐胁迫,当盐浓度超出一定范围后,4种盐胁迫处理下的种子发芽能力和活力均受到不同程度的抑制。
2.5 盐胁迫对东北薄荷种子活力指数的影响
由表2可见,随着盐浓度的升高,4种单盐胁迫处理下的活力指数均呈下降趋势,且同盐不同胁迫浓度下的活力指数均显著低于对照(P<0.05)。其中,在胁迫浓度为50 mmol·L-1时,NaCl和Na2SO4胁迫处理下的活力指数较对照分别下降57.80%和72.15%;而低浓度NaHCO3(20 mmol·L-1)和Na2CO3(15 mmol·L-1)处理下的活力指数较对照分别下降33.33%和88.58%。当NaCl和Na2SO4盐浓度继续升高到110 mmol·L-1和70 mmol·L-1时,活力指数骤然下降,较对照分别下降94.98%和97.26%;而NaHCO3(60 mmol·L-1)和Na2CO3(15 mmol·L-1)处理下的活力指数较对照分别下降62.56%和93.15%。当盐浓度达到170、90、100和25 mmol·L-1时,NaCl、Na2SO4、NaHCO3和Na2CO3处理下的活力指数分别由对照的2.19降至0.01、0.03、0.08和0。以上结果表明,4种单盐胁迫均不同程度的抑制了东北薄荷种子的发芽速率和生长量,并且从整体来看,Na2CO3处理对东北薄荷种子活力的抑制作用要强于其他3种盐处理。
2.6 东北薄荷种子耐盐性评价
由表2可以看出,随着盐浓度的升高,4种单盐胁迫处理下的相对盐害率均呈增加趋势,且同盐不同浓度处理之间差异显著(P<0.05)。其中,低浓度NaCl(50 mmol·L-1)和NaHCO3(20 mmol·L-1)处理下的相对盐害率较低,分别为1.03%和4.11%,而Na2SO4(50 mmol·L-1)和Na2CO3(15 mmol·L-1)处理下的相对盐害率达到11.30%和11.40%,说明东北薄荷种子对低浓度一价盐的耐受性要强于二价盐。之后随着盐浓度的继续升高,4种单盐胁迫对种子的伤害程度逐渐增大,当Na2SO4盐浓度达到70 mmol·L-1时,相对盐害率骤然上升至61.59%;而NaCl(110 mmol·L-1)、NaHCO3(60 mmol·L-1)和Na2CO3(20 mmol·L-1)处理下的相对盐害率上升幅度相差不大,分别为22.93%、20.69%和30.84%。当4种单盐胁迫浓度升至170、90、100和25 mmol·L-1时,其相对盐害率骤然增至74.18%、82.28%、70.93%和91.77%。说明高浓度盐胁迫已对东北薄荷种子萌发造成严重伤害,且二价盐(Na2SO4、Na2CO3)胁迫对东北薄荷种子的伤害程度远高于一价盐(NaCl、NaHCO3)胁迫。

综合以上结果表明,东北薄荷种子对4种单盐的耐受性由大到小为NaCl、NaHCO3、Na2SO4、Na2CO3,且东北薄荷种子对一价盐(NaCl、NaHCO3)的耐受能力强于二价盐(Na2SO4、Na2CO3)。

表4 东北薄荷种子的耐盐浓度
注:y代表相对发芽率;x1、x2、x3、x4分别代表NaCl、Na2SO4、NaHCO3、Na2CO3盐浓度。
3 结论与讨论
种子萌发期作为植物生命周期的第一阶段,在盐碱胁迫条件下,种子能否正常萌发、出苗、发育是决定农作物能否成功建植和产量的关键因素[23],盐胁迫下植物种子的萌发特性常常表现为发芽率下降,萌发进程延迟,甚至种子失去生活力而致死[21-23]。众多研究表明盐胁迫对植物种子萌发的抑制程度常与盐浓度、盐类型、胁迫时间、pH值及其植物自身耐受能力等因素相关[24-26],其对种子萌发的伤害作用主要归结为渗透效应和离子效应[27]。渗透效应引起溶液渗透势降低而使种子吸水受阻,从而影响种子萌发[28];离子效应一方面表现为盐离子(Na+、K+等)的直接毒害作用,从而抑制种子萌发,另一方面表现为离子渗入种子降低种子渗透势,加速吸水而促进萌发[29]。本研究结果表明,与对照相比,低浓度NaCl、Na2SO4和NaHCO3胁迫处理对东北薄荷种子平均发芽时间影响差异不显著(P>0.05),而随着盐浓度的升高,平均发芽时间则显著延长;Na2CO3胁迫处理则无论浓度高低均显著延长了种子的平均发芽时间。进一步从种子日发芽率来看,除25 mmol·L-1Na2CO3处理的种子几乎未萌发外,各浓度盐碱胁迫处理均延迟了东北薄荷种子初始萌发时间,且基本在第2天才开始萌发(对照组第1天已开始萌发),但在一定浓度范围内4种单盐胁迫并未延迟种子萌发峰值的来临,这可能是种子初始萌发阶段,由于盐分含量的增加,致使周围环境的渗透压升高、水势相应降低,产生渗透效应,使胚细胞吸水困难,延迟了种子初始萌发时间[30],也可能是由于盐胁迫导致种子产生浅度休眠而进入一种自我保护模式,这样可以暂缓盐胁迫带来的伤害。但是随着胁迫时间的延长,低浓度NaCl(50 mmol·L-1)、Na2SO4(50 mmol·L-1)和NaHCO3(20 mmol·L-1)盐胁迫环境条件下,种子迅速萌发,且其日发芽率均高于对照(53.33%),此现象认为是由离子效应所致,即渗入种子中的离子降低了种子渗透势,加速吸水而促进萌发[29],种子通过此方式以避免或减缓环境变化带来的负面效应[31],这可能是东北薄荷种子适应盐碱逆境的一种自我调节方式。4种盐胁迫处理下,东北薄荷种子的发芽率、发芽势等萌发指标也均受到影响。NaCl、Na2SO4、NaHCO3和Na2CO3胁迫处理下的种子发芽率、发芽指数和活力指数均呈逐渐下降趋势,而NaCl、Na2SO4和NaHCO3处理下的发芽势则表现为“低促高抑”的变化规律,可见低浓度盐溶液对种子的整体萌发速度和发芽整齐度并未造成影响。这与祖悦[32]对茶花凤仙(ImpatiensbalsamenaL.)种子的研究结果一致。当盐浓度继续升高时,4种盐处理下种子的发芽率、发芽势、发芽指数和活力指数均显著下降(P<0.05),这可能是较高浓度的盐溶液已对种子造成渗透胁迫,引起细胞质壁分离,抑制了种子的吸涨作用或者是高浓度盐离子的毒害作用,抑制了酶系统而影响胞内的新陈代谢,最终导致各项萌发指标下降[18,33]。从4种盐处理对东北薄荷种子萌发指标的抑制、伤害程度来看,碱性较强的Na2CO3盐溶液的设置浓度要比NaCl、Na2SO4和NaHCO3盐溶液的浓度低很多,但其对种子萌发的抑制作用十分明显。当Na2CO3盐浓度为25 mmol·L-1时,发芽率仅为7.78%,相对盐害率达到90%以上,而其它3种盐处理即使胁迫浓度达到最高时,其仍具有较高的发芽率(16%~30%)。说明Na2CO3胁迫对东北薄荷种子萌发的抑制作用要强于其它3种盐处理,其抑制作用除了来源于Na+的毒害作用外,还来自于碱性盐所造成的高pH作用。进一步从相对盐害率也可以看出,50 mmol·L-1NaCl和Na2SO4处理下东北薄荷种子的相对盐害率为1.03%和11.30%,而20 mmol·L-1NaHCO3和Na2CO3处理下的相对盐害率已达到4.11%和30.84%。当NaCl、Na2SO4、NaHCO3和Na2CO3浓度分别升高到110、90、100和25 mmol·L-1时,其对应的相对盐害率依次达到22.93%、82.28%、70.93%和91.77%。由此可见,东北薄荷种子萌发期对碱性盐胁迫较中性盐胁迫敏感,且NaCl盐胁迫对东北薄荷种子萌发的伤害程度远轻于其它3种盐处理。
当东北薄荷种子解除4种单盐(NaCl、Na2SO4、NaHCO3和Na2CO3)胁迫后,在盐胁迫中未萌发的薄荷种子则迅速而大量地萌发(表3)。与对照相比,其恢复萌发率随4种盐溶液浓度的升高而显著增加,其低浓度盐胁迫处理下的总发芽率和对照组的发芽率均无显著差异(P>0.05),且较高浓度NaCl(170 mmol·L-1)、Na2SO4(70 mmol·L-1)、NaHCO3(100 mmol·L-1)和Na2CO3(20 mmol·L-1)盐胁迫处理下的总发芽率相比初始发芽率均有大幅增加,其分别达到77.78%、65.56%、62.22%和77.78%,但是高浓度Na2SO4(90 mmol·L-1)和Na2CO3(25 mmol·L-1)胁迫处理下的种子恢复发芽率较低,其总发芽率仅为40.00%和16.67%,说明高浓度二价盐对部分种子已造成致死伤害,且碱性盐Na2CO3处理对种子萌发的伤害程度要重于中性盐Na2SO4处理。从种子萌发的整体情况来看,部分未萌发的薄荷种子在解除盐胁迫后仍具有较高的萌发力,说明在一定盐浓度范围内,4种盐胁迫处理对东北薄荷部分种子的萌发并未产生永久性抑制作用,其对种子萌发产生的抑制作用主要是渗透效应而不是盐离子本身对种子的直接毒害作用。分析其原因认为当未萌发种子解除盐胁迫置于蒸馏水中时,其种子内部的渗透势相对降低,此时促进种子从周围环境中吸收水分,进而使种子迅速恢复萌发;但是当盐溶液浓度超过东北薄荷种子萌发的耐受范围时,细胞内累积大量离子,使细胞质膜完整性遭受破坏,胞内代谢失调,造成永久性毒害(盐离子毒害作用),致使种子完全丧失活力[34]。
综上所述,不同浓度4种盐均抑制了东北薄荷种子的萌发,且Na2CO3的抑制作用最大,而NaCl处理对种子萌发的危害最小。本研究通过建立的函数方程进一步明确了东北薄荷种子萌发期对4种盐胁迫的耐受程度由大到小依次为NaCl、NaHCO3、Na2SO4、Na2CO3。在NaCl、Na2SO4、NaHCO3和Na2CO34种盐胁迫下,东北薄荷种子萌发的耐盐适宜浓度为119.44 mmol·L-1(0.70%)、64.64 mmol·L-1(0.92%)、64.32 mmol·L-1(0.54%)和19.27 mmol·L-1(0.20%);耐盐极限浓度为191.21 mmol·L-1(1.12%)、105.33 mmol·L-1(1.50%)、108.07 mmol·L-1(0.91%)和25.07 mmol·L-1(0.27%)。因此,在盐渍环境条件下开展东北薄荷人工种植时,应根据土壤含盐量及盐分组成有选择的播种,而对含盐量较高的区域,可以通过适时灌溉的方式促进种子迅速萌发,以缓解盐胁迫带来的危害。
[1] 黄璐琦,郭兰萍.环境胁迫下次生代谢产物的积累及道地药材的形成[J].中国中药杂志,2007,32(4):277-280.
[2] TALEI D, VALDIANI A, YUSOP M K, et al. Estimation of salt tolerance inAndrographispaniculataaccessions using multiple regression model[J]. Euphytica,2013,189(1):147-160.
[3] 万春阳,王丹,侯俊玲,等.氯化钠胁迫对甘草生长、生理及有效成分含量的影响[J].中国实验方剂学杂志,2011,17(18):118-122.
[4] 吉林省中医中药研究所.长白山植物药志[M].长春:吉林人民出版社,1982.
[5] 剑桂新,周自新,周荣汉.东北薄荷的化学型[J].植物资源与环境学报,1995,4(4):60-62.
[6] 李相来.东北薄荷的种子繁育技术[J].农业与技术,2013,33(12):96.
[7] 张侠,宋莉璐,任艳,等.椒样薄荷对NaCl胁迫的生理响应[J].安徽农业科学,2009,37(13):5967-5969.
[8] LI Z, WANG W W, LI G L, et al. MAPK-mediated regulation of growth and essential oil composition in a salt-tolerant peppermint (MenthapiperitaL.) under NaCl stress[J]. Protoplasma,2016,253(6):1541-1556.
[9] SHARIATMADARI Z, RIAHI H, ABDI M, et al. Impact of cyanobacterial extracts on the growth and oil content of the medicinal plantMenthapiperitaL.[J]. Journal of Applied Phycology,2015,27(6):2279-2287.
[10] OUESLATI S, KARRAY-BOURAOUI N, ATTIA H , et al. Physiological and antioxidant responses ofMenthapulegium(Pennyroyal) to salt stress[J]. Acta Physiologiae Plantarum,2010,32(2):289-296.
[11] BHARTI N, BARNAWAL, AWASTHI A, et al. Plant growth promoting rhizobacteria alleviate salinity induced negative effects on growth, oil content and physiological status inMenthaarvensis[J]. Acta Physiologiae Plantarum,2014,36(1):45-60.
[12] 陈连官.薄荷留兰香品种耐盐特性研究[J].上海农业科技,2006(4):25-26.
[13] HADDADI B S, HASSANPOUR H, NIKNAM V. Effect of salinity and waterlogging on growth, anatomical and antioxidative responses inMenthaaquaticaL.[J]. Acta Physiologiae Plantarum,2016,38(5):119-129.
[14] 姚荣江,杨劲松,刘广明.东北地区盐碱土特征及其农业生物治理[J].土壤,2006,38(3):256-262.
[15] 杨春武,李长有,张美丽,等.盐、碱胁迫下小冰麦体内的pH及离子平衡[J].应用生态学报,2008,19(5):1000-1005.
[16] MILLER T. Effects of emergence time on survival and growth in an early old-field plant community[J]. Oecologia,1987,72(2):272-278.
[17] 罗君,彭飞,王涛,等.黑果枸杞(Lyciumruthenicum)种子萌发及幼苗生长对盐胁迫的响应[J].中国沙漠,2017,37(2):261-267.
[18] 唐华江,赵丽丽,陈超,等.不同处理方法对2种雀稗属牧草种子萌发的影响[J].种子,2017,36(2):73-77.
[19] 曹满航,李进,张婷,等.温度和水分及盐分胁迫对银沙槐种子萌发的影响[J].西北植物学报,2011,31(4):746-753.
[20] 张绍山,刘璇,王景富,等.多因素处理对云南重楼及其多芽品系种子萌发的影响[J].中草药,2017,48(10):2111-2115.
[21] 姜云天,张丽娜,顾地周,等.盐胁迫对茶花凤仙种子萌发的影响[J].东北林业大学学报,2014,42(3):37-41.
[22] 刘玉艳,王辉,于凤鸣,等.盐胁迫对二色补血草种子萌发的影响[J].生态学杂志,2009,28(9):1794-1800.
[23] FANG Y J, LI J, JIANG J J, et al. Physiological and epigenetic analyses ofBrassicanapusseed germination in response to salt stress[J]. Acta Physiologiae Plantarum,2017,39(6):128-139.
[24] 徐小玉,张凤银,曾庆微.NaCl和Na2SO4盐胁迫对波斯菊种子萌发的影响[J].东北林业大学学报,2014,42(4):55-59.
[25] 王进,罗光宏,颜霞,等.单盐胁迫对蒙古扁桃种子萌发和幼苗生长的影响[J].中草药,2017,48(12):2509-2515.
[26] 王妮妮.混合盐碱胁迫对皂荚种子萌发的影响[J].东北林业大学学报,2017,45(4):14-18,27.
[27] 陆玉建,高春明,郑香峰,等.盐胁迫对拟南芥种子萌发的影响[J].湖北农业科学,2012,51(22):5099-5104.
[28] 郑安俭,王州飞,张红生.作物种子萌发生理与遗传研究进展[J].江苏农业学报,2017,33(1):218-223.
[29] 鱼小军,师尚礼,龙瑞军,等.生态条件对种子萌发影响研究进展[J].草业科学,2006,23(10):44-49.
[30] 高暝,李毅,种培芳,等.渗透胁迫下不同地理种源白刺的生理响应[J].草业学报,2011,20(3):99-107.
[31] 王志才,牙库甫江·阿西木,王艳,等.水盐胁迫对花花柴种子萌发的影响[J].中国沙漠,2012,32(3):750-755.
[32] 祖悦.中性盐和碱性盐胁迫对香豌豆和茶花凤仙的影响[D].牡丹江:牡丹江师范学院,2016.
[33] 庄华蓉.单盐和混合盐胁迫对沙冬青种子萌发的影响[J].节水灌溉,2015(2):15-20.
[34] 庞克坚,宋占丽,赵晓英.盐胁迫对蓝蓟种子萌发及早期幼苗的影响[J].中国野生植物资源,2012,31(5):37-40.
