亲和双水相胶束系统的相行为及其应用
2018-03-07周鑫鑫
刘 耀, 周鑫鑫, 邓 刚
(浙江师范大学 化学与生命科学学院,浙江 金华 321004)
双水相胶束系统(aqueous two-phase micellar system,ATPMS)是一种生物化学领域的液液萃取技术,因其具有生物相容性好、可调节因素多、对膜蛋白增溶效果好等优点而备受关注[1-2].在这个系统中,表面活性剂水溶液在一定条件下会自发分离成互不相溶的胶束富集相与胶束缺失相,利用两相间物理化学性质的差异,根据体积排阻效应、静电相互作用和疏水相互作用等的不同,实现不同生物分子的分离[3].自1981年Bordier[4]使用表面活性剂Triton X-114(TX)构成的双水相系统,首次实现两亲性内膜蛋白与亲水蛋白的分离后,双水相胶束系统就被成功应用于蛋白质[5-7]、抗生素[8]和DNA[9]等多种生物分子的萃取.近年来,更多的研究集中在双水相胶束系统中引入亲和配基以提高萃取的回收率和特异性.如Garg等[10]在TX上偶联色素形成一种亲和表面活性剂对乳酸脱氢酶的分离;Lam等[11]利用非离子型表面活性剂C10G1与CBM9标签间的亲和作用,对带有CBM9标签的绿色荧光蛋白GFP进行分配;Wang等[12]初步探索由TX螯合镍离子与TX构成的亲和双水相胶束系统对富组氨酸标签蛋白EGFP的萃取效果等.

(a)HM-EO

(b)TX-Cu(Ⅱ)
在疏水改性聚氧乙烯(HM-EO)形成的一元胶束系统中进行实验[13-14],引入带有亲和配基的小分子表面活性剂Triton X-114-IDA-Cu(Ⅱ)(TX-Cu(Ⅱ)),构建新型的亲和双水相混合胶束系统HM-EO/TX-Cu(Ⅱ)(见图1).考察了亲和表面活性剂加入量、温度、pH、盐离子浓度及种类对新系统液液相平衡性质的影响.并以重组蛋白3′,5′-二磷酸核苷酸酶为模型蛋白,研究新系统对富组氨酸蛋白的萃取选择性效果,为其实际应用提供基础依据.
1 材料与方法
1.1 试剂与仪器
疏水改性聚氧乙烯(HM-EO)购于瑞典Akzo Nobel Surface Chemistry AB公司,分子量约为55.8 kD;Triton X-114购于上海生工生物工程有限公司;亚氨基二乙酸(IDA)购自国药集团化学试剂有限公司;3′,5′-二磷酸核苷酸酶,实验室参照Yang等[15]方法表达及纯化.其他试剂均为市售分析纯.
Cary 4000紫外分光光度计(美国安捷伦科技有限公司);FE20型pH计(上海梅特勒-托利多有限公司);DDS-307电导率仪(上海精密科学仪器有限公司);BSA224S电子分析天平(北京赛多利斯科学仪器有限公司);DZF-6050B真空干燥箱(上海一恒科学仪器有限公司);DF-101S集热式恒温加热磁力搅拌器(郑州长城科工贸有限公司).
1.2 TX-Cu(Ⅱ)的合成
TX-Cu(Ⅱ)合成方法见参考文献[16].首先,以TX为载体,通过环氧氯丙烷(ECH)法进行羟基活化;然后TX-环氧化物在碱性条件下偶联亚氨基二乙酸(IDA),经氯仿萃取并真空干燥处理,合成得到TX-IDA;最后将TX-IDA与铜离子螯合,经再次萃取得到TX-Cu(Ⅱ).
1.3 双水相相图测定
用PBS缓冲液(50 mmol/L,pH 8.0)配制质量浓度均为10%的HM-EO与TX-Cu(Ⅱ)母液.按不同配比混合两种母液,加入适量缓冲液,配制成总质量5 g的双水相体系,其中HM-EO质量分数均为2.5%,TX-Cu(Ⅱ)质量分数分别为0.0%,0.2%,0.4%,0.6%,0.8%和1.0%.体系混合均匀,于10 ℃水浴中恒温静置24~48 h分相.测定上相与下相体积,并分别取样测定HM-EO含量.
HM-EO浓度测定[17]:称取一定量的待测样品,加入等量丙酮,并用质量比为1∶1的丙酮-水溶液稀释.取0.5 g稀释液,加入5 mL考马斯亮蓝G250试剂,静置30 min,620 nm处测吸光值,由标准曲线得到HM-EO浓度.利用称重法(真空干燥法)求得上下相中水的含量,质量衡算得到两相中TX-Cu(Ⅱ)含量,进而绘制相图描述双水相胶束系统的相行为.实验重复3次,取平均值.
1.4 模型蛋白亲和分配
YND用PBS缓冲液(50 mmol/L,pH 8.0)配制成2.5 mg/mL母液.取2 mL母液加入到不同配比的HM-EO与TX-Cu(Ⅱ)混合溶液中,配制成5 g的ATPMS,其中HM-EO质量分数为2.5%,TX-Cu(Ⅱ)质量分数从0.00%~0.15%变化.混合均匀,1 000 r/min离心5 min后于10 ℃水浴中恒温静置5 h分相.取样分析上下相中YND的酶活以及总蛋白含量.
YND活性根据PAP水解作用中NADH的消耗测定[15].酶活力单位(U)定义为特定条件下(4 ℃,pH 8.0),每min可以氧化1 μmol NADH所需的酶量.总蛋白浓度采用Lowry法[18],以BSA标准品制作标准曲线.分配系数Ke表示系统上相与下相中酶浓度的比值;Yt与Yb分别为上下相的酶活回收率(%).
2 结 果
2.1 双水相胶束系统相图
新构建的双水相胶束系统中,HM-EO是一个嵌段共聚物,亲水的聚氧乙烯链上带有表面活性基团,能与合成的亲和表面活性剂TX-Cu(Ⅱ)形成混合胶束[13].图2为2.5%的HM-EO与不同浓度TX-Cu(Ⅱ)形成的双水相胶束系统.图2显示,HM-EO与TX-Cu(Ⅱ)的配比显著影响了新双水相系统的成相稳定性,随着TX-Cu(Ⅱ)浓度的增加,两相间的双结线长度逐渐变短,表明体系由两相趋于均相.TX-Cu(Ⅱ)浓度在0.0%~0.6%时,系统中TX-Cu(Ⅱ)主要分配在下相,与HM-EO形成带亲和配基的混合胶束;随着TX-Cu(Ⅱ)含量的增加,下相中由高分子聚氧乙烯HM-EO形成的空间网状结构逐渐崩溃,相分离更加困难;在TX-Cu(Ⅱ)浓度高于1.0%以后,系统趋于均相,TX-Cu(Ⅱ)可能更多地以单胶束的形式存在.
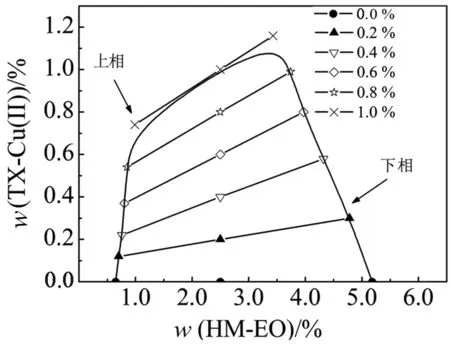
图2 HM-EO/TX-Cu(Ⅱ)系统相图
2.2 温度对HM-EO/TX-Cu(Ⅱ)系统相图的影响
图3显示,随着温度的升高,系统的两相区域(共存曲线之间的区域)逐渐变大,表明升高温度有利于系统的分相.系统温度升高会破坏HM-EO聚氧乙烯链与水分子之间的氢键结合,促进水分子从下相自发转移至上相,增加聚合物在下相的浓度,从而有利于胶束之间网状结构的形成[19-20].另外,分子热运动加剧,带亲和配基的小分子表面活性剂TX-Cu(Ⅱ)更易插入到HM-EO网状结构中形成混合胶束,对新构建系统的稳定有利.在本研究中,由于主成相剂HM-EO的分子量较大、浊点低,因此,系统中加入一定比例TX-Cu(Ⅱ)所构成的HM-EO/TX-Cu(Ⅱ)系统在较低的温度下(4 ℃)可以稳定快速分相[14-21],并且上下相的水含量均超过90%,适合用于对生物活性物质的萃取.
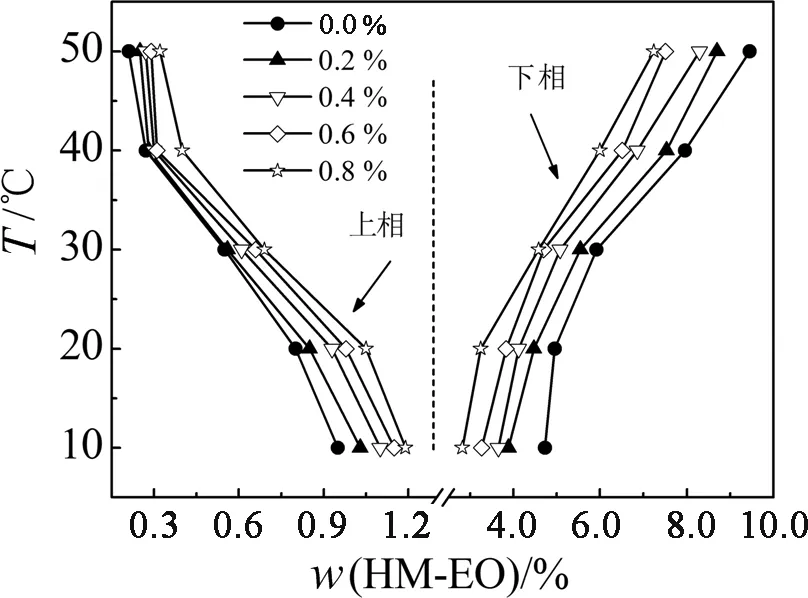
图3 HM-EO/TX-Cu(Ⅱ)系统在不同温度下的相图
2.3 pH对HM-EO/TX-Cu(Ⅱ)系统相图的影响
实验考察pH对系统相图的影响,结果如图4所示.随着pH值的降低,两相区域逐渐变大,上相HM-EO胶束浓度减少,下相胶束浓度增大,表明新构建的ATPMS在酸性环境更容易分相.表1显示,TX-Cu(Ⅱ)在下相的含量随着溶液pH值降低逐渐增大,HM-EO与带亲和配基的小分子表面活性剂可以形成更加稳定的双水相胶束系统.由于溶液的pH会显著影响蛋白质分子的电性及所带电荷数,所以可以调节蛋白质在系统中的分配系数[22]。因此,选择合适的pH对该双水相体系用于蛋白质的分配具有潜在的研究价值.

图4 溶液pH对HM-EO/TX-Cu(Ⅱ)系统相图的影响
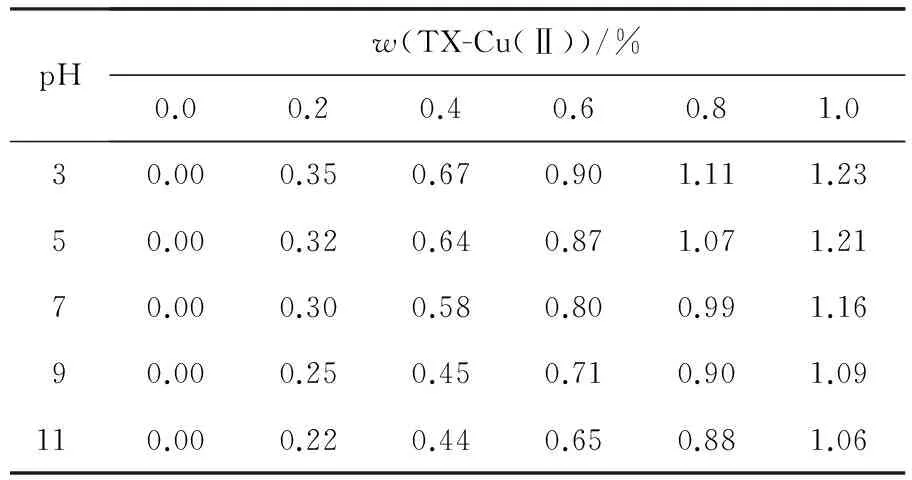
pHw(TX-Cu(Ⅱ))/%0.00.20.40.60.81.030.000.350.670.901.111.2350.000.320.640.871.071.2170.000.300.580.800.991.1690.000.250.450.710.901.09110.000.220.440.650.881.06
2.4 无机盐浓度对HM-EO/TX-Cu(Ⅱ)系统相图的影响
无机盐虽然不是成相的必需组分,但是在应用双水相胶束系统分离生物物质时,系统中通常会存在一定浓度的无机盐,盐浓度对相平衡性质会产生一定的影响.另外,盐浓度发生微小变化即可显著影响生物分子的分配[19],因此,在实际应用双水相胶束系统之前,需先了解无机盐对相行为及分配行为的影响.图5考察不同盐浓度对HM-EO/TX-Cu(Ⅱ)系统相平衡的影响,结果显示,随着NaCl浓度的增大,系统两相区域逐渐增大.一方面,添加盐离子可以压缩混合胶束扩散双电层,胶束网状结构收缩并在下相聚集.另一方面,无机盐的加入引起反离子静电屏蔽作用的增强[19],胶束带电聚集体离子头基间的距离缩短,胶束间斥力减弱,小分子表面活性剂TX-Cu(Ⅱ)更容易进入下相与HM-EO形成混合胶束(见表2).因此,通过增加盐浓度,有利于混合胶束网络的形成,促进新构建系统的成相与稳定.

图5 NaCl浓度对HM-EO/TX-Cu(Ⅱ)系统相图的影响
表2 NaCl浓度对不同质量分数TX-Cu(Ⅱ)在下相含量的影响
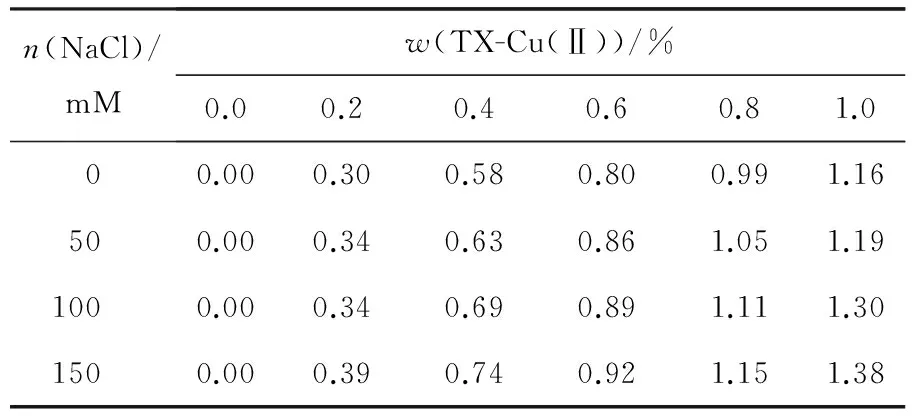
n(NaCl)/mMw(TX-Cu(Ⅱ))/%0.00.20.40.60.81.000.000.300.580.800.991.16500.000.340.630.861.051.191000.000.340.690.891.111.301500.000.390.740.921.151.38
2.5 不同种类盐离子对HM-EO/TX-Cu(Ⅱ)系统相图的影响

图7为阳离子对系统相图的影响.通过对比图7(a)和图7(b)常见的氯化盐及溴化盐,结果表明,K+在促进系统分相效果上略优于Na+.一般地,阳离子加入系统后,能够自发地与聚氧乙烯链相结合(熵增加过程)而使其“脱水”,这种去溶剂化效应有利于系统分相,随着结合位点逐渐接近饱和,熵不再增加,系统达到相平衡.在一定浓度范围内,与Na+相比,K+更易与聚氧乙烯链结合而达到饱和,因而,添加有K+的系统存在较大的两相区域[24].

图6 不同种类阴离子对HM-EO/TX-Cu(Ⅱ)系统相图的影响
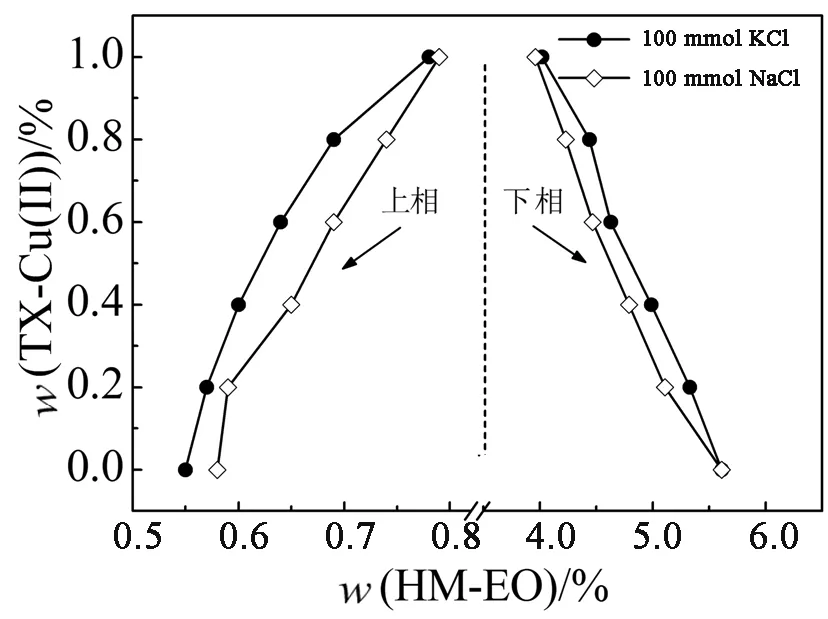
(a)氯化盐
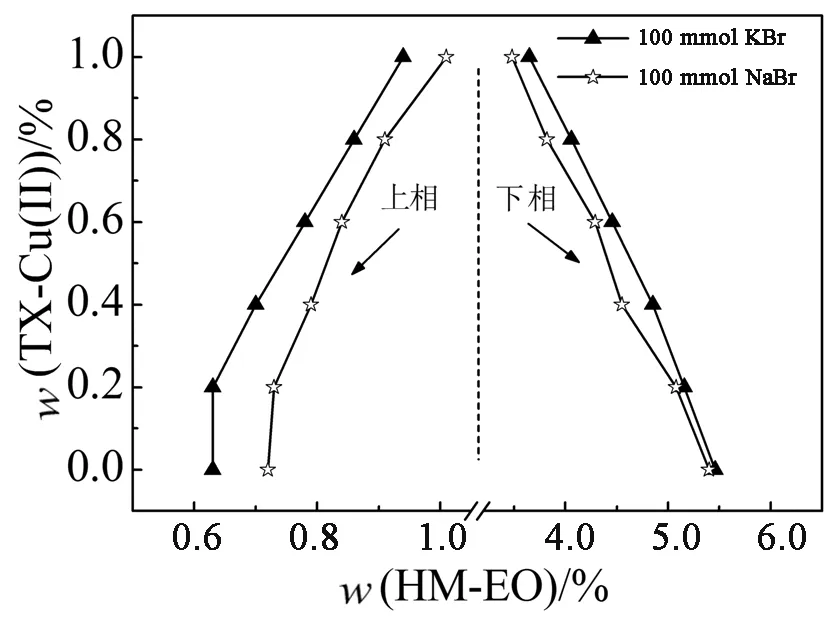
(b)溴化盐
2.6 YND在HM-EO/TX-Cu(Ⅱ)系统中的亲和分配
在模型蛋白分配实验中,重组蛋白YND带有六聚组氨酸标签.图8显示,系统中不含TX-Cu(Ⅱ)时,YND主要分配于上相(Ke=1.681),但是TX-Cu(Ⅱ)的存在可以改变YND分配行为,使其从倾向于分配到上相转为更易分配于下相.并且,随着TX-Cu(Ⅱ)在系统中含量的增加,ATPMS萃取分离的选择性增强,Ke在TX-Cu(Ⅱ)浓度为0.150%时降至0.153%,表明TX-Cu(Ⅱ)在富组氨酸蛋白分配中具有高的亲和结合效率.酶活回收代表分配过程中酶活性损失的程度.图8还显示,TX-Cu(Ⅱ)浓度在0.00%~0.15%时,YND酶活回收率总和下降小于2.60%,TX-Cu(Ⅱ)对酶活影响不大,这与Wang等[12]的研究结论相一致.因此,实验构建的HM-EO/TX-Cu(Ⅱ)系统可以有效用于对富组氨酸蛋白YND的分离纯化.
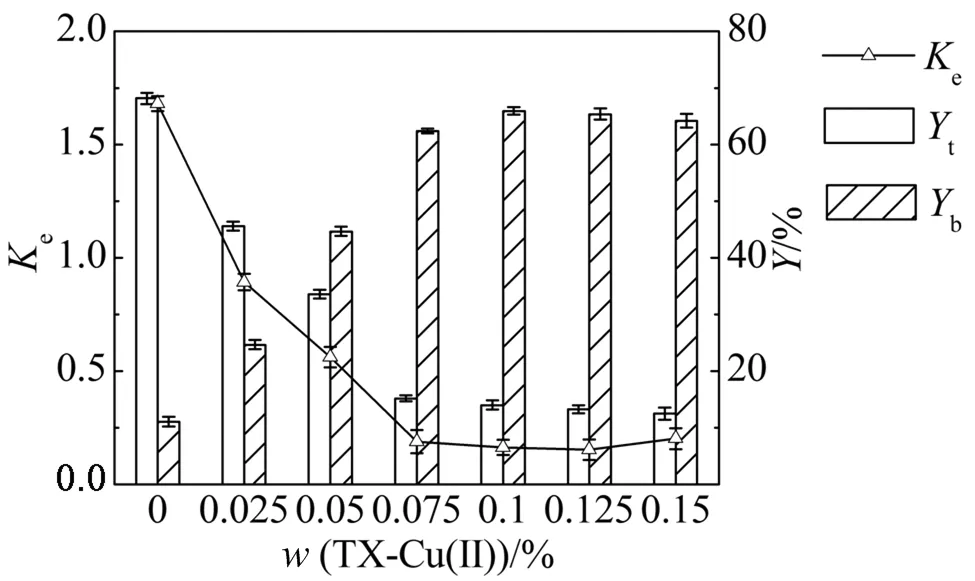
图8 TX-Cu(Ⅱ)浓度对YND分配的影响
3 讨 论
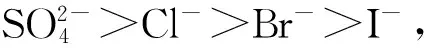
[1]Liu C L,Nikas Y J,Blankschtein D.Novel bioseparations using two-phase aqueous micellar systems[J].Biotechnology and Bioengineering,1996,52(2):185-192.
[2]Lopes A M,Pessoa-Jr A,Rangel-Yagui C D O.Can affinity interactions influence the partitioning of glucose-6-phosphate dehydrogenase in two-phase aqueous micellar systems[J].Quimica Nova,2008,31(5):998-1003.
[3]Liu C L,Kamei D T,King J A,et al.Separation of proteins and viruses using two-phase aqueous micellar systems[J].Journal of Chromatography B,1998,711(2):127-138.
[4]Bordier C.Phase separation of integral membrane proteins in Triton X-114 solution[J].The Journal of Biological Chemistry,1981,256(4):1604-1607.
[5]Becker J S,Thomas O R T,Franzreb M.Protein separation with magnetic adsorbents in micellar aqueous two-phase systems[J].Separation and Purification Technology,2009,65(1):46-53.
[6]Fischer I,Hsu C C,Gaertner M,et al.Continuous protein purification using functionalized magnetic nanoparticles in aqueous micellar two-phase systems[J].Journal of Chromatography A,2013,1305(1):7-16.
[7]Jaramillo P M D,Gomes H A R,Siqueira F G,et al.Liquid-liquid extraction of pectinase produced byAspergillusoryzaeusing aqueous two-phase micellar system[J].Separation and Purification Technology,2013,120(1):452-457.
[8]Santos V C,Hasmann F A,Converti A,et al.Liquid-liquid extraction by mixed micellar systems:A new approach for clavulanic acid recovery from fermented broth[J].Biochemical Engineering Journal,2011,56(2):75-83.
[9]Mashayekhi F,Meyer A S,Shiigi S A,et al.Concentration of mammalian genomic DNA using two-phase aqueous micellar systems[J].Biotechnology and Bioengineering,2009,102(6):1613-1623.
[10]Garg N,Galaev I Y,Mattiasson B.Use of a temperature-induced phase-forming detergent (Triton X-114) as ligand carrier for affinity partitioning in an aqueous three-phase system[J].Biotechnology and Applied Biochemistry,1994,20(2):199-215.
[11]Lam H,Kavoosi M,Haynes C A,et al.Affinity-enhanced protein partitioning in decyl β-D-glucopyranoside two-phase aqueous micellar systems[J].Biotechnology and Bioengineering,2005,89(4):381-392.
[12]Wang S,Bai S,Dong X Y,et al.Partitioning behavior of enhanced green fluorescent protein in nickel-chelated affinity-based aqueous two-phase micellar system and its purification from cell lysate[J].Separation and Purification Technology,2014,133(36):149-154.
[13]Thuresson K,Karlson L,Lindman B.Clouding of a cationic hydrophobically associating comb polymer[J].Colloids and Surfaces A Physicochemical and Engineering Aspects,2002,201(3):9-15.
[14]Jonsson M,Johansson H O.Protein partitioning in thermoseparating systems of a charged hydrophobically modified ethylene oxide polymer[J].Journal of Chromatography A,2003,983(2):133-144.
[15]Yang Y,Ma J,Yang Y,et al.Yeast 3′,5′-bisphosphate nucleotidase:An affinity tag for protein purification[J].Protein Expression and Purification,2014,97(2):81-87.
[16]Lu J,Lin D Q,Yao S J.Preparation and application of novel EOPO-IDA-Metal polymer as recyclable metal affinity ligand in aqueous two-phase systems[J].Industrial and Engineering Chemistry Research,2006,45(5):1774-1779.
[17]Deng G,Yao S J,Lin D Q.Partitioning of proteins using a hydrophobically modified ethylene oxide/SDS aqueous two-phase system[J].World Journal of Microbiology and Biotechnology,2005,21(6):1209-1214.
[18]Lowry O H,Rosebrough N J,Farr A L,et al.Protein measurement with the folin phenol reagent[J].The Journal of Biological Chemistry,1951,193(1):265-275.
[19]Santos-Ebinuma V C,Lopes A M,Converti A,et al.Behavior of Triton X-114 cloud point in the presence of inorganic electrolytes[J].Fluid Phase Equilibria,2013,360(9):435-438.
[20]Blankschtein D,Thurston G M,Benedek G B.Phenomenological theory of equilibrium thermodynamic properties and phase separation of micellar solutions[J].Journal of Chemical Physics,1986,85(85):7268-7288.
[21]Saeki S,Kuwahara N,Nakata M,et al.Upper and lower critical solution temperatures in poly (ethylene glycol) solutions[J].Polymer,1976,17(8):685-689.
[22]Hasmann F A,Pessoa A J,Roberto I C.Screening of variables in β-xylosidase recovery using cetyl trimethyl ammonium bromide reversed micelles[J].Applied Biochemistry and Biotechnology,2001,93(1):719-728.
[23]Yang Z.Hofmeister effects:An explanation for the impact of ionic liquids on biocatalysis[J].Journal of Biotechnology,2009,144(1):12-22.
[24]Martins J P,Oliveira F C D,Coimbra J S D R,et al.Equilibrium phase behavior for ternary mixtures of poly (ethylene) glycol 6 000+ water+ sulfate salts at different temperatures[J].Journal of Chemical and Engineering Data,2008,53(10):2441-2443.
