牦牛精子总RNA提取方法的研究
2018-03-07凌笑笑梁春年吴晓云王宏博
唐 朋 ,凌笑笑,梁春年,吴晓云,褚 敏,王宏博,阎 萍*
(1.甘肃农业大学动物科学技术学院,甘肃兰州 730070;2.中国农业科学院兰州畜牧与兽药研究所,甘肃兰州 730050;3.甘肃省牦牛繁育重点实验室,甘肃兰州 730050)
传统观点认为,成熟的精子是基因转录停止的细胞,几乎不存在mRNA[1]。但近年来,聚焦于精子RNA的表达研究及cDNA检测发现,成熟精子中存在大量编码与非编码RNA,这些RNA的种类和转录功能复杂,参与调控精子受精、获能及胚胎的早期发育等生理过程[2-4]。因此,分析和研究精子RNA是了解受精及胚胎早期发育中遗传信息传递的重要途径,有助于提高动物的繁殖性能。但由于精子细胞核被一薄层细胞质覆盖以及RNA含量极微等自身特征的限制,需要优化提取方法才能获得高质量的精子RNA。目前,人、牛、猪等动物精子RNA提取已有报道[5-7],但对牦牛精子的研究却很少。本实验在前人研究基础上,以牦牛精液为研究对象,通过3种方法对RNA提取进行探索研究,为后续研究精子的基因表达及功能提供理论基础。
1 材料与方法
1.1 材料
1.1.1 实验动物与精子采集 选择3头健康、繁殖能力正常的大通牦牛种公牛的细管冻精,各15支,精子密度≥108精子/mL,精子活率≥0.35。
1.1.2 主要试剂 PercollTM纯化剂(GE Healthcare),PBS缓冲液(Solarbio),TRIzol®Reagent裂解液(Ambion),β-巯基乙醇(南京建成生物工程研究所),核酸助沉剂(Acryl Carrier),DNase/Rnase -Free Water,RNeasy Kit( 德 国,Qiagen),Transcriptor First Stand cDNA Synthesis Kit(Roche),枪头和试管均用DEPC处理。
1.2 方法
1.2.1 精液解冻及精子纯化 从液氮中取出细管冻精,38℃水浴解冻,分别检测每头牦牛精液密度,从每头牦牛精液中取相同数量的精子构建精子池,从精子池中取约3×107个精子细胞进行纯化。将精液缓慢在3倍体积45% Percoll单层梯度液上层,1 500 r/min离心20 min,弃上清;向沉淀中加3 mL 1×PBS缓冲液,涡旋30 s,5 000 r/min离心5 min,留沉淀,清洗2次。
1.2.2 精子总RNA提取 纯化后的精子沉淀用RNeasy Kit(德国,Qiagen)、热TRIzol法和TRIzol一步法分别提取总RNA,每种提取方法按精子数量加入适量裂解液,即每1×107个精子细胞加1 mL TRIzol或600 μL提取RLT缓冲液。热TRIzol法提取的主要步骤:向洗涤后的精子沉淀中加适量TRIzol,反复吹打5 min,涡旋30 s;加 40 μLβ-巯基乙醇,混匀,65℃ 水浴 45 min,立即取出冰浴1 min;加200 μL氯仿,用力振荡15 s,室温静置10 min,12 000×g,4℃离心15 min;取水相,加500 μL异丙醇和5 μL核酸助沉剂,混匀,4℃静置15 min,12 000×g,4℃离心10 min,弃上清;分别加75%乙醇和无水乙醇500 μL漂洗沉淀一次,5 000×g,4℃离心5 min,弃上清,室温干燥,待乙醇完全挥发后,加 20 μL RNase-free Water水溶解 RNA。
TRIzol一步法提取的主要步骤:向精子沉淀中加入1 mL TRIzol,反复吹打5 min,涡旋30 s,室温静置10 min后,直接加200 μL氯仿,其余步骤与热TRIzol法相似。
RNeasy Kit提取的主要步骤:向沉淀中加适量RLT缓冲液,吹打30 s,反复通过20 G一次性注射器针头10次以剪切DNA;加入等体积70%乙醇,吹打混匀后加至RNA吸附柱,8 000 ×g离心15 s;弃液后向吸附柱中加350 μL RW1缓冲液,8 000×g离心15 s;加100 μL Dnasel工作液至吸附柱,室温静置15 min,加 350 μL RW1缓冲液,再漂洗 1次;加 500 μL RPE缓冲液至吸附柱,8 000×g离心15 s;加500 μL RPE缓冲液至吸附柱,12 000×g离心2 min;加20 μL RNasefree Water 水至吸附柱膜上,12 000×g离心1 min,收集管中的洗脱液即为精子总RNA。用紫外分光光度计测定含量和OD260/280。
1.2.3 反 转 录 取 10 μL 总 RNA, 加 1 μL Oligo(dT)
18,2 μL随机引物,混匀,65℃孵育10 min后迅速置于冰上;加5×逆转录缓冲液(含Mg2+)4 μL, RNA酶抑制剂0.5 μL,dNTPs(10 mmol/ L)2 μL 和逆转录酶 0.5 μL,混匀后,25℃ 10 min,55℃ 30 min,85℃ 5 min,冰上急冷5 min终止反应,-20℃保存。以逆转录所得cDNA作模板进行聚合酶链反应(PCR)扩增。
1.2.4 RNA完整性及基因组DNA和体细胞去除效果检测 利用Primer5.0软件根据GenBank中牛mRNA和cDNA设计引物(表1)。CDH1(NCBI登录号:NM_001002763.1)、CD45(NCBI登录号:NM_0012 06523.1)、和c-kit(NCBI登录号:NM_001166484.1)基因分别作为表皮细胞、白细胞和生殖细胞污染的标记基因。GAPDH(NCBI登录号:NM_001034034.2)、β-actin(NCBI登 录 号:NM_173979.3)、SRY(NCBI登录号:NM_001014385.1)和RPS23(NCBI登录号:NM_001034690.2)基因用于检测RNA完整性。其中GAPDH基因的第3外显子和第4外显子设计1对特异性引物,其产物涵盖了第4内含子完整序列,当RNA不含DNA污染时,RT-PCR产物条带为126 bp,若含DNA污染时,则显示217 bp条带。25 μL PCR体系:TaqTMDNA 聚合酶 mix 12.5 μL,上、下游引物各 1 μL,cDNA 6 μL,RNase-free water 4.5 μL。PCR 程 序:94℃预变性5 min;94℃变性30 s,退火30 s(表1),循环36次;最后72℃延伸10 min。RT-PCR产物取5 μL经2.0%琼脂糖凝胶电泳鉴定。

表1 PCR引物
1.3 统计分析 使用SPSS19.0对总RNA量及浓度、OD260/280值和单个精子细胞RNA量进行单因素方差分析,P<0.05为差异显著。
2 结 果
2.1 冷冻精子的纯化 为了尽可能获得较多精子,同时又尽量去除精液中其他细胞的污染,本次实验采用3倍体积、单层45% Percoll梯度液离心纯化精子。如图1所示,纯化效果较为理想,可进行后续实验。
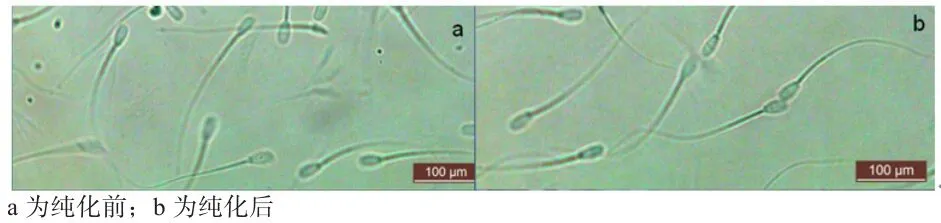
图1 精子纯化结果
2.2 精子总RNA纯度检测 由表2可知,试剂盒提取精子RNA的OD260/280值为1.89,显著高于热TRIzol法与TRIzol一步法(P<0.05),证明RNA纯度较高;热TRIzol法与TRIzol一步法提取精子RNA的OD260/280值为1.64~1.66,均小于1.8,可能混有酚类、醇类、蛋白质或胍盐。采用试剂盒提取精子总RNA量为988.67 ng,每个精子细胞RNA平均含量为32.96 fg,均显著高于热TRIzol法与TRIzol一步法(P<0.05);采用热TRIzol法提取精子总RNA量为753.33 ng,每个精子细胞RNA平均含量为25.11 fg,均显著高于TRIzol一步法(P<0.05)。表明试剂盒可获得较高质量的精子总RNA。
2.3 RNA质量检测
2.3.1 RNA完整性及基因组DNA去除效果检测 如图2所示,各个RNA样品均在126 bp和177 bp处出现条带,与GAPDH和β-actin基因的扩增产物理论长度一致。扩增产物中没有出现217 bpGAPDH基因组条带,说明3种方法制备的精子总RNA完整性较好且均无基因组DNA污染。从条带的亮度上分析,试剂盒提取的总RNA经RT-PCR检测的基因条带最清晰,与总RNA浓度检测结果一致。
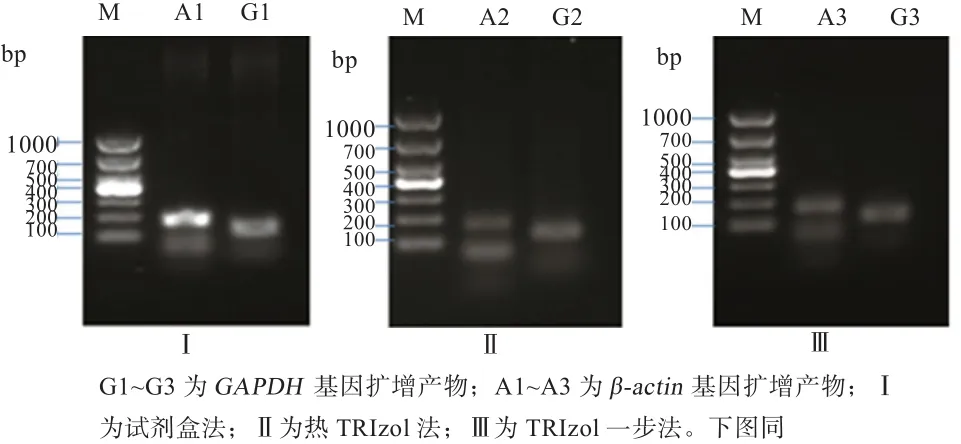
图2 GAPDH和β-actin基因扩增电泳图
各RNA样品针对成熟精子细胞内表达的基因SRY、RPS23的RT-PCR检测发现(图3),试剂盒提取的RNA扩增出SRY、RPS23基因条带;热TRIzol和TRIzol一步法均只出现SRY基因条带,这说明试剂盒提取精子总RNA的质量优于另外2种方法。
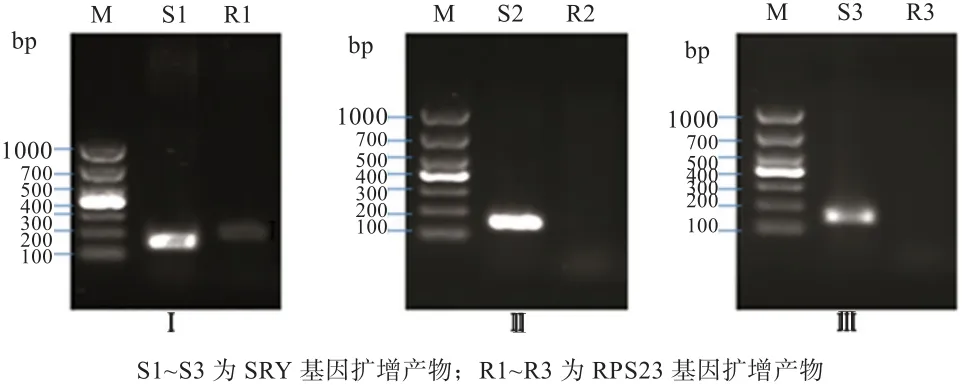
图3 SRY 和 RPS23基因扩增电泳图
2.3.2 体细胞去除效果检测 各总RNA样品针对基因CD45、CDH1和c-kit的RT-PCR检测结果显示(图4),3种不同方法制备的精子总RNA样品均未检测到上述目的基因条带,表明各RNA样品中均未受到表皮细胞、白细胞和生殖细胞污染。

图4 CD45、CDH1和c-kit基因扩增电泳图
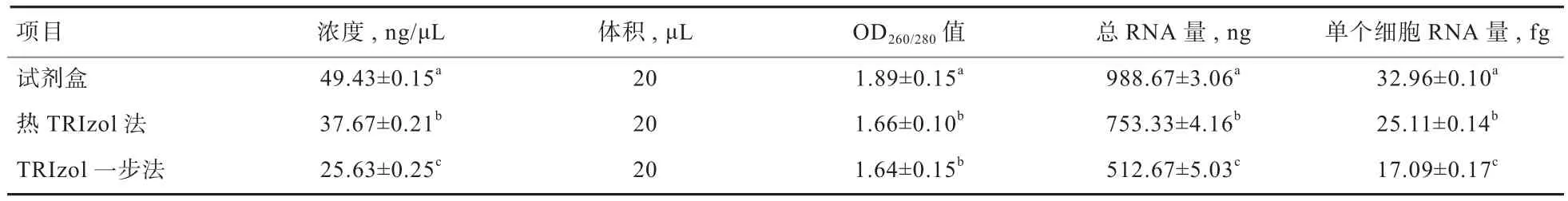
表2 总RNA浓度检测
3 讨 论
目前,通过哺乳动物精液分析基因表达评估动物的生殖能力被广泛认为是一种新的技术手段[8]。精子发生是一个复杂的过程,包括精原干细胞的分裂、分化到成熟精子的形成。精子mRNA表达水平反映睾丸精子发生的过程,一些重要的调节因子通过影响靶mRNA的表达进而参与精子发生的各个阶段,可用于雄性不育的检测和治疗[9]。精子纯化是RNA制备的关键,而精液中存在精浆及生精细胞、白细胞和上皮细胞[10]等的污染,提取RNA首要去除基因组DNA的污染。目前,Percoll密度梯度离心法和上浮法纯化精子被广泛应用于生殖技术中。有研究表明,Percoll梯度离心法相比于上浮法可更有效地去除精液中存在的其他细胞成分,活精子回收率更高[12]。周其赵等[13]通过比较双层及单层梯度液纯化效果发现,2种方法均能分离出精子,但单层梯度液分离后回收率较高,符合精子RNA提取要求。本实验采用3倍体积45% Percoll单层梯度液进行纯化,显微镜下未见到圆形细胞,与人精子上研究结果一致[14];RT-PCR结果显示,CDH1、CD45和c-kit标记基因条带出现,说明提取的RNA无体细胞污染[15]。
另外,精子染色质重塑产生浓缩的核结构导致核基因组转录受到抑制,且这种包装存在物种差异,因此各物种提取精子RNA的最适方法不同。近年来,人、奶牛常采用试剂盒提取精子RNA[5,11],猪精子RNA采用TRIzol法提取[7],Gilbert等[6]采用热TRIzol法对牛精子RNA提取进行了优化。本实验中,TRIzol一步法与热TRIzol法提取牦牛精子RNA,OD260/280值在1.6左右。OD260/280值偏低的原因可能与精子RNA含量太少、细胞结构的特殊性和精子使用量大有关;精子核、膜和尾的结构都与普通细胞有差异,特别是核结构紧密,较难裂解;精子核酸、蛋白质含量高,加之使用精子数量大(约为1×107个),所以提取的RNA可能存在蛋白质污染。而试剂盒(OD260/280=1.89)提取精子不论从纯度还是浓度上均优于上述2种方法,推测是由于试剂盒能快速充分裂解精子细胞核,同时吸附柱对精子RNA较敏感,可实现少量RNA的富集。
精子RNA完整性以及是否存在基因组DNA的污染通常用RT-PCR进行检测。结果显示,GAPDH只扩增出126 bp条带,无217 bp条带,从而排除了基因组DNA的污染。通过扩增β-actin、SRY和RPS23基因以确定RNA完整性[16]。RT-PCR结果显示,试剂盒能够扩增出完整的β-actin、SRY和RPS23条带,而另外2种方法均不能扩增出RPS23基因条带,可见试剂盒提取的牦牛精子RNA完整性更好,这与奶牛上的研究一致[11]。可能是由于试剂盒法提取的RNA操作简单,用时短,减少了RNA的降解。但与于艳等[14]在人精子上研究不同,可能是精子种属差异较大所致。
4 结 论
本研究采用试剂盒(RNeasy Kit)提取牦牛精子RNA效果优于热TRIzol法和TRIzol一步法,它能使牦牛精子更充分的裂解,且操作简单,用时短,可实现少量RNA的制备以及低丰度基因在精子特异性表达的分析,为后续牦牛精子的分子生物学研究提供参考。
[1] Kierszenbaum A L, Tres L L. Structural and transcriptional features of the mouse spermatid genome[J]. J Cell Biol, 1975,65(2): 258-270.
[2] Fagerlind M, Stålhammar H, Olsson B,et al. Expression of mirnas in bull spermatozoa correlates with fertility rates[J].Reprod Domest Anim, 2015, 50(4): 587-594.
[3] Lambard S, Galerauddenis I, Martin G,et al. Analysis and significance of mRNA in human ejaculated sperm from normozoospermic donors: relationship to sperm motility and capacitation[J]. Mol Hum Reprod, 2004, 10(7): 535-541.
[4] Feng R, Sang Q, Yan Z,et al. MiRNA-320 in the human follicular fluid is associated with embryo quality in vivo and affects mouse embryonic development in vitro[J]. Sci Rep,2015, 5: 8689.
[5] 李红钢, 周慧, 官黄涛, 等. 人精子RNA的提取及含量分析[J]. 生殖医学杂志, 2008, 17(2): 104-108.
[6] Gilbert I, Bissonnette N, Boissonneault G,et al. A molecular analysis of the population of mRNA in bovine spermatozoa[J].Reproduction, 2007, 133(6): 1073-1086.
[7] 高波, 宋成义. 猪精子RNA提取及cDNA质量检测[J]. 黑龙江畜牧兽医, 2014(7): 61-63.
[8] Montjean D, De L G P, Gentien D,et al. Sperm transcriptome profiling in oligozoospermia[J]. J Assist Reprod Gen, 2012,29(1): 3-10.
[9] He Z, Kokkinaki M, Pant D,et al. Small RNA molecules in the regulation of spermatogenesis[J]. Reproduction, 2009, 137(6):901-911.
[10] Card C J, Anderson E J, Zamberlan S,et al. Cryopreserved bovine spermatozoal transcript profile as revealed by highthroughput ribonucleic acid sequencing[J]. Bio Reprod, 2013,88(2): 49.
[11] 任小霞, 陈晓丽, 李秀岭, 等. 奶牛圆形、长形、成熟精子细胞微量RNA制备和含量分析[J]. 畜牧兽医学报, 2016,47(8): 1546 -1554.
[12] 夏长所, 朱桂金, 罗丽兰, 等. Percoll密度梯度离心技术和上游法对精子的选择作用[J]. 中华泌尿外科杂志, 1996,17(10): 629.
[13] 周其赵, 冯春琼, 邹亚光, 等. 1层和2层梯度离心法分离精子的效果评价[J]. 中华男科学杂志, 2010, 16(3): 217-219.
[14] 于艳, 管群, 张斌, 等. 人类精子高质量RNA提取方案的优化[J]. 实用医学杂志, 2013, 29(21): 3589-3593.
[15] Goodwin L O, Karabinus D S, Pergolizzi R G. Presence of N-cadherin transcripts in mature spermatozoa[J]. Mol Hum Reprod, 2000, 6(6): 487-497.
[16] Han C M, Chen R, Li T,et al. Evaluation of the semen swim-up method for bovine sperm RNA extraction[J]. Genet Mol Res,2016, 15(2): 1-9.
