后部可逆性脑病综合征2例病例报告
2018-03-07金首跃龙治元张海南尹炜凡
金首跃, 蒋 波, 龙治元, 杨 利, 张海南, 尹炜凡
后部可逆性脑病综合征(posterior reversible encephalopathy syndrome,PRES)是指患者在特定临床情况下出现皮质下可逆性血管源性水肿,出现急性或亚急性神经系统症状和体征,通常来说其临床及影像学改变具有可逆性[1]。MRI技术的发展极大促进了对此病的认识,已证实此病并非完全可逆,且病灶并不局限于大脑后部脑白质,亦不局限于血管源性水肿改变。本文将报告2例PRES患者并对该病临床及影像学特点进行总结,以期加强临床医师对此病的认识并做出更加准确的诊断和治疗。
1 临床资料
病例1:73岁,女性,因“腹泻10余天,四肢乏力2 d,意识障碍1 d”于2017年6月1日转入我院。患者5月30日因四肢乏力就诊外院,查血肌酐为597.8 μmol/L,下午出现急起意识障碍(昏迷),发作时血压不详,次日出现痫性发作,血液透析治疗后神志无改善。既往有癫痫病史50余年,病因不详,近3 y无再发;有血肌酐升高病史半年,最高为315 μmol/L,未治疗。入院查体:血压160/100 mmHg,神志浅昏迷,Glasgow评分E1V1M4=6分,右侧病理征阳性。辅助检查:头部CT平扫示双侧顶、枕叶脑白质对称性低密度灶(见图1)。血肌酐635.7 μmol/L,免疫学检查及余常规血生化检查无异常。脑脊液检查:常规及三大染色正常,脑脊液蛋白1197.9 mg/L↑。血清及脑脊液神经节苷脂抗体谱、中枢神经系统脱髓鞘疾病检测、寡克隆带检查均阴性。脑电图示:顶、枕区慢波频段功率增高。腹部B超示:双肾实质弥漫性病变,双肾测值偏小。6月6日我院头部MRI平扫+DWI+MRA示:双侧顶、枕叶脑白质区大片对称性长T1长T2信号病灶,FLAIR明显高信号,部分病灶呈DWI高信号,ADC图低信号,部分病灶呈DWI等信号,ADC图高信号;MRA未见异常(见图2)。患者入院后经严格血压管理(乌拉地尔持续静脉泵入)、血液透析治疗及对症支持治疗后,神志仍无改善,且在入院后第3天因Ⅱ型呼吸衰竭行有创机械通气治疗,在入院后的第12天患者家属要求出院。
病例2:59岁,女性,因“头晕4 d,左侧肢体乏力3 d,意识障碍2 d”于2017年5月30日转入我院。患者5月26日出现头晕昏沉感,伴非喷射性呕吐,次日出现左侧肢体乏力,外院诊断“脑梗死”,经治疗后症状无改善。5月28日患者突起头痛伴血压急骤升高(收缩压270 mmHg,舒张压不详),随后出现意识障碍(嗜睡),遂转至我院。既往有高血压病史2 y,收缩压最高220 mmHg,舒张压不详,未规律治疗。入院查体:血压214/129 mmHg,神志嗜睡,四肢肌力Ⅳ级,双侧共济运动欠协调,左侧为重,双侧病理征阴性。辅助检查:头部+肾上腺CT平扫:双侧大脑白质对称弥漫性低密度灶(见图1);左侧肾上腺皮质增生(后诊断为嗜铬细胞瘤)。入院血生化及脑脊液检查无异常,血清及脑脊液神经节苷脂抗体谱、中枢神经系统脱髓鞘疾病检测、寡克隆带检查均阴性。脑电图示:额、中央区慢波频率增高。6月6日头部MRI平扫+DWI+MRA示:双侧大脑半球白质区、丘脑、基底节区大片对称性稍长T1、长T2信号病灶,FLAIR明显高信号,DWI等信号、ADC图高信号;双侧小脑及左侧延髓病灶呈FLAIR高信号,DWI明显高信号,ADC图部分病灶呈稍低信号,部分病灶呈等信号;MRA未见异常(见图3)。患者入院后予严格降压(左旋氨氯地平、厄贝沙坦、特拉唑嗪口服+硝普钠及乌拉地尔临时静脉泵入)及对症支持治疗,入院后第3天患者出现意识障碍加重(昏睡),且因Ⅱ型呼吸衰竭行有创机械通气治疗,但治疗后患者神志及呼吸功能很快得到改善,间断使用无创呼吸机治疗。6月29日复查头部MRI平扫+DWI+SWI示:小脑及延髓病灶较前缩小,T2WI、FLAIR、DWI信号较前减低,ADC图信号较前增高;双侧大脑半球白质区、丘脑、基底节区病灶同前;双侧侧脑室旁微出血灶(见图3)。此时患者神志清楚,逐步停用无创呼吸机,四肢肌力亦逐渐恢复正常,但仍遗留双侧共济失调,左侧为重,左侧病理征阳性。
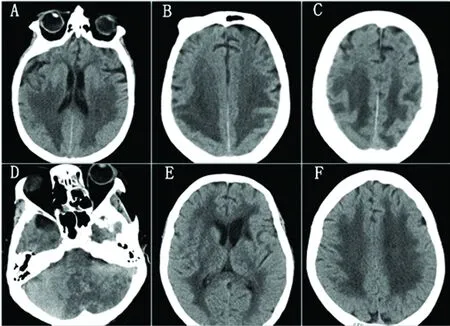
图1 A、B、C为患者1头部CT示双侧顶、枕叶脑白质对称性低密度灶;E、D、F为患者2头部CT示双侧大脑白质对称性弥漫性低密度灶

图2 患者1头部MRI检查:A、D为T2WI序列;B、E、C、F分别为对应层面的DWI序列与ADC图
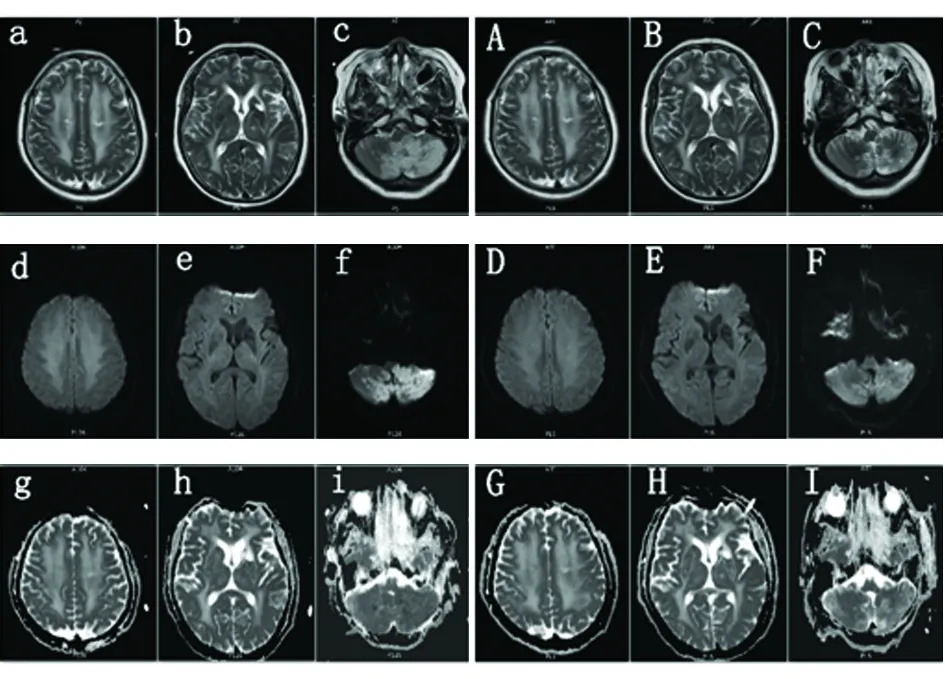
图3 左侧a~i为患者2起病后第10天头部MRI,a、b、c为T2WI序列;d~i分别为对应层面的DWI序列与ADC图;右侧A~I为患者2起病后第35天头部MRI复查
2 讨 论
1996年,Hinchey等[2]通过文献回顾对一组具有相似临床表现及神经影像学特点的患者进行归纳分析后发现其临床和影像改变均具有可逆性,且病灶多位于大脑后部皮质下脑白质,故将其命名为“可逆性后部白质脑病综合征”(reversible posterior leukoencephalopathy syndrome,RPLS)。2000年,Casey等[3]发现高达94%的RPLS患者存在大脑皮质病灶,且血管源性水肿甚至可能起源于皮质,首次提出PRES这一概念并沿用至今。
目前报道了众多与PRES相关的潜在病因,最常见的病因包括急性血压增高、先兆子痫或子痫以及应用免疫抑制及细胞毒性药物(如环孢霉素、他克莫司、α-干扰素、顺铂、丙种免疫球蛋白、促红细胞生成素、白介素、抗HIV药物、粒细胞刺激因子、甲氨喋呤、阿糖胞苷等)。其他相对少见的临床情况包括:(1)肾功能不全:尿毒症、溶血尿毒综合征;(2)结缔组织疾病:系统性红斑狼疮、结节性多动脉炎、白塞病、Wegener’s肉芽肿、Sjogren综合征等;(3)血液系统疾病:镰状细胞贫血、急性卟啉病、大量输血治疗等;(4)代谢内分泌系统疾病:急性卟啉病、嗜铬细胞瘤、原发性醛固酮增多症、甲状腺功能减退症、重度高钙血症、透析平衡失调等;(5)消化系统疾病:克罗恩病、溃疡性结肠炎、原发性硬化性胆管炎等;(6)其他疾病:血栓形成性血小板紫癜、器官移植术、颈动脉内膜剥脱术后再灌注综合征、伴自主神经功能亢进的吉兰-巴雷综合征[4]、视神经脊髓炎[5]等。 急性血压增高作为PRES最常见的原因,尤其多见于存在严重高血压或者血压急骤升高的患者,一般指平均动脉压超过150 mmHg,特别是舒张压升高超过120 mmHg。但有研究显示15%~20%的患者血压可以是正常甚至可能是低血压[6],即使在那些存在高血压的患者,也有半数以上人的平均动脉压没有超过我们认为的脑血管自身调节能力上限(140~150 mmHg)[7,8]。
PRES常见临床症状和体征包括:(1)脑病(50%~80%);(2)痫性发作(60%~75%);(3)头痛(50%);(4)视觉障碍(33%);(5)局灶性神经功能缺损(10%~15%);(6)癫痫持续状态(5%~15%)。其中,脑病程度可从轻微意识混乱到昏迷不等;视觉障碍包括视力下降、视野缺损、皮质盲或幻觉;局灶性神经功能缺损症状包括偏瘫、失语,而脊髓受累症状则少见[1]。
目前PRES的发病机制尚不明确,主要存在两种学说:(1)“脑血管自动调节机制受损学说”:当脑灌注压(平均动脉压-颅内压)在一定范围内波动时,脑血管自动调节机制可使脑血流量维持恒定。当血压急剧升高超过该水平而造成脑组织高灌注时,血脑屏障破坏体液渗出则发生血管源性水肿[1]。交感神经系统在此机制中发挥重要作用,颈内动脉系统交感神经分布丰富,而椎-基底动脉系统则分布稀疏;此外,大脑白质内毛细血管丰富,组织结构较皮质相对疏松,细胞外液易潴留,故大脑后部白质更易受高灌注压的影响发生血管源性水肿[9]。(2)“血管内皮损伤学说”:即细胞毒性药物、细胞毒素、代谢产物、多种细胞因子(如TNF-α、IL-1、INF-γ、VEGF等)可直接损伤血管内皮导致血管通透性增高、血脑屏障破坏引起血管源性水肿[10,11]。
典型PRES病灶在CT平扫上呈低密度改变,急诊首选CT平扫检查。此外,约20%的患者会出现病灶区强化,但CT增强信号的出现与患者的临床症状程度及预后并无相关性[12,13]。但首诊CT阴性的情况可达22%,且不能将非典型病灶与其他疾病相鉴别,即使CT发现了部分病灶,随后的MRI检查也会证实存在比CT上更加广泛的病灶。MRI对发现PRES病灶更加敏感,一些特殊检查序列对疾病诊断及病情变化评估具有重要意义[14]。MRI显示PRES病灶呈长T1长T2信号,FLAIR明显高信号,通常呈双侧非对称性分布。近年随着MRI技术的发展,众多研究证实PRES的病灶并不局限于大脑后部脑白质,亦不局限于血管源性水肿改变。额颞叶、基底节区、丘脑、脑干及小脑均可受累,灰质受累亦不少见,并可存在细胞毒性水肿、强化病灶[12,13]、颅内出血[15]。FLAIR序列是发现皮质及皮质下水肿病灶的敏感手段[3],根据FLAIR序列下病灶分布特点,目前有两种分类方法描述PRES病灶分布模式:(1)“三分法”[14]:顶、枕叶为主型;半球分水岭型;额上沟型。该研究特别指出,此分类方法的提出仅用于帮助临床诊断,病灶分布模式与脑水肿严重程度、临床症状类型及严重程度均无相关性。(2)“五分法”[8]:后部为主型;前部为主型;弥漫分布型;基底节区型;脑干/小脑为主型。
在FLAIR序列的基础上结合DWI(弥散加权成像)和ADC(表观扩散系数)图能有效发现病灶并区分血管源性水肿与细胞毒性水肿病灶。缺血性卒中急性期病灶呈DWI高信号、ADC图低信号,呈细胞毒性水肿信号改变;典型PRES病灶呈DWI等或低信号、ADC图高信号,呈血管源性水肿信号改变。在部分患者的PRES病灶中DWI可呈稍高信号,但强度远不及缺血性卒中急性期病灶,这是由弥散加权效应和T2滤过效应造成,而ADC图可以除去T2滤过效应,因此可以避免低估病灶范围[16]。对于PRES不典型病灶,有时会出现血管源性水肿与弥散受限病灶共存的影像学改变(15%~30%患者),通常表现为在较大的血管源性水肿病灶内出现小面积弥散受限,极少数情况下会出现大面积弥散受限,此时不易与缺血性卒中急性期病灶鉴别[8,13,17]。患者2在起病时存在头晕、恶心、呕吐等椎基底动脉系统脑梗死常见临床表现,且存在与病灶相符的神经功能缺损定位体征(双侧共济失调、呼吸功能衰竭),进一步增加了两者的鉴别难度。弥散受限通常意味着不可逆性结构损伤,临床及影像学均不能完全恢复[18]。
此外,约10%~25%的患者会伴发颅内出血(可表现为微出血、脑实质出血或蛛网膜下腔出血),这可能与抗凝药物的使用及凝血功能异常有关[15]。因此,及早进行磁敏感加权成像(SWI)评估显得十分重要,特别是当血管源性水肿病灶合并弥散受限病灶不易与脑梗死鉴别时,SWI的结果有助于抗栓治疗方案的制定。Fugate等[13]发现不同病因情况下的病灶分布亦各有特点,合并痫性发作者颞叶病灶多见,存在自身免疫性疾病者小脑病灶更为常见。
目前对PRES尚缺乏统一的诊断标准,结合临床病史(如急剧血压升高、尿毒症、应用细胞毒性药物等),当患者存在急性或亚急性神经功能障碍,神经影像学检查发现特点符合的病灶,排除其他疾病之后,需要考虑诊断PRES。Fugate等[13]在2010年提出了一个供参考的诊断标准:(1)急性神经功能障碍的症状或体征;(2)神经影像学检查发现(局灶性)血管源性水肿病灶;(3)可逆性临床症状和/或影像学改变。由于PRES的临床表现及潜在临床病因均无特异性,因此病灶的神经影像学分布模式及改变特点是将本病与其他疾病相鉴别的关键点。
目前尚无针对PRES的特异性治疗手段,通常来说,在疾病早期积极处理病因,临床及影像学改变是可逆的,多数患者在1 w内恢复,少数需要数周才能完全恢复。原发疾病、病灶分布、诊断和治疗时机与临床预后密切相关[19]。但并非所有患者,且并非患者的所有神经功能障碍都可逆,约10%~20%的患者可出现不可逆性损害,如遗留癫痫、视觉障碍等,甚至出现脑出血、梗阻性脑积水、脑干压迫危及生命[1]。此外,约有5%~10%的患者,特别是高血压未得到控制的患者,会出现反复发作[20]。对于考虑高血压脑病的患者,迅速控制血压对疾病预后尤为重要,2013年欧洲心脏病学会(ESC)与欧洲高血压学会(ESH)高血压管理指南建议在初始治疗的前数小时内将血压降低25%[21]。需要警惕的是,由于血压波动过大可能诱发或加重PRES,因此平稳降压十分重要。痫性发作在PRES中常见,因此及时有效的抗癫痫治疗对临床预后至关重要,急性期抗癫痫治疗是有必要的,但目前并不推荐长疗程使用抗癫痫药物[8]。对于考虑免疫抑制剂及细胞毒性药物诱发的,多数研究建议应早期及时减量或停药[22]。
从1996年第一次提出“可逆性后部白质脑病综合征”这一概念到现在已经过去了20 y的时间,但目前对本病发病机制及治疗措施的理解仍很片面,血压因素在病程中的作用、脑组织灌注改变与血管源性水肿发生之间的关联、脑血管收缩是否存在意义等问题是目前争议的焦点。临床医师应该及时更新对此病的认识,特别是要能准确识别存在非典型影像学改变的PRES患者,对其做出及时有效的诊断、治疗。
[1]Fugate JE,Rabinstein AA.Posterior reversible encephalopathy syndrome: clinical and radiological manifestations,pathophysiology,and outstanding questions[J].Lancet Neurol,2015,14(9):914-925.
[2]Hinchey J,Chaves C,Appignani B,et al.A reversible posterior leukoencephalopathy syndrome[J].N Engl J Med,1996,334(8):494-500.
[3]Casey SO,Sampaio RC,Michel E,et al.Posterior reversible encephalopathy syndrome:utility of fluid-attenuated inversion recovery MR imaging in the detection of cortical and subcortical lesions[J].AJNR Am J Neuroradiol,2000,21(7):1199-1206.
[4]Chen A,Kim J,Henderson G,et al.Posterior reversible encephalopathy syndrome in Guillain-Barre syndrome[J].J Clin Neurosci,2015,22(5):914-916.
[5]Magana SM,Matiello M,Pittock SJ,et al.Posterior reversible encephalopathy syndrome in neuromyelitis optica spectrum disorders[J].Neurology,2009,72(8):712-717.
[6]Rabinstein AA,Mandrekar J,Merrell R,et al.Blood pressure fluctuations in posterior reversible encephalopathy syndrome[J].J Stroke Cerebrovasc Dis,2012,21(4):254-258.
[7]Mueller-Mang C,Mang T,Pirker A,et al.Posterior reversible encephalopathy syndrome:do predisposing risk factors make a difference in MRI appearance[J].Neuroradiology,2009,51(6):373-383.
[8]Li Y,Gor D,Walicki D,et al.Spectrum and potential pathogenesis of reversible posterior leukoencephalopathy syndrome[J].J Stroke Cerebrovasc Dis,2012,21(8):873-882.
[9]Edvinsson L,Owman C,Sjoberg NO.Autonomic nerves,mast cells,and amine receptors in human brain vessels.A histochemical and pharmacological study[J].Brain Res,1976,115(3):377-393.
[10]Marra A,Vargas M,Striano P,et al.Posterior reversible encephalopathy syndrome:the endothelial hypotheses[J].Med Hypotheses,2014,82(5):619-622.
[11]Postma IR,Slager S,Kremer HP,et al.Long-term consequences of the posterior reversible encephalopathy syndrome in eclampsia and preeclampsia:a review of the obstetric and nonobstetric literature[J].Obstet Gynecol Sur,2014,69(5):287-300.
[12]Kastrup O,Schlamann M,Moenninghoff C,et al.Posterior reversible encephalopathy syndrome:the spectrum of MR imaging patterns[J].Clin Neuroradiol,2015,25(2):161-171.
[13]Fugate JE,Claassen DO,Cloft HJ,et al.Posterior reversible encephalopathy syndrome:associated clinical and radiologic findings[J].Mayo Clin Proc,2010,85(5):427-432.
[14]Bartynski WS,Boardman JF.Distinct imaging patterns and lesion distribution in posterior reversible encephalopathy syndrome[J].AJNR Am J Neuroradiol,2007,28(7):1320-1327.
[15]Hefzy HM,Bartynski WS,Boardman JF,et al.Hemorrhage in posterior reversible encephalopathy syndrome: imaging and clinical features[J].AJNR Am J Neuroradiol,2009,30(7):1371-1379.
[16]Covarrubias DJ,Luetmer PH,Campeau NG.Posterior reversible encephalopathy syndrome:prognostic utility of quantitative diffusion-weighted MR images[J].AJNR Am J Neuroradiol,2002,23(6):1038-1048.
[17]Liman TG,Bohner G,Heuschmann PU,et al.The clinical and radiological spectrum of posterior reversible encephalopathy syndrome:the retrospective Berlin PRES study[J].J Neurol,2012,259(1):155-164.
[18]Moon SN,Jeon SJ,Choi SS,et al.Can clinical and MRI findings predict the prognosis of variant and classical type of posterior reversible encephalopathy syndrome (PRES)[J].Acta Radiol,2013,54(10):1182-1190.
[19]Pande AR,Ando K,Ishikura R,et al.Clinicoradiological factors influencing the reversibility of posterior reversible encephalopathy syndrome:a multicenter study[J].Radiat Med,2006,24(10):659-668.
[20]Li R,Mitchell P,Dowling R,et al.Is hypertension predictive of clinical recurrence in posterior reversible encephalopathy syndrome[J].J Clin Neurosci,2013,20(2):248-252.
[21]Mancia G,Fagard R,Narkiewicz K,et al.2013 ESH/ESC guidelines for the management of arterial hypertension:the Task Force for the Management of Arterial Hypertension of the European Society of Hypertension (ESH) and of the European Society of Cardiology (ESC)[J].Eur Heart J,2013,34(28):2159-2219.
[22]Tlemsani C,Mir O,Boudou-Rouquette P,et al.Posterior reversible encephalopathy syndrome induced by anti-VEGF agents[J].Target Oncol,2011,6(4):253-258.
