磁共振扩散峰度成像在前列腺癌诊断中的临床应用价值
2018-03-07空军总医院放射科北京100142
空军总医院放射科(北京 100142)
张丹卉 时惠平 马晓璇
前列腺癌在男性恶性肿瘤中位于第二位,也是引起男性死亡的恶性肿瘤之一,其致死率达1~2%[1-2]。近年来,随着PSA筛查的普及、中国经济的迅速发展和饮食、生活习惯的西方化,肿瘤的发病谱也逐渐发生改变,国人前列腺癌的发病率不断升高[3]。前列腺MRI是前列腺常用的影像学检查手段之一,它能够从前列腺癌的定位、定性及临床分期等多方面进行评估,其中弥散加权成像(diffusion weighted imaging,DWI)是前列腺MRI中重要的功能成像方法之一,在前列腺癌的诊断中表现出较高的敏感性和特异性[4-5]。但传统扩散成像技术是基于高斯扩散模型,而人体组织结构是复杂的,水分子扩散信号受诸多因素影响,尤其是高b值下水分子扩散并不完全遵循高斯分布,扩散峰度成像(diffusion kurtosis imaging,DKI)是一种用来评价水分子非高斯分布特征的新的影像学方法,它可以量化分析真实与理想状态下水分子的扩散分布位移偏离程度,反映水分子扩散的受限程度和不均质性,从而反映组织微观结构的变化[6]。本文旨在利用DKI技术对前列腺癌与不同成分的前列腺增生、良性外周带组织进行鉴别,从而提高前列腺疾病诊断的准确率。
1 材料与方法
1.1 临床资料回顾性分析2015年5月~2017年1月于空军总医院行常规前列腺磁共振检查及扩散峰度成像患者48例,所有患者均经手术病理或TRUS穿刺病理证实。纳入标准:①能配合MRI检查,图像清晰;②在MRI检查后两个月内进行手术或TRUS穿刺活检;③前列腺癌患者在MRI图像上可以观察到有显著肿瘤病灶,且为病理证实相应区域。排除标准:①MRI检查前进行过活检或相关治疗、手术者;②临床资料不齐全;③图像质量欠佳,影响分析者。
最终入组39例,前列腺癌16例(18个病灶,外周带癌灶16个,移行区癌灶2个);前列腺增生23例(42个病灶,基质增生灶 28个,非基质增生灶14个);外周带良性组织35例(目标区域37个)。
记录入组患者的年龄、前列腺体积、PSA值、手术或穿刺时间及Gleason评分,相关临床资料见表1。本研究经我院伦理委员会审批同意。
1.2 设备和参数所有受试者均使用美国GE Discovery MR 750 3.0T超导全身磁共振扫描仪,以体线圈为射频发射线圈,8通道体部相控阵线圈(3.0T HD8-CH TORSO ARRAY)为接收线圈,扫描中心置于耻骨联合处,行前列腺整体成像。扫描前嘱受试者适度充盈膀胱,取仰卧位,平静呼吸,扫描时双外耳道内置入耳塞以减少不适。
成像序列包括轴位T1WI、三方位T2WI、轴位T2WI-FS、DWI及DKI序列。扫描参数如下:T1WI(TE 7ms,TR 726ms,矩阵320×224,FOV 46×46cm,层厚/层间距4mm/0.4mm);T2WI(TE 99ms,TR 5338ms,矩阵288×224,FOV 22cm×22cm,层厚/层间距4mm/0.4mm);T2WIFS(TE 102ms,TR 6058ms,矩阵 288×192,FOV 22cm×22cm,层厚/层间距4mm/0.4mm);DWI(TE 54ms,TR 3600ms,矩阵160×160,FOV 30cm×30cm,层厚/层间距3mm/1mm,激励次数4,b=0,1000s/mm2);SE-EPI DKI(TE min ms,TR 4500ms,矩阵128×128,FOV 30cm×30cm,层厚/层间距3mm/0mm,激励次数2,b=0,1000s/mm2,2000s/mm2,每个非0b值施加15个互相垂直方向的扩散敏感梯度场。总采集时间约为15min。
1.3 图像分析和数据采集扫描完成后,将DKI及DWI原始数据传入GE AW4.5工作站,经Functool软件后处理生成DKI各参数(FA、MD、Da、Dr、MK、Ka、Kr)图及ADC图,病灶区由作者及一名具有10年以上诊断经验的医师根据病理结果共同确定。
前列腺癌的感兴趣区(region of interest,ROI)结合T2WI和DWI图像(T2WI表现为边界不清低信号,DWI呈高信号),以病理阳性区为准,在病灶显示最大层面勾勒出来。测得ROI的大小为(39.6±7.4)cm2(图1)。
前列腺增生的ROI选取根据增生结节在T2WI表现,选取边界清楚,具有包膜的增生结节,根据信号高低分为基质增生结节(低信号)和非基质增生结节(高信号)。基质增生结节的ROI大小为(42±8.6)cm2,非基质增生结节的ROI大小为(38±7.3)cm2(图2)。
前列腺良性外周带的ROI选取标准为T2WI信号呈均匀一致的高信号,在外周带所占比例最大的层面放置ROI,大小为(43.5±9.2)cm2。
ROI的选取以覆盖目标区域2/3为标准,且尽量避开钙化、坏死、尿道及血管区域。以上所有ROI均测量三次,最后取三次测量平均值作最终的数据统计。
1.4 统计学方法采用SPSS 20.0软件对数据进行统计学分析。计量资料先进行正态分布检验,符合正态分布采用(±s)表示,不符合则采用中位数和四分位数间距表示。采用单因素方差分析(one-way ANOVA)及Tukey HSD法比较前列腺癌、前列腺增生(基质、非基质)、良性外周带的DKI参数(MK、Ka、Kr、FA、MD、Da、Dr)与ADC值的的差异;采用受试者工作特征曲线(receiver operating characteristic,ROC)分析各参数在诊断前列腺癌与良性外周带间的特异度和敏感度。P<0.05认为差异具有统计学意义,P<0.001认为差异具有显著统计学意义。
2 结 果
2.1 DKI各参数与ADC值在前列腺癌、前列腺增生、良性外周带值的比较前列腺癌、前列腺增生(基质增生、非基质增生)、良性外周带的MK、Ka、Kr、FA、MD、Da、Dr值及ADC值组内比较均有显著统计学差异(F=33.477,P=0.000<0.001;F=27.461,P=0.000<0.001;F=24.348,P=0.000<0.001,F=13.949,P=0.000<0.001;F=25.403,P=0.000<0.001;F=32.522,P=0.000<0.001;F=25.062,P=0.000<0.001;F=18.843,P=0.000<0.001),DKI各参数及ADC值在各组的平均值,前列腺癌分别与前列腺增生(基质、非基质)、良性外周带两两比较资料见表2,见图3-13。
2.2 DKI各参数与ADC值在前列腺癌与良性外周带诊断效能比较DKI各参数与ADC值在前列腺癌与良性外周带ROC分析具体结果见表3。

表1 16例前列腺癌患者一般资料
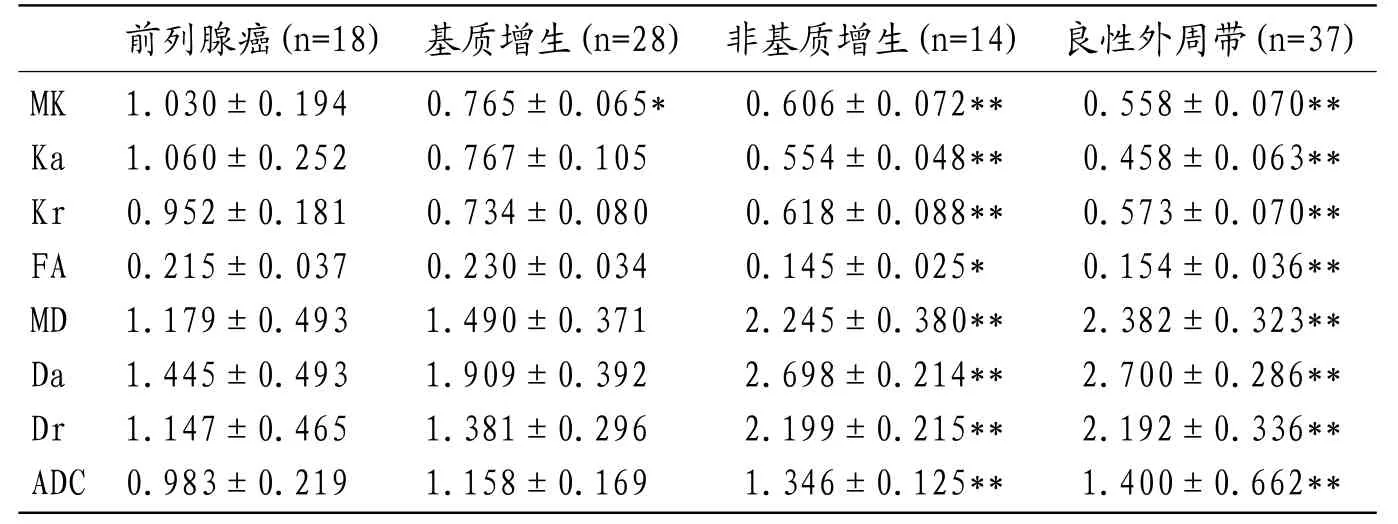
表2 前列腺癌、前列腺增生、良性外周带的DKI各参数值及ADC值

表3 DKI各参数值及ADC值在前列腺癌与良性外周带间诊断效能
3 讨 论
DKI是一种用来评价水分子非高斯分布特征的新方法,由Jensen等人于2005年首次提出[7],它不同于传统的扩散张量成像(diffusion tensor imaging,DTI)技术对二阶三维张量的认识,而是将水分子呈非高斯分布扩散,四阶三维峰态张量应用于MRI的过程。DKI作为DTI技术的拓展,能够量化分析水分子非高斯分布扩散特性[8-10]。
目前,DKI已相继应用于中枢神经系统等各个系统疾病的诊断、临床研究等,在缺血性脑梗塞[11]、多发性硬化[12]、胶质瘤分级[13]等方面均显示出巨大优势,在观察微观组织结构变化方面较常规弥散技术显示出了更高的敏感性和特异性,在前列腺相关疾病的研究方面也初具规模,Michael Quentin等人[14]对14例前列腺癌患者和10例健康志愿者行DKI扫描,得出前列腺癌区的MK、Ka值明显高于正常外周带和中央带,DKI各参数和Gleason评分有弱相关性(Ka r=0.19,MK r=0.14,Kr r=0.15,FA r=-0.01)。Suo等人[15]的实验共纳入19例前列腺癌患者并对其进行多b值DWI扫描,采用扩散峰度模型和单指数模型分别得到D值、K值及ADC 值,统计分析得出前列腺癌的D值、ADC值均低于良性组织区(P<0.001),K值高于良性组织区(P<0.001)。以上研究均证明了DKI在前列腺癌和正常前列腺组织鉴别诊断方面有一定价值。
本研究不仅将前列腺癌与正常前列腺组织纳入实验,还同时纳入了良性前列腺增生组织,并对前列腺增生进一步分为基质增生和非基质增生分别进行探究。结果显示出DKI各参数值在前列腺癌与良性前列腺组织的鉴别诊断中具有意义,MK在前列腺癌与基质前列腺增生中有一定价值,前列腺癌与非基质前列腺增生的鉴别中,除FA值外,余各值均显示出显著统计学差异。以上结果也与Rosenkrantz等人[16]的报道相一致,但其采用超声引导下经直肠穿刺活检病理,而本研究采用手术病理切片与DKI参数图进行对照研究。从前列腺癌与良性前列腺外周带的ROC分析结果来看,MD、Da、Dr值在各参数值中敏感度最高,达100%,因为DWI技术的优势之一就是在监测前列腺癌中有较高的敏感性[17-20],另一方面可能受本实验样本量影响。在特异度方面评估,MK、Ka、Kr具有较高的特异度,达100%,而敏感度不如MD相关参数,结合著参数有望达到良好的诊断效果。
本研究的局限性在于:①样本数量较少,可能对实验结果产生一定的影响;②研究采取手术病理与TRUS穿刺活检病理两种手段与DKI图像进行对照,某些情况下,两种方式所得病理结果可能有一定误差;③前列腺增生结节的分类是依据于T2WI信号高低而区别,仅利用肉眼观察信号强度可能有所偏倚。
综上所述,DKI作为一种新的MRI功能成像技术,能够从微观组织水平对前列腺癌进行分析,在前列腺癌的鉴别诊断中显示出了较高的灵敏度和特异度,在前列腺癌的定位、范围划定方面也显示出了一定的临床应用价值。DKI技术有望成为评估前列腺癌更有效的手段。
[1]Jemal A,Center M M,Desantis C,et al.Global Patterns of Cancer Incidence and Mortality Rates and Trends[J].CANCER EPIDEM BIOMAR,2010,19(8):1893-1907.
[2]Attard G,Parker C,Eeles R A,et al.Prostate cancer[J].Lancet,2015,387(10013):49-52.
[3]Zhu Y,Wang H K,Qu Y Y,et al.Prostate cancer in East Asia:evolving trend over the last decade[J].ASIAN J ANDROL,2015,17(1):48-57.
[4]章绪辉,全显跃,路世龙,等.DWI和ADC图在前列腺癌诊断中的应用研究[J].中国CT和MRI杂志,2014,12(8):66-68.
[5]张刚,林骅.MR扩散加权成像诊断前列腺癌的临床研究[J].中国CT和MRI杂志,2016,14(10):99-101.
[6]Wu E X,Cheung M M.MR diffusion kurtosis imaging for neural tissue characterization[J].NMR BIOMED,2010,23(7):836-848.
[7]Jensen J H,Helpern J A,Ramani A,et al.Diffusional kurtosis imaging: the quantification of non-gaussian water diffusion by means of magnetic resonance imaging[J].MAGNET RESON MED,2005,53(6):1432-1440.
[8]Akin O,Sala E,Moskowitz C S,et al.Transition zone prostate cancers: features, detection,localization,and staging at endorectal MR imaging[J].Radiology,2006,239(3):784-792.
[9]Lu H,Jensen J H,Ramani A,et al.Three-dimensional characterization of nongaussian water diffusion in humans using diffusion kurtosis imaging[J].NMR BIOMED,2006,19(2):236-247.
[10]Jensen J H, Helpern J A. MRI quantification of non-Gaussian water diffusion by kurtosis analysis[J].NMR BIOMED,2010,23(7):698-710.
[11]Jensen J H,Falangola M F, Hu C,et al.Preliminary observations of increased diffusional kurtosis in human brain following recent cerebral infarction[J].NMR BIOMED,2011,24(5):452-457.
[12]Steven A J,Zhuo J,Melhem E R.Diffusion kurtosis imaging:an emerging technique for evaluating the microstructural environment of the brain[J].AJ R,2014,202(1):26-33.
[13]Jiang R,Jiang J,Zhao L,et al.Diffusion kurtosis imaging can efficiently assess the glioma grade and cellular proliferation[J].Oncotarget,2015,6(39):42380-42393.
[14]Quentin M,Pentang G,Schimmoller L,et al.Feasibility of diffusional kurtosis tensor imaging in prostate MRI for the assessment of prostate cancer:Preliminary results[J].MAGN RESON IMAGING,2014,32(7):880-885.
[15]Suo S,Chen X,Wu L,et al.Non-Gaussian water diffusion kurtosis imaging of prostate cancer[J].MAGN RESON IMAGING,2014,32(5):421-427.
[16]Rosenkrantz A B,Sigmund E E,Johnson G,et al.Prostate cancer: feasibility and preliminary experience of a diffusional kurtosis model for detection and assessment of aggressiveness of peripheral zone cancer[J].Radiology,2012,264(1):126-135.
[17]Verma S,Rajesh A,Morales H,et al.Assessment of aggressiveness of prostate cancer:correlation of apparent diffusion coefficient with histologic grade after radical prostatectomy[J].AJR,2011,196(2):612-615.
[18]Wu L M,Xu J R,Ye Y Q,et al.The clinical value of diffusionweighted imaging in combination with T2-weighted imaging in diagnosing prostate carcinoma:a systematic review and meta-analysis[J].AJR,2012,199(1):103-110.
[19]Reinsberg SA,Payne GS,Riches SF,et al.Combined use of diffusion-weighted MRI and 1H MR spectroscopy to increase accuracy in prostate cancer detection[J].AJR,2012,188(1):91-98.
[20]Tan C H,Wei W,Johnson V,et al.Diffusion-weighted MRI in the detection of prostate cancer:meta-analysis[J].AJR,2012,199(4):822-829.
