毛细胞型星形细胞瘤MR诊断与病理分析
2018-03-07解放军第149医院放射科江苏连云港222042
1.解放军第149医院放射科(江苏 连云港 222042)
2.江苏省连云港海滨康复医院放射科 (江苏 连云港 222042)
张永娣1 邵世香1 孙献勇2
毛细胞型星形细胞瘤(pilocytic astrocytoma,PA)是一种少见的中枢神经系统肿瘤,约占原发性中枢神经系统肿瘤的1.5%,手术切除效果良好,2007年WHO分类中列为Ⅰ级星形细胞瘤[1]。本文回顾性分析经手术病理证实的17例PA,探讨其MR表现与病理特点。
1 资料与方法
1.1 研究对象2011年8月~2016年8月解放军第149医院经手术病理证实的17例PA患者,其中男4例,女13例,男:女为0.31∶1;年龄3~27岁,平均(17±2.5)岁。临床主要表现为头痛、头晕、恶性、呕吐,6例有不同程度的共济失调,2例有癫痫发作病史。发病时间1周~数年不等。
1.2 仪器与方法使用德国西门子3.0T Magnetom Trio Tim超导型成像仪。FSE序列轴位、矢状位、冠状位T1WI(TR/TE=250ms/25ms)、T2WI(TR/TE=4000~6000ms/80~120ms),T2-FLAIR(TR/TE=8000ms/97ms)。17例患者同时行增强扫描,造影剂使用Gd-DTPA,剂量为0.1~0.2mmol/kg,经肘静脉注射后,行FSE序列轴位、矢状位、冠状位T1WI(TR/TE=250ms/25ms)扫描。所有患者均行手术切除,切除标本观察大体表现及镜下所见,并经免疫组化检查,将其影像学表现与病理所见进行对比分析。
2 结 果
2.1 病变部位17例患者中,病变位于幕上5例,占29%,分别为丘脑(累及部分中脑)1例,颞叶1例,枕叶例;病变位于幕下小脑12例,占71%,其中小脑蚓部10例,小脑半球2例。
2.2 MR表现 本组17例患者中,囊结节型11例,实质型4例,囊肿型2例。(1)囊结节型:T1WI囊性部分低信号,结节部分稍低信号(图1);T2WI囊性部分高信号,结节部分稍高信号(图2)。T2-FLAIR囊性部分低信号、等信号或高信号,较小结节为一致高信号,结节较大时为混杂高信号。增强扫描结节部分明显强化,结节越小强化越显著(图3);较大结节强化欠均匀,强化幅度相对较弱(图4)。囊液部分及囊壁无强化。瘤周无或轻微水肿。(2)实质型:本组4例实质型PA均位于小脑蚓部,其内均有不同程度的囊变,信号混杂,增强扫描见不均匀强化(图5-6)。(3)囊肿型:左侧小脑半球及小脑蚓部各1例,左侧小脑半球病例显示为囊状长T1、长T2信号,增强扫描囊壁呈线环状强化。位于小脑蚓部病例囊腔内信号表现为等T1、长T2信号,T2-FLAIR高信号,囊底部可见水平分层现象,囊壁在各序列均为环状低信号,瘤周水肿;增强扫描囊内、囊壁均无强化。术后证实该瘤囊内有明显出血,本例同时合并小脑扁桃体下疝,呈继发性ChiariⅠ型畸形(图7-9)。
2.3 病理所见大体上肿瘤呈灰白或暗红色,质软或韧,肿瘤无包膜或有假包膜,囊腔内多为淡黄色液体,1例小脑蚓部囊肿型PA,囊液为暗红色血性液体,囊壁及临近组织内观察到含铁血黄素颗粒。镜下肿瘤组织呈双相结构,由致密区梭形细胞和疏松区多极细胞组成。梭形细胞细长,一端呈发丝状,呈致密束状排列,常伴Rosenthal纤维;疏松微囊区的细胞常为原浆型星形细胞,胞突相对较短,常伴嗜酸性颗粒小体。瘤组织中血管丰富,囊壁上常可见新生的血管呈屏障样排列。免疫组织化学标记:胶原纤维酸性蛋白GFAP全部显示阳性,见图10。
3 讨 论
3.1 临床病理学特征PA是Penfield于1937年根据肿瘤细胞两端突起为细长的毛发样胶质纤维而命名,因此根据Rosenthal纤维标准,只要镜下见到毛样星形细胞与疏松的成熟胶质纤维混杂排列,即可诊断为PA。但是,Rosenthal纤维的形成仅是该瘤的一个突出特点,而并非诊断所必需的依据[2]。瘤组织中血管丰富,有酷似毛细血管瘤或海绵状血管瘤样区域。瘤囊内绝大部分为黄色清亮液体,亦可为新鲜或陈旧的血性液体[3]。该瘤是一种生长缓慢、预后良好的星形细胞瘤,最常见于20岁以下儿童和青少年,男女发病比例均等[4]。本组17患者中,男4例,女13例,男:女为0.31:1,女性明显多于男性,与文献报道不尽相同,但因本组病例数较少,是否有意义尚有待大宗病例分析阐释。PA可发生于中枢神经系统任何部位,但以发生在小脑和中线结构多见[3],本组结果与之相符。
3.2 MR表现(1)囊结节型:最为常见,也较有特征性。本组共11例,占本组病例的65%。MR表现为边界清晰的病灶,囊液为长T1、长T2信号,因囊液内蛋白含量差异,T2-FLAIR序列可为低、等或高信号。壁结节大小不等,结节较小时T1WI为均匀稍低信号,T2WI为稍高信号,较囊液高信号低,所以结节有时可被囊液信号掩盖,在T2-FLAIR序列呈较高信号。增强扫描壁结节呈显著均匀强化,囊壁不强化。壁结节较大时,形态不规则,信号不均匀,可见条状分隔,T2-FLAIR序列及增强扫描显示壁结节内可有囊性变,增强扫描结节实性部分强化可不均匀,强化幅度往往不及小壁结节高。部分肿瘤周围囊壁有胶质增生或有肿瘤组织时可发生线环状强化。瘤周一般无水肿或轻微水肿。(2)实质型:本组4例均位于小脑蚓部,其内因有不规则的囊性变而使其信号不均,囊性部分为长T1、长T2信号,实性部分平扫时T1WI及T2WI约为等信号,T2-FLAIR序列为高信号。增强后实性部分呈不均匀明显强化。一般而言,脑肿瘤的强化程度与肿瘤的恶性程度呈正相关[5]。这与肿瘤的恶性程度越高,肿瘤血管发育越不成熟和血脑屏障破坏严重有关,是肿瘤的恶性生物学行为引起的。而毛细胞型星形细胞瘤的明显强化,不代表肿瘤为恶性和血脑屏障破坏,而与肿瘤血管的自身特点-有孔型毛细血管有关[6]。Takeuchi等[7]报道在注入对比剂后的PA的血管细胞内发现对比剂胞饮小泡,说明对比剂是通过胞饮作用通过肿瘤的血管内皮细胞。因此证明PA的强化特点是由于其毛细血管的通透性增高而引起的肿瘤强化,并非是血脑屏障的破坏而引发的。与之相类似的脑部Ⅰ级肿瘤中,实质型的血管母细胞瘤MR增强也存在明显强化的特征,所以,脑肿瘤的强化程度与肿瘤的恶性程度二者之间的关系尚需具体疾病具体分析。(3)囊肿型:本组2例。增强后囊壁可强化,也可不强化,与囊壁的组织来源有关。囊壁由反应性增生的胶质或受压的脑组织构成,则囊壁不强化;囊壁由含活性的肿瘤细胞及增生的新生血管构成,则囊壁强化[8]。本组2例囊肿型病例中,左侧小脑半球内1例病灶囊壁呈欠光滑线环状明显强化。另1例小脑蚓部病例因瘤囊内出血,表现较为特殊,平扫病灶呈等T1、长T2信号,T2-FLAIR呈明显高信号,囊底部为血液有形细胞成分,所以呈现水平分层现象,囊壁各序列环状低信号为含铁血黄素沉积所致。有学者认为,PA的瘤内出血,可能与肿瘤内的血管壁的纤维结构不良有关[9]。
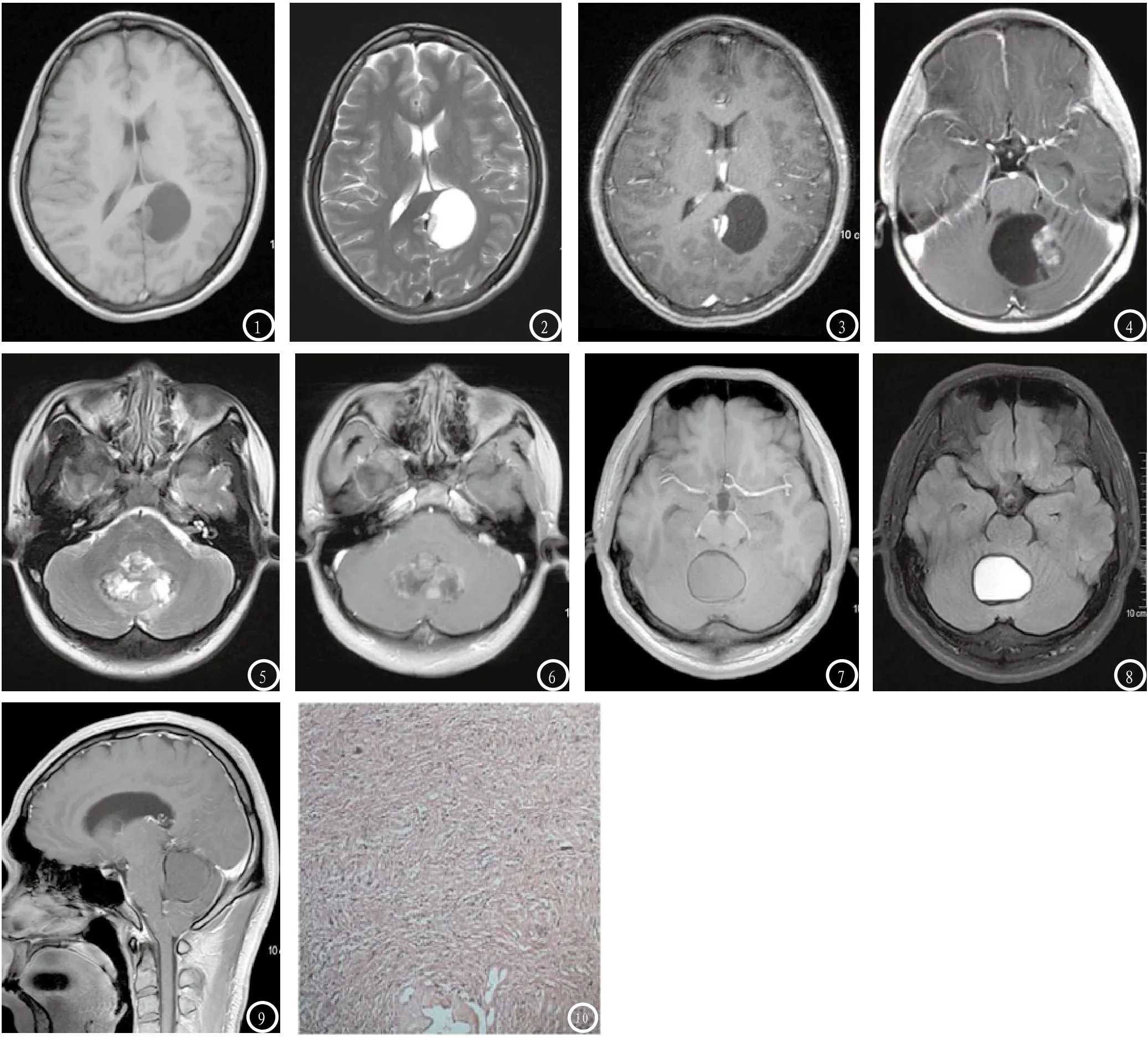
图1-3 左侧枕叶囊结节型PA。MR平扫显示类圆形长T1长T2信号影,囊内壁小结节呈稍长T1稍长T2信号影(图1、2),增强扫描示小结节明显均匀一致强化,囊液及囊壁无强化(图3)。图4 小脑蚓部囊结节型PA。增强扫描示囊内结节不均匀强化,囊液及囊壁无强化。图5-6 小脑蚓部实质型PA。图5 T2WI示肿瘤为等高信号,瘤周轻微水肿。图6 增强扫描示肿瘤不均匀强化。图7-9 小脑蚓部囊肿型PA,囊内伴出血。图7 T1WI示肿瘤呈均匀等信号,底部显示分层现象,囊壁因含铁血黄素沉积呈线环状低信号。图8 T2-FLAIR示囊液呈高信号,囊底部及囊壁呈明显低信号,瘤周无水肿。图9 增强扫描示肿瘤无强化,矢状位显示部分小脑扁桃体疝入枕骨大孔下方。图10 PA病理切片(HE×100)示:肿瘤组织呈双相结构,由致密区梭形细胞和疏松区多极细胞组成。
3.3 鉴别诊断
3.3.1 囊结节型PA与大囊小结节型血管母细胞瘤鉴别:MR表现上二者有一定共性,但血管母细胞瘤的壁结节均位于软脑膜侧,且强化幅度较PA壁结节更为显著,另外,血管母细胞瘤结节内或/和瘤旁可见流空血管影。
3.3.2 实质型PA与髓母细胞瘤及四脑室室管膜瘤鉴别:髓母细胞瘤多发生于儿童小脑蚓部,肿瘤坏死囊变较少,信号较均匀,瘤周水肿明显,增强扫描呈轻~中度强化,不如PA强化明显。第四脑室室管膜瘤形态多不规则,常伴有周围脑组织水肿,肿瘤增强不均匀,边缘不光整,没有PA强化显著,四脑室以上脑室系统积水明显,矢状位更有利于肿瘤定位。
3.3.3 小脑囊肿型PA与单纯囊肿鉴别:单纯囊肿在MR各个序列上均与脑脊液信号相似,增强扫描壁不强化。囊肿型PA在T2-FLAIR序列上为低、等或高信号,增强扫描壁可强化。。
综上所述,PA的MR表现,与其病理特征紧密相关,在MR检查诊断中,除了常规序列外,增强扫描可以反映出肿瘤结节或实性部分的强化特征,结合患者的其他相关临床资料,有利于术前正确诊断。但最终定性尚需结合病理检查。
[1]杨学军.解读世界卫生组织中枢神经系统肿瘤分类(2007年)[J].中国神经精神疾病杂志,2007,33(9):513-517.
[2]赵本胜,余永强,钱银锋,等.毛细胞型星形细胞瘤的CT、MRI表现[J].临床放射学杂志,2007,26(6):539-542.
[3]Koeller KK,Rushing EJ.From the archives of the AFIP:pilocytic astrocytoma:radiologicpathologic correlation[J].Radiographics,2004,24(6):1693-1708.
[4]赵有财,李发云,周晓军.毛细胞型星形细胞瘤的临床和病理学研究进展[J].中华病理学杂志,2007,36(12):846-848.
[5]李春和,姚振威,冯晓源.青少年小脑毛细胞型星形细胞瘤的CT、MR诊断[J].中国医学计算机成像杂志,2005,11(4):219-222.
[6]李文华,朱铭,耿道颖,等.儿童期小脑星形胶质细胞瘤的MRI特征[J].实用放射学杂志,2002,18(6):511-513.
[7]Takeuchi H,Kubota T,Sato K,et a1.Ultrastructure of capillary endothelium in pilocy in pilocytic astrocytomas[J].Brain Tumor Pathol,2004,21(1):23-26.
[8]钟文招,陈武标,刘文慈.颅内毛细胞型星形细胞瘤的CT、MRI诊断[J].实用放射学杂志,2010,26(8):1096-1099.
[9]许守利,马永华,孙建刚,等.毛细胞型星形细胞瘤的CT、MRI表现及病理学基础[J].中国医学影像学杂志,2010,18(2):175-178.
