补充—个Cu催化(脱氢)氧化乙醇的实验
2018-03-06刘怀乐
刘怀乐
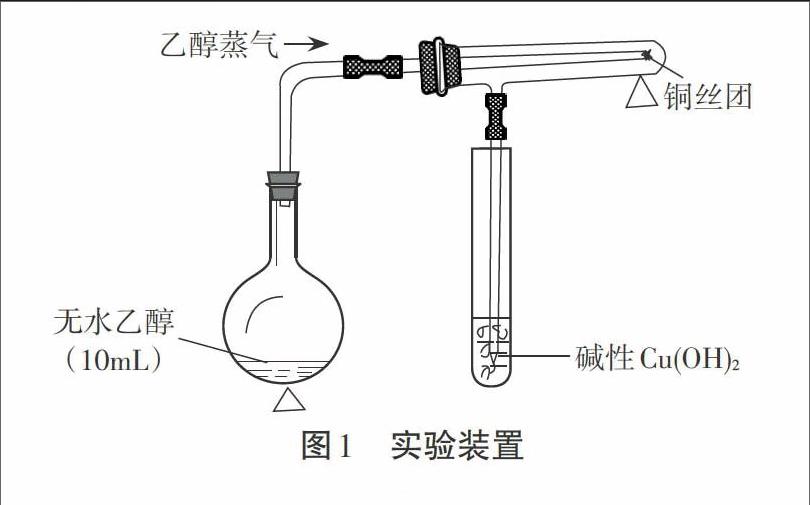
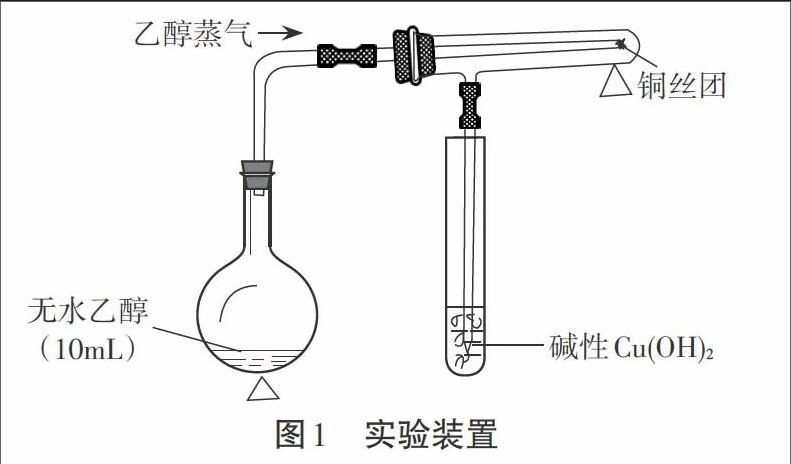
摘要:红热的Cu丝与乙醇的反应,属于氧化剂(CuO)氧化乙醇;乙醇的催化氧化属于乙醇在Cu催化条件的脱氢氧化。本实验是在隔绝(排除)空气的条件下,观察加热的铜丝与乙醇蒸气反应,生成乙醛被碱性Cu(OH)2检验。
关键词:乙醇蒸气;红热Cu丝(CuO);脱氢;隔绝(排除)空气;碱性氢氧化铜;可逆反应
文章编号:1008-0546(2017)11—0094—01 中图分类号:G633.8 文献标识码:B
doi:10.3969/j.issn.1008—0546.2017.11.031
现行高中化学(必修2)74页,陈述了乙醇氧化反应的四点性质:
(1)乙醇在空气中燃烧;
(2)在一定条件下乙醇可以与氧化剂发生反应;
(3)乙醇在铜或银做催化剂的条件下,可以被空气中的氧气氧化成乙醛(CH3CHO);
(4)乙醇还可以与酸性高锰酸钾溶液或………
这里,试想对乙醇的铜催化氧化补充一个实验。
一、关于铜或银等催化氧化乙醇的理性分析
乙醇的催化氧化早有成熟的理论和实践,在教学中必须把握好以下两点:
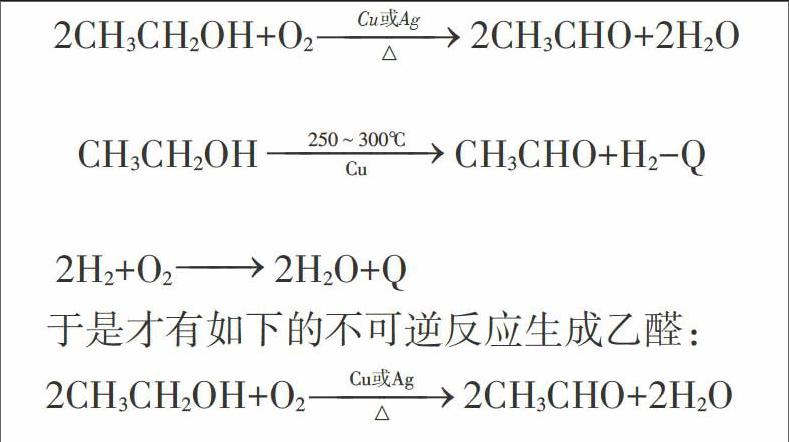
第一,乙醇的铜催化氧化是一个可逆的脱氢氧化过程,反应是吸热的,反应要消耗能量(须加热)。
第二,若将乙醇的蒸气和适量的空气或氧气一起通过催化剂进行氧化脱氢,则氢和氧会结合生成水,反应可以进行到底。这里,氢气的氧化反应是放热的。
于是才有如下的不可逆反应生成乙醛:
可见,教材出示的乙醇在Cu催化氧化生成乙醛的反应,是在一定条件下(Cu或Ag催化,加热)两个反应的加和式。
二、乙醇催化(脱氢)氧化的实验设计
乙醇的催化(Cu)脱氢是外界提供能量(加热)条件下发生的脱氢氧化,反应是在仅有乙醇蒸气和Cu存在的条件下生成乙醛,这是实验设计的关键。
如图所示,在一个配有单孔橡皮塞的小烧瓶(或试管)里注入10mL左右的无水乙醇,不断微微加热(略显沸腾),让不断产生的乙醇蒸气除去(赶尽)反应空间的空气,然后再集中火力加熱具支试管底有Cu丝的部位。当发现酒精的量蒸发减半,红热Cu丝略显变黑(酒精蒸气被红热的Cu丝炭化所致)的时候,把导气管伸进碱性氢氧化铜浊液,就会出现碱性Cu(OH)2浊液的试管内,因生成的热的乙醛蒸气被碱性氢氧化铜氧化生成不溶性的橙红色Cu2O沉淀,从而使乙醇被催化脱氢氧化生成的乙醛得检。
三、演示乙醇催化(脱氢)氧化实验的意义
据笔者所知,教学中不少教师把教材“实验3-3用红热螺旋铜丝(CuO)氧化乙醇”的实验视为乙醇的催化氧化。须知,红热的螺旋铜丝本身就是一种氧化剂(CuO)。况且教材已明确指出:“乙醇可以与氧化剂发生反应”,而实验3-3所提供的实验本身,恰恰提供了一种具体的氧化剂(CuO),或者说实验3-3是教材所说的氧化剂氧化乙醇一种实证方法。可惜不少文献,包括新近的《化学教育》2017年第5期66页有《乙醇催化氧化实验改进》,以及该文所引用的文献[2]→[6]。几乎都把教材实验3-3视为乙醇的催化氧化,这是欠妥甚至是不对的。
其次,乙醇的Cu催化氧化本身是一个脱氢氧化过程,反应具有可逆性,反应过程中需要消耗能量(要给铜丝加热),在本实验设计里得到了体现。但是当有空气或有氧气存在时,脱下来的氢会与氧结合生成水放出大量的热,会把脱氢的吸热过程转变为放热过程。教材所示乙醇催化氧化的反应(方程式),把这两个过程因为合为一体而把脱氢过程掩盖了。
当然,中学化学教学本身没有对乙醇催化脱氢提出要求,本文也无意在中学化学中必须提出这种要求,但是这种掩盖科学本质东西,我们教师必须做到心中有数。
笔者跟一些在职中年教师探讨这个问题时,他们的观点非常明确,在中学化学教学中没有这样的要求,完全没有必要讨论这个问题。笔者认为,我们完全可以这样去打发一个学生向我们提出这样的问题,但是我们无法回避我们在教学研究时可以(应该)讨论这样的问题。我在想,如果我们的学生看到一篇文章,遇到个别不认识的字、词或成语去问语文老师,抑或有什么历史史实去请教历史老师,我们教师能以“这不是中学教材内容所要求”为由,谢绝回答你的学生吗?何况我们所提出的问题是我们化学教师在大学期间应有的知识储备,在教学和教研过程中讨论这样的问题,想必是非常必要的。
退一万步,即令不讨论这样的问题,我们也无论如何不能把乙醇与红热铜丝(CuO)的氧化剂氧化等同于乙醇的催化氧化。不难明白,笔者提供的乙醇催化脱氢氧化实验,是对教材实验3-3的氧化剂氧化乙醇有本质区别提供了一个有力的实验依据,对于结束当前在这个问题上的教学混沌状态,想必是大有裨益的。endprint
