花生衣多酚物质H PLC分析及表儿茶素、儿茶素含量测定
2018-03-06
(玉溪农业职业技术学院,云南玉溪653100)
花生衣化学成分研究较早的有张秀尧等[1]的研究表明花生衣中含有原花色苷和D(+)-儿茶素。Lou Hongxiang等[2]的研究表明花生衣中含有表儿茶素、儿茶素类以及原花青素B2、B3和B4。诸多研究[3-7]表明花生衣中含有多种酚酸类、原花青素类以及黄酮类等多种多酚类成分。中医认为花生衣具有止血、补血的作用,现代营养学认为花生衣具有抗氧化、清除自由基、抑菌、降血压等多种生理功效,这方面研究已报道较多[8-10]。花生衣的抗氧化等活性主要由于所含原花青素类、白藜芦醇以及黄酮类等物质[11-14]。表儿茶素与儿茶素属于原花青素中重要的单体,而槲皮素与芦丁也属于极具有生物活性的黄酮醇。目前儿茶素及表儿茶素含量测定多见于茶叶及一些中药成分分析中[15-18],花生衣中儿茶素、表儿茶素等成分的分析与含量测定仅见个别报道[19],黄酮类及其他酚酸类报道也极少。高效液相色谱法(High Performance Liquid Chromatography,HPLC)多见于分离分析葡萄籽中原花青素类物质[20-21],液相色谱-质谱法(Liquid Chromatography/Mass Spectrometry,HPLC-MS)多用于研究原花青素类单体、低聚体成分[22-23]。本试验采用HPLC法以多种标准品为对照分析了云南玉溪本地白、红两种花生衣中酚酸类物质、原花青素单体中表儿茶素与儿茶素、黄酮类等成分,并测定了两种花生衣中表儿茶素与儿茶素的含量,为花生衣成分的针对性研究奠定基础。
1 材料与方法
1.1 材料与试剂
白、红花生:玉溪本地超市或农贸市场购买;表儿茶素、儿茶素、槲皮素、芦丁、绿原酸:均为分析标准品UV≥95%,上海金穗生物科技有限公司;没食子酸:优级纯,酷尔生物;鞣酸、无水乙醇:优级纯,天津凤船化学试剂科技有限公司;甲醇、乙腈:色谱纯,Tedia company,USA;超纯水:玉溪农业职业技术学院光谱实验室自制。
1.2 仪器设备
LC-10A高效液相色谱仪、shimpack VP-ODS,C-18(15 cm×4.6 mm)色谱柱、UV2550紫外可见分光光度计:岛津仪器(苏州有限公司);JL-180DT超声波清洗器:上海吉理超声仪器有限公司。
1.3 方法
1.3.1 色谱分析条件
1)分析波长选择:通过UV-2550光谱显示,表儿茶素、儿茶素及鞣酸在280 nm处均有最大吸收峰,没食子酸在261 nm处有最大吸收峰,而绿原酸在327 nm处有最大吸收峰,因此实验以280 nm为表儿茶素、儿茶素、绿原酸、鞣酸及没食子酸的分析波长;槲皮素在375 nm处有最大吸收峰,芦丁在360 nm处有最大吸收峰,UV光谱图像显示二者在280 nm波长下吸收值均很小,故槲皮素与芦丁分析波长定为360 nm。
2)流动相:表儿茶素、儿茶素、绿原酸、鞣酸及没食子酸:乙腈-0.5%乙酸(10∶90,体积比);槲皮素与芦丁:甲醇-0.5%乙酸(45∶55,体积比)。
3)流速、柱温与进样量:流速均为1.0 mL/min,柱温均为30℃(夏天当地室温接近30℃),进样量均为 20 μL。
1.3.2 花生衣分析液的制备
称取花生衣粉0.500 0 g于100 mL棕色容量瓶中,按照花生衣多酚提取方法[24]用约80 mL60%的乙醇溶液在55℃下超声波辅助提取20 min,冷却后定容至100 mL,过滤至100 mL棕色容量瓶中(置冰箱中储存可使用一周),滤液经0.45 μm滤膜过滤后备用。
1.3.3 标准品溶液的配制
分别将各标准品20 mg(表儿茶素、儿茶素、槲皮素、芦丁、绿原酸)用无水乙醇配制成0.200 mg/mL的储备液,再稀释至一定浓度,经0.45 μm滤膜过滤后使用。其中表儿茶素与儿茶素配成浓度为0.003、0.005、0.010、0.020、0.030、0.040、0.050 mg/mL的标准系列。鞣酸(乙醇配制)与没食子酸(水配制)各称取0.010 0 g,分别配制成0.100 mg/mL的储备液,再稀释至一定浓度,经0.45 μm滤膜过滤后使用。各标准品储备液均以棕色容量瓶保存在冰箱中。
1.3.4 HPLC分析方法的建立
试验采用不同比例的流动相对样品及标准品反复进行HPLC分离试验。以不同比例的乙腈-0.5%乙酸进行表儿茶素、儿茶素、绿原酸、鞣酸及没食子酸的分离分析,以不同比例的甲醇-0.5%乙酸进行槲皮素与芦丁的分离分析,一方面要求花生衣样品各色谱峰能完全分离,另一方面要求目标物的保留时间不要太长。对样品中目标物及相应对照品保留时间的确定采取两次以上重复进样,若样品目标物峰的周围有其他干扰峰,还采用标准加入法来定性,以确保分析的准确性。
1.3.5 表儿茶素与儿茶素标准曲线制作及在花生衣中含量分析
试验以峰面积(mV·min)为横坐标(x),质量浓度(mg/mL)为纵坐标(y)制作表儿茶素与儿茶素的标准曲线,以此为对照测定样品中表儿茶素与儿茶素浓度,含量计算方法如下:

式中:c为测得样品质量浓度(mg/mL);m为试验称取花生衣的质量,g。
1.3.6 表儿茶素精密度与加标回收率实验
由于在花生衣HPLC分析中仅有红花生衣中检出儿茶素,试验仅对表儿茶素进行精密度与加标回收率分析。精密度试验计算:对花生衣样品溶液连续进样5次的峰面积及保留时间的RSD值。加标回收率试验设计方法为:取5 mL花生衣样品溶液与5 mL表儿茶素标准品溶液,将二者混合,再检测混合液中表儿茶素浓度。回收率结果按照以下公式计算:

式中:c混合为混合溶液质量浓度,(mg/mL);c样品为花生衣样品溶液质量浓度,(mg/mL);c标样为表儿茶素标准品溶液质量浓度,(mg/mL)。
2 结果与分析
2.1 色谱条件与方法因素分析
2.1.1 流动相因素分析:
对于表儿茶素、儿茶素、绿原酸、鞣酸及没食子酸的分析,在280 nm波长下流动相以乙腈-0.5%乙酸的不同比例进行实验。试验结果显示,若流动相中乙腈的比例小于8%,随着乙腈比例的减小表儿茶素与儿茶素的保留时间逐渐变长,不利于分析,或者乙腈浓度更低时儿茶素与表儿茶素均不出峰;当乙腈比例为10%时,表儿茶素与儿茶素能完全分离,花生衣样品在70 min内所有出峰完成;当乙腈比例为15%及以上时表儿茶素与儿茶素出峰时间明显缩短,且二者不能完全分离,所以流动相乙腈比例选择10%较为合理。另外,在此流动相条件下考虑实验目标物保留时间均在20 min内,为缩短样品分析时间,在20 min以后采取梯度洗脱。
对于槲皮素与芦丁的分析,在360 nm波长下流动相以甲醇-0.5%乙酸的不同比例来试验,结果显示,当甲醇比例为30%时,槲皮素不出峰,芦丁保留时间约为27 min,当为40%时,芦丁与槲皮素保留时间较长均超过20 min,当为45%时,二者保留时间均小于15 min,样品中槲皮素与芦丁也均与其他物质完全分离,所以流动相甲醇比例选择45%较为合适。
2.1.2 保留时间与加入标准法定性分析
由于样品中绿原酸的峰很低,同时其峰的周围有其他峰的影响而不易判断,所以定性分析采用保留时间与样品中加入绿原酸标准品的方法来分析,同时绿原酸标样与花生衣样品为同一天的某时段连续进样分析。
2.2 花生衣中各多酚物质HPLC分析结果
在280 nm波长下各标准品(表儿茶素、儿茶素、绿原酸、没食子酸、鞣酸)以及花生衣样品HPLC图见图1~图2。
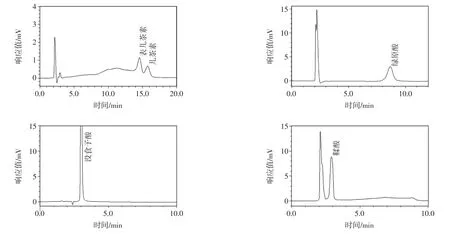
图1280 nm波长下标准品HPLC图Fig.1 The HPLC chromatogram of standard sample detected at 280 nm

图2280 nm波长下花生衣HPLC图Fig.2 The HPLC chromatogram of peanut skin detected at 280 nm
通过标准品与样品HPLC图像分析可知,白、红两种花生衣中均含有表儿茶素及少量绿原酸,红花生衣中还含有少量儿茶素,而白花生衣中不含儿茶素,或者含量太低未检出;两种花生衣中均不含鞣酸与没食子酸,这与前人个别研究报道有差异。

图3 槲皮素、芦丁标准品HPLC图Fig.3 The HPLC chromatogram of quermination and rutin standard sample
在360 nm波长下标准品槲皮素与芦丁及花生衣样品HPLC图见图3~图4。

图4 花生衣HPLC图Fig.4 The HPLC chromatogram of peanut skin
通过标准品与样品HPLC图像分析可知,白、红两种花生衣中均含有槲皮素与芦丁,同时通过峰高可以初步判断红花生衣中槲皮素与芦丁含量均明显高于白花生衣中含量。
另外试验还用国标法对白、红两种花生衣进行白藜芦醇的提取与色谱分析,用100 mL80%的乙醇提取0.5 g花生衣中的白藜芦醇,结果在提取液中并未检测到白藜芦醇,说明本地白、红两种花生衣白藜芦醇含量远远低于表儿茶素等物质含量。
2.3 花生衣中表儿茶素与儿茶素含量分析
2.3.1 表儿茶素与儿茶素标准曲线制作结果
表儿茶素与儿茶素的峰面积-浓度的标准曲线制作结果见图5,表儿茶素方程式为y=(3.661 77×10-7x+1.088 52×10-3,r=0.998 123 8;儿茶素方程式为 y=3.381 17×10-7x+2.682 08×10-5,r=0.998 559 8。

图5 表儿茶素与儿茶素标准曲线Fig.5 HPLC standard curve of epicatechin and catechin
以表儿茶素与儿茶素标准曲线为对照测定花生衣中表儿茶素与儿茶素的质量浓度,并计算含量,结果见表1。

表1 花生衣中表儿茶素、儿茶素含量Table 1 Content of epicatechin and catechin in peanut skin
通过分析可知红花生衣中表儿茶素含量略低于白花生衣中含量,而红花生衣中表儿茶素含量约为儿茶素含量的7倍多。
2.3.2 精密度与加标回收率试验分析结果
精密度实验结果见表2。
该方法精密度分析峰面积RSD为3.52%,浓度RSD为2.99%,说明该方法重现性好。加标回收率试验结果见表3。

表2 表儿茶素精密度试验结果Table 2 Result of precision test for epicatechin determination

表3 表儿茶素加标回收率试验结果Table 3 Result of recovery test for epicatechin determination
其中最低加标回收率为96.23%,最高为106.93%,平均加标回收率为101.43%,基本符合色谱分析加标回收率要求,说明该色谱分析方法测得数据基本准确,结果也较为可靠。
3 结论与讨论
花生衣多酚类物质的HPLC分析,在280 nm波长下以乙腈-0.5%乙酸(10∶90,体积比)为流动相能对儿茶素、表儿茶素等原花青素类单体以及酚酸类物质有较好的分离效果,采用该方法分析花生衣中表儿茶素含量时,峰面积及浓度RSD分别为3.52%及2.99%,说明该方法分析数据可靠;另外,两种花生衣HPLC图像显示,在此色谱分析条件下花生衣中还有其他几种多酚类物质也明显被分离,而且色谱峰较高,这为花生衣中其他多酚类物质的分析与检测研究提供了参考依据;以甲醇-0.5%乙酸(45∶55,体积比)为流动相在花生衣中同时检测出槲皮素与芦丁,方法简单可行;本地白、红两种花生衣中表儿茶素、儿茶素含量,以及槲皮素、芦丁两种黄酮醇含量有不同的差异,这为进一步研究不同品种花生衣中表儿茶素没食子酸酯、儿茶素没食子酸酯、表没食子儿茶素没食子酸酯等儿茶素类以及原花青素B2[6]等含量的差异提供一定的理论依据。
[1]张秀尧,凌罗庆,戴荣兴.花生衣的化学成分研究[J].中国中药杂志,1990,15(6):36-38
[2]Lou Hongxiang,Yuan Huiqing,Ma Bin,et al.Polyphenols from peanut skins and their freeradical-scavenging effects[J].Phytochemistry,2004,65(16):2391-2399
[3]Jianmei Yu,Mohamed Ahmedna,Ipek Goktepe.Effects of processing methods and extraction solvents on concentration and antioxidant activity of peanut skin phenolics[J].Food Chemistry,2005,90(7):199-206
[4]王文昕,董全.响应面法优化超声辅助提取花生红衣多酚工艺[J].食品科学,2012,33(22):1-5
[5]陈洋,王冰,玉佳男,等.RP-HPLC-ESI-MS/MS分离鉴定花生红衣原花青素A型和B型二聚体[J].食品科学,2013,34(23):140-146
[6]赵艳敏,王志平,刘岱琳.葡萄籽和花生红衣中原花青素的差异性研究[J].食品研究与开发,2014,35(3):75-78,84
[7]严丹,赵重博,解达帅,等.花生衣开发利用研究进展[J].亚太传统医药,2015,11(20):51-54
[8]张红梅,金征宇,朱立贤,等.花生衣红抗氧化活性的研究[J].食品与生物技术学报,2005,24(6):83-87
[9]吴克刚,袁林,柴向华,等.花生红衣多酚的乙醇提取及清除DPPH自由基能力的研究[J].中国食品添加剂,2012(5):92-96.
[10]初丽君,张睿,尹贤华,等.花生红衣多酚类物质组成及抑菌活性研究[J].中国油脂,2014,39(6):77-79
[11]刘大川,刘强,吴波,等.花生红衣提取物中自藜芦醇、原花色素分离工艺的研究[J].食品科学,2006,27(1):134-140
[12]王庆玲,董娟,姬华,等.花生红衣原花色素研究进展[J].食品研究与开发,2011,32(4):184-186
[13]吕丽爽.天然抗氧化剂低聚原花青素的研究进展[J].食品科学,2002,23(2):147-150
[14]FRANCISCO M L.RESURRECCION A V A.Development of a reversed-phase high performance liquid chromatography(RP—HPLC)procedure for the simultaneous determination of phenolic compounds in peanut skin extracts[J].Food Chemistry,2009,117(2):356-363
[15]邹盛勤,姜琼.RP-I-IPLC测定茶叶中没食子酸、儿茶素和表儿茶素的含量[J].江苏农业科学,2014,42(7):322-324
[16]韦杰,周璐炜,何金莲,等.HPLC法测定乌龙茶中6种儿茶素类成分含量[J].分析仪器,2016(6):55-57
[17]侯颖.HPLC法测定蠲痹抗生丸中儿茶素、表儿茶素、松果菊苷和毛蕊花糖苷[J].中成药,2013,35(12):2649-2653
[18]黄镛,林钰文,杨柳青.中药茅莓根、茎、叶中表儿茶素的含量测定[J].北方医学,2016,13(7):3-4
[19]蒋文玉,李江,邓俊刚,等.高效液相色谱法测定花生红衣中儿茶素的含量[J].华夏医学,2014,24(6):11-13
[20]陈召桂,卢艳花,魏东芝.HPLC测定葡萄籽提取物中原花青素B2的含量[J].中成药,2007,29(11):1645-1647
[21]辛立波,李晓波,於洪建,等.葡萄籽低聚原花青素化学成分及抗氧化研究[J].食品研究与开发,2012,33(8):40-43
[22]侯冬岩,刁全平,吴寒,等.岩茶水库岭肉桂中原花青素的高效液相色谱一串联质谱法分析[J].质谱学报,2013,34(1):51-56
[23]杜蕾,李新华.黑、红花生衣中原花色素的分析[J].食品科学,2014,35(4):190-194
[24]裴云逸.白·红花生衣多酚物质含量分析及提取技术优化[J].安徽农业科学,2015,43(30):221-224
