番木瓜籽中硫代葡萄糖苷的超声辅助降解研究
2018-03-06于磊李文钊姜化彬韩红超阮美娟
于磊,李文钊,姜化彬,韩红超,阮美娟
(天津科技大学食品工程与生物技术学院,天津300457)
番木瓜籽是番木瓜加工过程中的废料,目前没有得到充分利用,番木瓜籽占番木瓜重量的7%,将番木瓜籽综合开发利用,对提高番木瓜产业的附加值具有重要意义[1]。目前对番木瓜籽已开展了较多的研究,主要集中在以下几个方面:番木瓜籽营养成分分析、番木瓜籽油的提取及成分分析和功能评价、番木瓜籽中活性成分的相关研究、番木瓜籽中异硫氰酸酯的研究[2-4]等。异硫氰酸酯是一类具有-N=C=S基团的化合物,是硫代葡萄糖苷的酶解产物[5],在自然界中主要以硫代葡萄糖苷的形式广泛存在于十字花科[6]、番木瓜科、柏乐树科、白花菜科、旱金莲科、多籽果科等双子叶植物中[7]。异硫氰酸酯是一种具有特殊风味的物质,其抗癌活性已经得到了确认,对于其抑菌活性、提高细胞的抗氧化能力的研究还正在进行[8]。硫代葡萄糖苷(Glucosinolates,简称GS)是一类广泛存在于植物界的次生代谢产物,其降解产物具有多种活跃的化学和生物活性[9-10]。GS种类繁多,根据其侧链R基团来源不同可以分为脂肪族、芳香族和吲哚族3大类[6,11]。GS降解过程受多种因素影响而难以控制:不同种类的GS在硫苷酶作用下产生异硫氰酸酯类、腈类、硫氰酸酯类、环腈类、恶唑烷酮类化合物等,在较高温度下能发生自降解,在强酸、强碱以及某些化学物质的作用下也不稳定,也能在微生物作用下有效降解[9,12]。硫代葡萄糖苷的降解方式共包含4种方式,酶降解、热降解、化学降解、微生物降解[11,13]。本文在酶降解基础上,对番木瓜籽中的硫代葡萄糖苷进行超声辅助降解,优化超声波辅助降解工艺,使异硫氰酸苄酯(Benzylisothiocyanate,简称BITC)得率达到最大,为提高GS的转化率提供理论基础。
1 材料与方法
1.1 材料与仪器
1.1.1 主要原辅料
番木瓜籽:海南斯坦德生物科技有限公司;异硫氰酸苄酯(98%):西格马奥格里奇(上海)贸易有限公司。
1.1.2 主要仪器与设备
752E紫外可见分光光度计:天津市普瑞斯仪器有限公司;KA2200DE超声波清洗机:昆山超声仪器有限公司;VARIAN4000MS气相色谱-质谱联用仪:美国瓦里安技术有限公司;FT-IR傅立叶变换红外光谱仪:赛默飞世尔科技公司
1.2 方法
1.2.1 硫代葡萄糖苷的检测方法
硫代葡萄糖苷的检测采用3,5-二硝基水杨酸(3,5-Dinitrosalicylic acid,DNS)比色法,制作葡萄糖标准曲线,并对硫代葡萄糖苷进行测定[14]。
1.2.1.1 样品的降解
样品超声辅助降解:准确称取番木瓜籽粉末样品0.500 g两份,分别置于两支25 mL刻度试管中。在一支试管中加入35℃~38℃蒸馏水15 mL,置37℃水浴中恒温酶解48 min,使硫代葡萄糖苷在芥子酶作用下完全水解,完成酶解后加热至沸并保持10 min。在一支试管中加沸水15 mL,立即加热至沸并保持10 min。随后进行超声辅助降解。
1.2.1.2 硫代葡萄糖苷的检测
在两支试管中分别加入2 mL三氯乙酸,以沉淀其中的蛋白质等物质,静置后在4 000 r/min的转速下离心除去残渣(残渣体积约2 mL),将上清液移至25 mL刻度试管,加1.5 mL浓度为1 mol/L氢氧化钠溶液调节pH值至中性,最后加蒸馏水定容至25 mL,滤纸过滤,取滤液各0.5 mL,按葡萄糖标准曲线绘制方法,分别测定其吸光度。
1.2.1.3 硫代葡萄糖苷含量的计算
硫代葡萄糖苷含量按公式(1)计:

式中:C1为灭酶管葡萄糖量,mg;C2为酶解管葡萄糖量,mg;m为样品质量,mg;2.167为硫代葡萄糖转化为硫代葡萄糖苷的系数(以苄基硫代葡萄糖苷计算)。
1.2.2 异硫氰酸苄酯的检测方法
在NY/T 1596-2008《油菜饼粕中异硫氰酸酯的测定(硫脲比色法)》的基础上进行改进,利用内源酶进行酶解代替在样品前处理中加芥子酶[15]。
1.2.2.1 样品的处理
1)样品热降解处理:将番木瓜籽用万能粉碎机粉碎,过100目标准筛,准确称取0.200 0 g番木瓜籽粉末放入圆底烧瓶中,加入5.0 mL水混合,接冷凝器,于集热式恒温磁力搅拌器中油欲,在适当温度下恒温油浴1 h,热降解完成后,转移至具塞试管中备用。
2)将番木瓜籽用万能粉碎机粉碎,过100筛,准确称取0.200 0 g番木瓜籽粉末放入具塞试管中,加入2.0 mL pH值为7.0的缓冲溶液充分混合并在35℃下恒温水浴2 h,水浴酶解完成后,样品备用。
往具塞试管中加2.5 mL二氯甲烷,用旋涡混合器混合均匀,在室温下震荡0.5 h,4 000 r/min转速下离心20 min,取6.0 mL体积分数为80%的氨乙醇于具塞试管,用微量进样器取离心管下层有机相50 μL,加入到装有80%氨乙醇具塞试管中,盖上塞。漩涡混合均匀,将具塞试管放入水浴锅,50℃下加热0.5 h后取出,冷却至室温,用紫外分光光度计,10 mm石英比色皿测定光密度值,测定波长分别为 235、245、255 nm。同时测定试样空白溶液。
1.2.2.2 异硫氰酸苄酯含量的计算
试样中异硫氰酸苄酯的含量(ω)以每克样品中异硫氰酸苄酯的毫克数(mg/g)表示,按公式(2)计算:

式中:O.D235为试样235 nm处的光密度值;O.D245为试样245 nm处的光密度值;O.D255为试样255 nm处的光密度值;28.55为异硫氰酸苄酯的换算系数。
1.2.3 番木瓜籽中硫苷超声辅助降解产物研究
1.2.3.1 番木瓜籽硫苷超声辅助降解产物的制备方法
番木瓜籽用万能粉碎机粉碎,过100目标准筛,准确称取0.2 g木瓜籽粉末于10 mL刻度试管中,加入配制好pH值为7.0的缓冲液4 mL,旋涡混合器充分混匀,于35℃酶解反应48 min,随后进行超声辅助降解。
降解样品加入5 mL正己烷,用旋涡混合器充分混合均匀,将混合均匀的样品移至15 mL离心管中,在4 000 r/min转速下离心10 min,将下层有机相移至具塞试管中,加入过量无水硫酸钠除水,并置于冰箱冷冻过夜,将上清液取出作为待测样品。
1.2.3.2 GC-MS分析条件
色谱条件:在此基础上进行改进,DB-5石英毛细管柱(30 m×0.32 mm×0.25 μm);升温程序:100℃保持3 min,以10℃/min升至310℃,保持5 min;载气为He,流速1.4 mL/min;进样口温度250℃,分流比 10 ∶1,进样量 1 μL。
质谱条件:电子轰击离子源;电子能量70 eV;传输线温度200℃;离子源温度200℃;质量扫描范围 m/z 40~600。
1.2.3.3 红外光谱仪分析条件
红外光谱仪条件:背景扫描次数,32;样品扫描次数,32;采样增益,4.0;分辨率,4.000;光阑,100.00;分束器,KBr;动镜速度,0.474 7;检测器,DTGS ART;光源,红外光源IR。
1.2.4 超声波辅助降解对硫代葡萄糖苷降解的影响
探究超声波对硫代葡萄糖苷降解的影响,在内源酶降解基础上进行超声辅助降解。酶解条件为:缓冲液 pH4.8,料液比 1∶20(g/mL),酶解时间 48min,酶解温度27℃。
1.2.4.1 超声时间对硫代葡萄糖苷可控降解的影响
探究超声时间对硫代葡萄糖苷降解的影响,超声功率60 W,水温30℃,超声时间分别为0、5、10、15、20、25、30 min。分别测定 GS 降解率、BITC 得率。
1.2.4.2 超声温度对硫代葡萄糖苷可控降解的影响
探究超声温度对硫代葡萄糖苷降解的影响,超声功率60 W,超声时间25 min,超声温度分别为20、35、50、65、80 ℃。分别测定 GS 降解率、BITC得率。
1.2.4.3 超声功率对硫代葡萄糖苷可控降解的影响
探究超声功率对硫代葡萄糖苷降解的影响,超声温度35℃,超声时间25 min,超声温度功率为40、60、80、100 W。分别测定 GS降解率、BITC 得率。
1.2.4.4 超声波辅助番木瓜籽中硫代葡萄糖苷降解的优化试验
在单因素试验基础上,进行影响面优化,根据Box-Behnken模型的试验设计原理[16],用Design-Expert软件安排试验组合。分别测定异硫强酸苄酯得率及硫代葡萄糖苷降解率。
1.2.4.5 超声辅助硫代葡萄糖苷降解产物分析
利用GC-MS,分别对最优条件下(异硫强酸苄酯得率最高、硫代葡萄糖苷降解率最高)的降解产物进行测定。
2 结果与讨论
2.1 硫代葡萄糖苷含量检测
葡萄糖标准曲线的制作:经试验获得的葡萄糖浓度与吸光度关系,葡萄糖标准曲线见图1所示。

图1 葡萄糖标准曲线Fig.1 Standard curve of glucose
吸光度Y与葡萄糖浓度X(mg/mL)的关系为:

此标准曲线可用于溶液中葡萄糖含量的测定,进而计算出溶液中硫代葡萄糖苷的含量。
2.2 超声波辅助降解对硫代葡萄糖苷降解的影响
原料粒径100目,按照酶解条件料液比1∶20(g/mL),缓冲液pH=4.8,酶解时间48 min进行酶解,随后进行超声辅助降解,因素为时间、功率、温度。以GS降解率、BITC得率为指标分别进行单因素试验,并进行响应面优化。
2.2.1 超声时间对硫代葡萄糖苷降解的影响
探究超声时间对硫代葡萄糖苷降解的影响,超声功率60 W,超声温度30℃,超声时间分别为:0、5、10、15、20、25、30 min。原料粒径 80 目,酶解条件:27 ℃、料液比 1 ∶20(g/mL),pH=4.8,酶解 48 min 辅助条件:超声功率60 W,温度30℃。分别测定GS降解率、BITC得率。结果如图2。
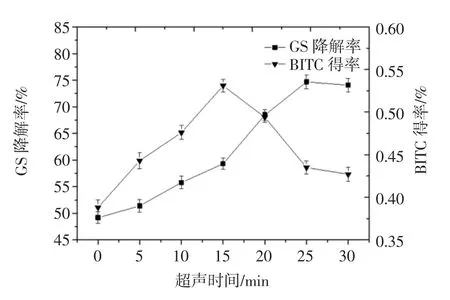
图2 超声时间对GS降解的影响Fig.2 Effect of ultrasonic time on degradation of GS
由图2可知,随着超声时间延长,GS降解率呈增大趋势,当超声时间达到25 min时,GS降解率最大,为74.68%±1.24%,当辅助时间继续延长时,GS降解率不再增加。随着超声时间延长,BITC得率逐渐增大,在超声时间为15 min时,BITC得率最高,达到(0.531±0.008)%,当辅助时间继续延长时,BITC得率不再增加。
2.2.2 超声温度对硫代葡萄糖苷降解的影响
探究超声温度对硫代葡萄糖苷降解的影响,超声功率60 W,测定GS降解率时超声时间为25 min(测定BITC得率时超声时间15 min),超声温度分别为:20、35、50、65、80℃。分别测定 GS降解率、BITC得率。结果如图3。
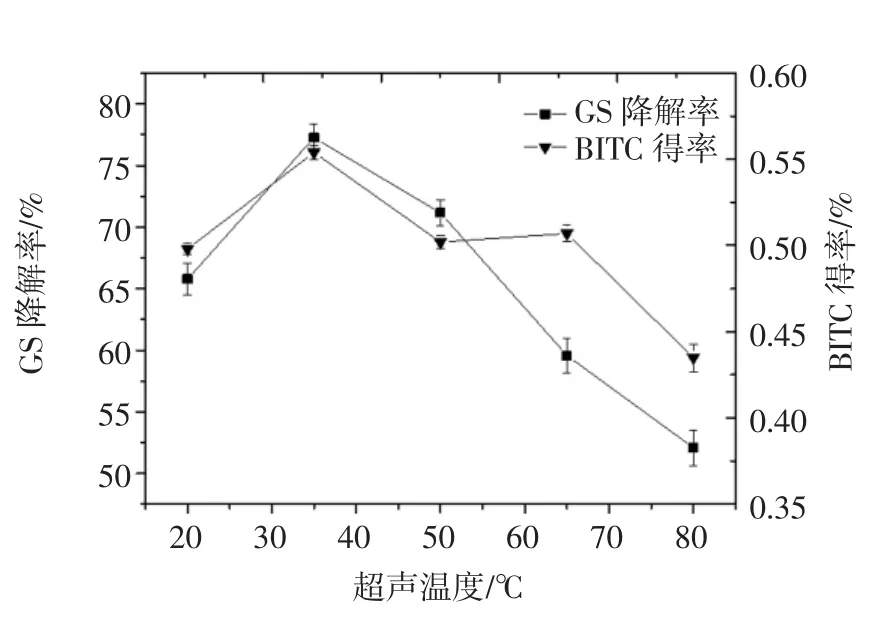
图3 超声温度对GS降解的影响Fig.3 Effect of ultrasonic temperature on degradation of GS
由图3可知,随着超声温度升高,GS降解率呈增大趋势,当超声温度达到35℃时,GS降解率最大,为(77.25±1.12)%,当超声温度继续增大时,GS降解率不再增加。随着超声温度升高,BITC得率逐渐增大,在超声温度为35℃时,BITC得率最高,达到(0.554±0.004)%,当辅助温度继续升高时,BITC得率不再增加。
2.2.3 超声功率对硫代葡萄糖苷降解的影响
探究超声功率对硫代葡萄糖苷降解的影响,超声温度35℃,测定GS降解率时超声时间为25 min(测定BITC得率超声时间15 min),超声功率为40、60、80、100 W。分别测定GS降解率、BITC得率。结果如图4。

图4 超声功率对GS降解的影响Fig.4 Effect of ultrasonic power on degradation of GS
由图4可知,随着超声温度升高,GS降解率呈增大趋势,当超声功率达到60 W时,GS降解率最大,为77.187%±1.3%,当超声温度继续增大时,GS降解率不再增加。随着超声温度升高,BITC得率逐渐增大,在超声功率为60 W时,BITC得率最高,达到(0.554±0.005)%,当辅助功率继续增大时,BITC得率不再增加。
2.2.4 超声波辅助对番木瓜籽中BITC得率优化试验
结合单因素试验结果以BITC得率为优化指标,设计响应面优化试验,超声波辅助BITC得率响应面优化试验设计见表1。
应用Design-Expert软件对上述试验结果进行响应面分析,可以得到该模型的二阶拟合方程:
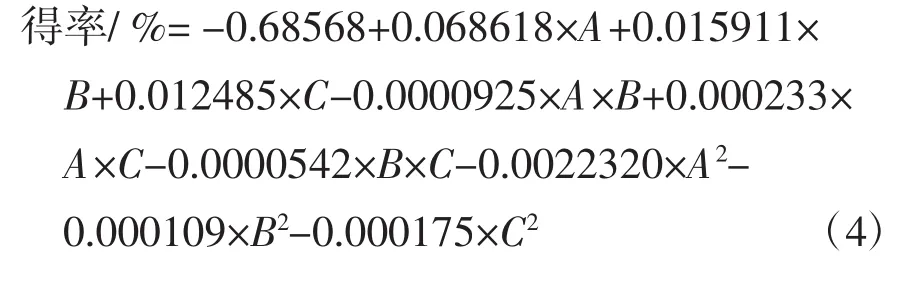
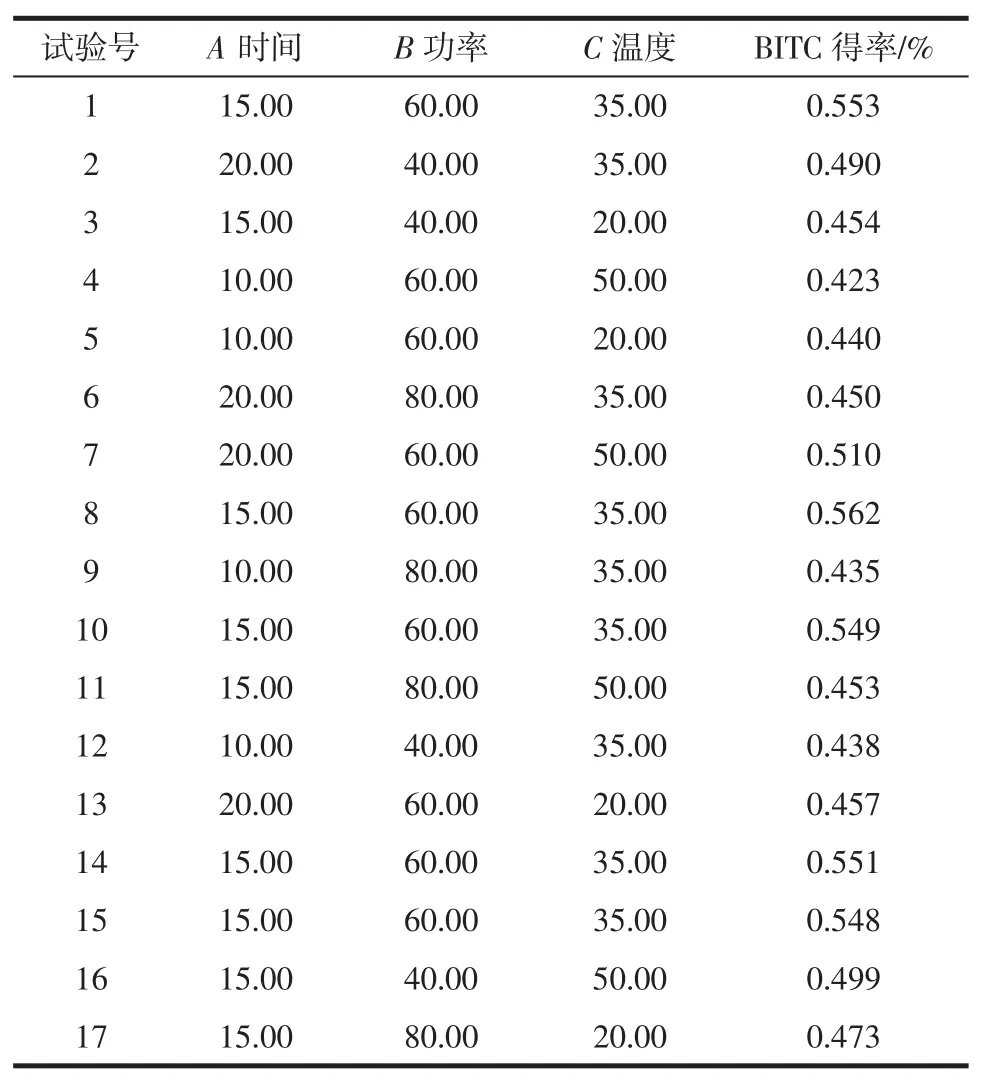
表1 超声波辅助GS降解响BITC得率响应面优化试验Table 1 Response surface optimization experiment of ultrasonic assisted GS degradation BITC yield
该模型的方差分析结果见表2所示。
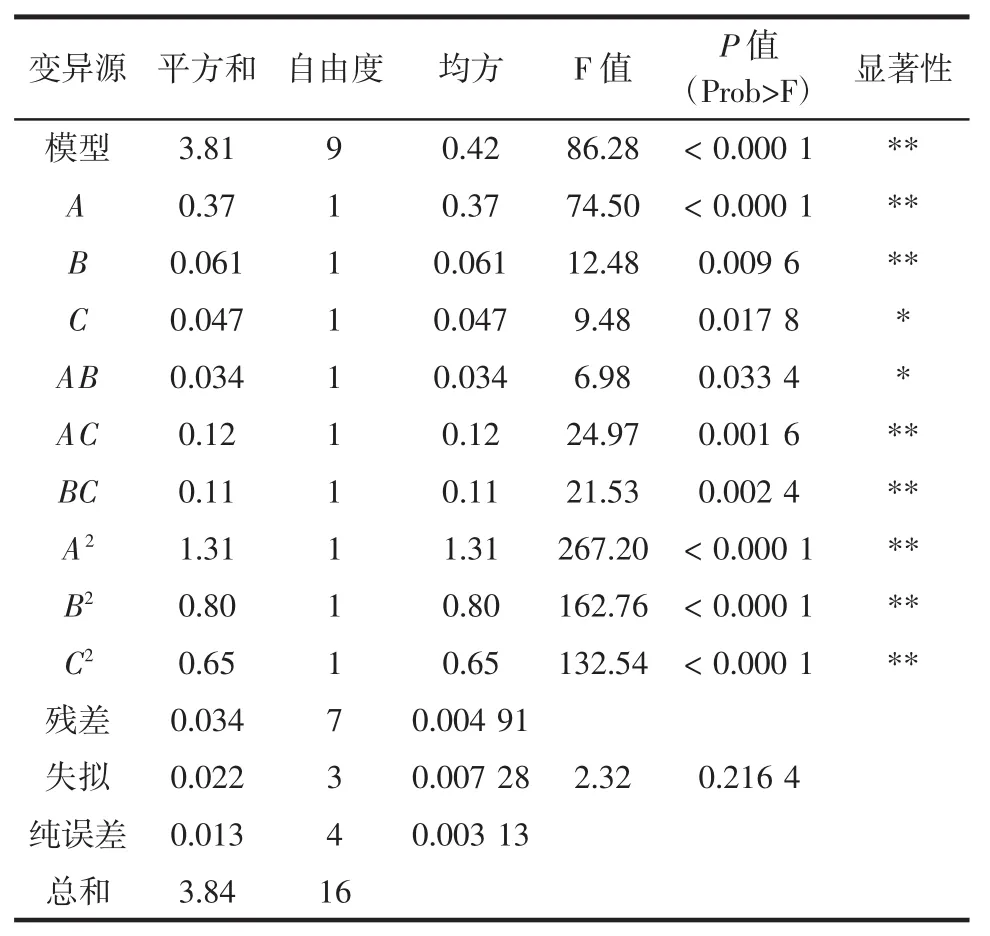
表2 响应面设计二阶回归模型方差分析Table 2 Analysis of variance for the second-order regression model
从表2可以看出,该回归模型P值<0.000 1,说明了该方程模型极显著,模型失拟项P值>0.05,说明失拟不显著,可以利用该模型预测异硫氰酸苄酯的最高得率;从分差分析结果来看,超声时间,超声功率对辅助酶解得率影响极显著,超声温度对辅助酶解得率影响显著;超声时间与超声功率的交互相应对酶解得率有显著影响,超声时间与超声温度,超声功率与超声温度的交互相应对酶解得率有极显著影响,说明超声时间(A)、超声功率(B)、超声温度(C)3个因素对酶解得率的影响不只是简单的线性关系,交互项、二次项也有一定的影响。
应用Design-Expert软件对上述试验结果进行响应面分析,可以得到该模型的响应面图和等高线图,见图5。
从图5响应面及等高线图来看,超声时间、超声功率、超声温度之间具有一定的交互效应。通过Design Expert软件对试验模型进行优化,以异硫氰酸苄酯得率最高为优化目标,得到的最优超声时间16.17 min、超声功率56.82 W、超声温度37.72℃,预期BITC得率0.56%。实际操作过程中选择超声时间16.17 min、超声功率60 W、超声温度38℃,此时异硫氰酸苄酯的得率为0.558%,硫代葡萄糖苷的降解率为(63.62±1.17)%。
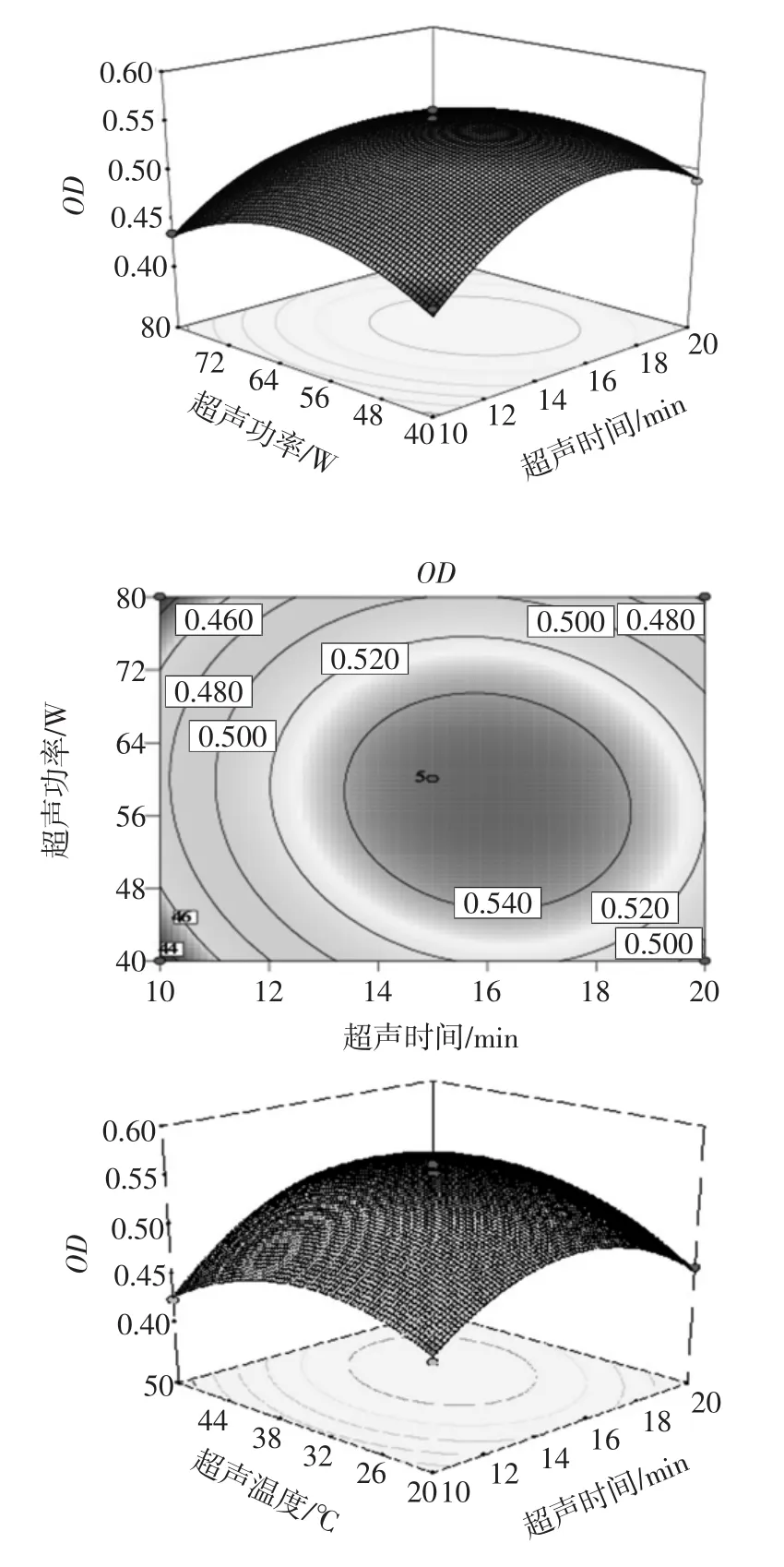
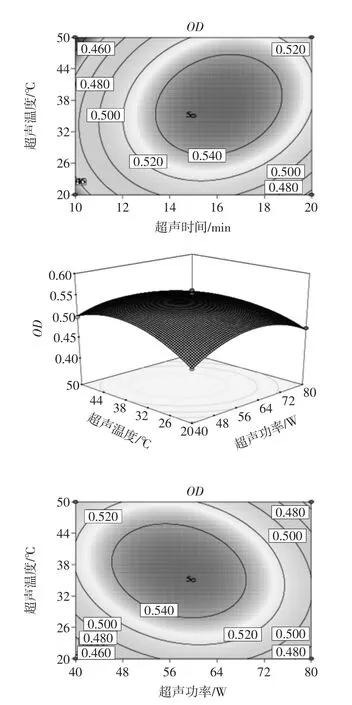
图5 响应面图和等高线图Fig.5 Response surface map and contour map
2.2.5 降解BITC提取分离及鉴定
2.2.5.1 酶解超声辅助降解BITC提取分离
番木瓜籽粉碎过100目筛,按照酶解条件(料液比 1 ∶20 g/mL,缓冲液 pH=4.8,酶解时间 48 min)进行酶解,在超声时间16.17 min、超声功率60 W、超声温度38℃条件下进行辅助降解。随后将降解产物进行同时蒸馏萃取,萃取目标产物BITC。收集粗提物约1 g进行硅胶柱层析,获得BITC纯品。随后进行GC-MS分析,见图6。

图6 番木瓜籽提取物的GC-MS分析谱图Fig.6 GC-MS analysis spectra of papaya seed extract
如表3,初步判定出硫代葡萄糖苷可能的酶解产物,分别为苯甲醛(RT3.41min)、氯化苄(RT3.615min)、异氰酸苄酯(RT5.085min)、硫氰酸苄酯(RT8.533 min)、异硫氰酸苄酯(RT8.834 min),通过分析可以发现,酶解产物中有苄基,由此推测番木瓜籽中含有苄基硫代葡萄糖苷;由于在气质分析结果中并没有发现其他类别的异硫氰酸酯,所以可以认为番木瓜籽中只有苄基硫代葡萄糖苷这一种硫苷,这与文献报道的结果相一致。另外纯化后番木瓜籽提取物中异硫氰酸苄酯纯度达到98.81%,纯度很高。

表3 番木瓜籽提取物GC-MS结果分析Table 3 Analysis of papaya seed extract GC-MS
2.2.5.2 番木瓜籽提取物的鉴定
经过GC-MS结果可以看出,番木瓜籽酶解产物主要为异硫氰酸苄酯,其对应的主要前提物质为苄基硫苷,为了进一步确定提取物为异硫氰酸苄酯,通过红外光谱的方法对纯化后的提取物进行鉴定。
用毛细管吸取少量的异硫氰酸苄酯提取物和异硫氰酸苄酯标品分别涂抹样品去,进行400 cm-1~4 000 cm-1的红外光谱扫描。
红外条件:背景扫描次数,32;样品扫描次数,32;采样增益,4.0;分辨率,4.000;光阑,100.00;分束器,KBr;动镜速度,0.474 7;检测器,DTGS ART;光源,红外光源IR。

图7 番木瓜籽异硫氰酸苄酯纯化物和异硫氰酸苄酯标品红外光谱Fig.7 Infrared spectroscopy of purified benzyl isothiocyanate from papaya seed and benzyl isothiocyanate standard substance
由图7,3 032 cm-1为苯环上=C-H的伸缩振动(ν=C-H),2 924 cm-1为亚甲基的不对称伸缩振动(ν-CH2),2 860 cm-1为亚甲基的对称伸缩振动(ν-CH2),2 175、2 093 cm-1为-N=C=S 的特征吸收峰,1 604、1 496、1 454、1 439 cm-1为苯环骨架振动吸收带(ν骨架),732、699 cm-1芳氢的面外弯曲振动(ν=C-H),454 cm-1环上C=C面外弯曲振动。经过对比,番木瓜籽异硫氰酸苄酯纯化物和异硫氰酸苄酯标品的红外光谱一致。
3 结论
超声波辅助番木瓜籽中硫代葡萄糖苷的降解试验中,在内源酶水解硫代葡萄糖苷的基础上进行超声波辅助。在单因素基础上,对超声时间、超声功率、超声温度3个因素进行优化。以异硫氰酸苄酯得率最高为优化目标,发现超声时间、超声功率、超声温度之间具有一定的交互效应。得到的最优超声时间16.17 min、超声功率60 W、超声温度38℃,异硫氰酸苄酯的得率为0.558%,此时硫代葡萄糖苷的酶解率为63.62%。纯化后经气相色谱及红外光谱分析,发现纯化物为异硫氰酸苄酯,且纯度较高,达到98.81%。
[1]杨培生,钟思现,杜中军,等.我国番木瓜产业发展现状和主要问题[J].中国热带农业,2007(4):8-9
[2]ALLARD E,LARPENT C.Core-shell type dually fluorescent polymer nanoparticles for ratiometric pH-sensing[J].Journal of Polymer Science Part A Polymer Chemistry,2008,46(18):6206-6213
[3]KALKUNTE S,SWAMY N,DIZON D S,et al.Benzyl isothiocyanate(BITC)induces apoptosis in ovarian cancer cells in vitro[J].Journal of Experimental Therapeutics&Oncology,2006,5(4):287-300
[4]RADULOVIĆ N S,DEKIĆ M S,STOJANOVIĆ-RADIĆZ Z.Antimicrobial volatile glucosinolate autolysis products from Hornungia petraea(L.)Rchb.(Brassicaceae)[J].Phytochemistry Letters,2012,5(2):351-357
[5]王建华,张振超,毛忠良,等.西兰花硫代葡萄糖苷及其降解产物与育种研究进展[J].江西农业学报,2010,22(12):57-59
[6]修丽丽,钮昆亮.十字花科植物中的硫代葡萄糖苷及其降解产物[J].浙江科技学院学报,2004,16(3):187-189
[7]孔永强,郑华,张弘,等.我国异硫氰酸酯(ITCs)的开发现状及利用前景[J].化工进展,2011(s1):291-294
[8]王梦倩,蔡圣宝,籍保平.皱皮木瓜籽的抗氧化活性以及对HepG2细胞的生长抑制作用[J].食品科技,2013(2):207-210
[9]胡国伟,杨瑛洁,李淑燕,等.异硫氰酸酯分析方法研究进展[J].食品工业科技,2011(12):524-527
[10]李泽友,沈文涛,言普,等.番木瓜中异硫氰酸苄酯及其前体物质苄基硫代葡萄糖苷的含量分析[J].药物分析杂志,2011(4):678-681
[11]杨瑛洁,李淑燕,胡国伟,等.硫代葡萄糖苷的降解途径及其产物的研究进展[J].西北植物学报,2011,31(7):1490-1496
[12]苏光耀,沈莲清,王向阳,等.西兰花籽中硫代葡萄糖苷酶解条件的研究[J].中国粮油学报,2008,23(2):178-182
[13]BLAZEVIC I,MALES T,RUSCIC M.Glucosinolates of Lunaria annua:thermal,enzymatic,and chemical degradation[J].Chemistry of Natural Compounds,2014,49(6):1154-1157
[14]张清峰,姜子涛,张久春,等.紫外分光光度法测定辣根及芥末制品中异硫氰酸酯含量的研究[J].中国调味品,2005(6):15-20
[15]潘雷,李爱科,程茂基,等.异硫氰酸酯(ITC)的硫脲紫外法和银量法测定对比研究[J].安徽农业科学,2009,37(17):7823-7825
[16]SEIGLER D S,PAULI G F,NAHRSTEDT A,et al.Cyanogenic allosides and glucosides from Passiflora edulis and Carica papaya[J].Phytochemistry,2002,60(8):873-882
