钆喷酸葡胺增强MRI对肝硬化背景下肝癌的诊断价值分析
2018-03-06栗斌
栗 斌
(河北省邢台市人民医院CTMR室 054001)
与正常肝脏不同,肝硬化背景下合并占位性病变因肝组织结构异常导致诊断困难,尤其在肝癌与异型增生结节(dyspiasticnodule,DN)的鉴别上,后者属于癌前病变,常规CT及磁共振成像(MRI)很难将二者区分,此时需静脉注射造影剂进行增强[1]。与增强CT相比,增强MRI具有无电离辐射的优势,尤其是磁共振动态增强成像(dynamiccontrastenhancedMRI,DCE-MRI),将图像与灌注参数相结合,大大提高了肝癌的诊断准确率[2]。钆喷酸葡胺(gadolinium-diethylenetriaminepentaaceticacids,Gd-DTPA)是临床上最常用的造影剂,本研究旨在分析Gd-DTPA增强MRI下灌注参数用于诊断肝癌的效果及对判断癌组织分级的意义,现报道如下。
1 资料与方法
1.1 一般资料 选取2015年1月至2016年12月于本院接受GD-DTPA增强MRI检查的肝硬化背景下肝脏局灶性病变患者116例。纳入标准:(1)年龄18~<80岁,男女不限;(2)既往有肝硬化病史,因体检发现肝区局灶性病变接受MRI检查;(3)后经病理学活检或肝穿刺细胞学检查证实为原发性肝癌(PHC)或异型增生结节(DN);(4)患者对本研究知情并签署同意书。排除标准:(1)继发性肝癌(SHC);(2)一般情况差,无法耐受穿刺或手术者;(3)对造影剂过敏或合并严重肾功能不全者。其中男70例,女46例;年龄25~78岁,平均(52.35±4.19)岁;PHC58例,肝脏DN58例;单发性病灶102例,多发性病灶14例;病灶直径2.75~7.52cm,平均(4.65±1.49)cm;代偿期肝硬化34例,失代偿期肝硬化82例。
1.2 方法
1.2.1 检测步骤 仪器采用PhilipsAchieva3.0TTX磁共振扫描仪(购自上海创讯医疗器械有限公司),造影剂选用GD-DTPA(购自济南郭氏伟业化工有限公司)。检查前嘱患者禁食8h,向患者讲述扫描过程中的注意事项,使患者尽量消除紧张情绪,平稳呼吸,并采用多头腹带限制患者腹式呼吸。患者取仰卧位,头先进,双手置于头顶,线圈中心和扫描中心定位于患者剑突下3cm处。首先进行常规平扫,定位病灶,包括轴位T2WI快速自旋回波序列(重复时间2 200ms,回波时间78ms,视野375mm×270mm,层厚4.5mm,层间距2.0mm,反转角135°)、冠状位T2WI半傅立叶采集序列(重复时间2 100ms,回波时间88ms,视野370mm×275mm,层厚4.8mm,层间距1.0mm,反转角75°)、轴位T1WI二维梯度回波序列正反相位成像(重复时间150ms,回波时间2.35ms,视野375mm×280mm,层厚4.8mm,层间距1.2mm,反转角75°)和轴位T1WI三维容积内插体部检查序列(重复时间3.0ms,回波时间1.2ms,视野370mm×275mm,层厚2.8mm,层间距0.7mm,反转角75°)。DCE:通过高压注射器经肘静脉注射GD-DTPA,速率3mL/s,T1WI和T2WI均为轴位,前者快速自旋回波序列(重复时间750ms,回波时间8.2ms,视野360mm×360mm,层厚5.0mm,层距1.0mm),后者采用脂肪抑制技术(重复时间4 000ms,回波时间136.6ms,视野360mm×360mm,层厚5.0mm,层距1.0mm),分别于20、60、120s行3次采集,扫描过程中患者需屏气。
1.2.2 图像分析 将图像资料导入工作站中,采用Tissue-4D软件测量患者病灶及正常肝脏部位的灌注参数,包括转运常数(Ktrans)、速率常数(Kep)和血管外细胞外间隙体积分数(Ve),病灶和正常肝脏均取3个点测量后取平均值,取点时遵循随机的原则且正常肝脏组织取点注意避开血管[3]。
1.2.3 观察指标 (1)患者病灶及正常肝脏部位Ktrans、Kep和Ve;(2)定义病灶的相对灌注参数=病灶灌注参数/正常肝脏组织灌注参数,计算Ktrans相对、Kep相对和Ve相对;(3)根据Edmondson-Steiner′s分级系统,将PHC分为高、中、低分化3级,若病灶中存在不同分化程度的肿瘤组织,以占主要优势的组织分化程度为准,分析PHC病理等级与灌注参数的相关性[4]。
2 结 果
2.1PHC与DN灌注参数比较PHC组Ktrans病灶、Ktrans相对、Ve病灶和Ve相对均低于DN组(P<0.05);两组患者Kep病灶和Kep相对比较,差异均无统计学意义(P>0.05),见表1。
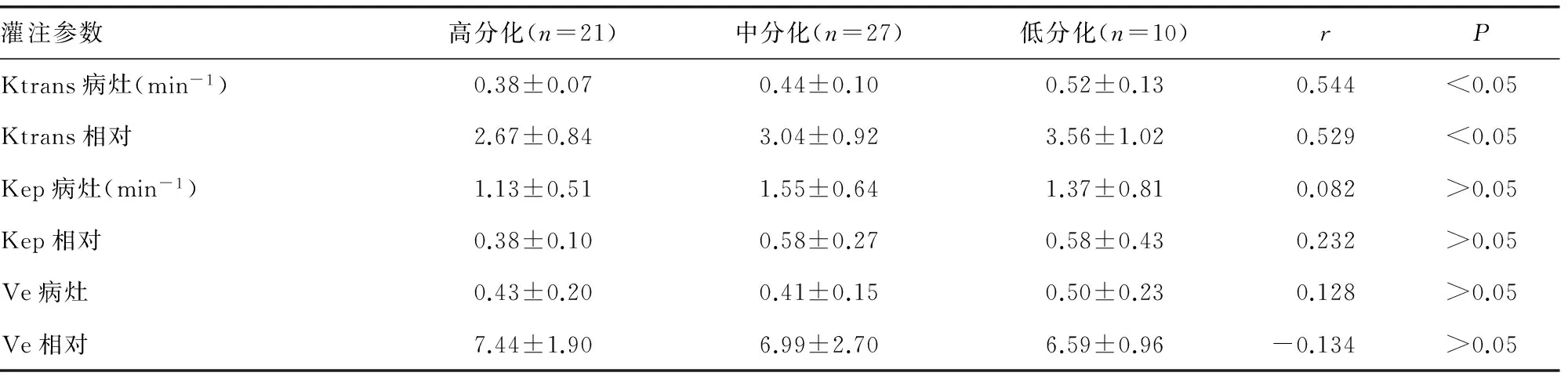
表2 PHC分化程度与灌注参数的相关性分析
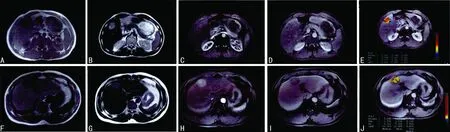
A:平扫T1WI示肝右叶S5段病灶稍低信号;B:平扫T2WI示肝右叶S5段病灶稍高信号;C: 病灶处增强后动脉期明显强化;D:病灶处增强后静脉期强化减退;E:DCE下处理图像得出的灌注参数;F:肝右叶S4段病灶平扫T1WI稍低信号;G:肝右叶S4段病灶平扫T2WI稍高信号;H: 肝右叶S4段病灶增强后,动脉期明显强化;I:肝右叶S4段病灶增强后,静脉期强化减退,病灶呈相对低信号;J:DCE下处理图像得出灌注参数
图1 典型病例GD-DTPA增强MRI检查图像
2.2PHC分化程度与灌注参数的相关性 58例PHC中,高分化21例,中分化27例,低分化10例,经Spearman秩相关检验,Kep病灶、Kep相对、Ve病灶和Ve相对与分化程度无相关性(P>0.05),而Ktrans病灶和Ktrans相对与分化程度呈正相关(P<0.05),见表2。
2.3 典型病例 病例1,患者,男,52岁,体检发现肝右叶占位性病变,病理诊断为“肝细胞性肝癌,低分化”,行GD-DTPA增强MRI检查显示增强后病灶部位动脉期明显强化,静脉期强化减退,见图1A、B、C、D、E。病例2,患者,男,49岁,体检发现肝右叶占位性病变,病理诊断为“肝细胞性肝癌,高分化”,行GD-DTPA增强MRI检查显示病灶增强后,动脉期明显强化,静脉期强化减退,见图1F、G、H、I、J。
3 讨 论
PHC是指起源于肝细胞或肝内胆管的恶性肿瘤,是我国人群中最常见的消化系统恶性肿瘤之一,有研究显示,2012年全球新发肝癌病例50万,其中约42%发生于中国[5]。PHC起病隐匿,当出现肝区疼痛时往往已发展至中晚期,预后较差。PHC往往合并肝硬化背景,随着人们健康理念的不断提高,绝大部分肝硬化患者可做到定期体检,此时发现肝区出现占位性病变,及时诊断并处理可大大改善患者的预后[6]。PHC往往经历再生结节和异型增生结节两个癌前病变过程,然而肝硬化背景下合并上述占位性病变,常规超声、CT和MRI很难将其鉴别[7]。DCE-MRI是近年来用于临床的一项新技术,其在T1WI三维容积内插体部检查序列的基础上,在注入造影剂后快速多期反复扫描以获得组织的血流灌注信息,经过后期数据处理,可获得该部位的灌注参数,即微循环特点[8]。不同组织灌注参数存在明显差异,因此理论上可大大提高诊断的准确率,然而DCE-MRI限于扫描技术和呼吸运动的影响,用于肝脏疾病的诊断方面尚存在争议[9]。
从本研究的结果来看,PHC组Ktrans病灶和Ktrans相对低于DN组(P<0.05),Ktrans又称为造影剂容积转运常数,数值越大血浆向血管外渗透的速度越快,体现血管的通透性,由于PHC的生长需要充足的血供,因此组织在各种细胞因子的作用下产生大量新生血管,然而这种新生血管与正常血管相比表现出杂乱无章、内皮发育不成熟的特点,因此通透性较高,很好地解释了两组间Ktrans病灶和Ktrans相对上的差异。Ve又称为血管外细胞外容积比,当血管通透性增加时,造影剂渗透到血管外的量就越大,同时与DN相比,PHC细胞密度较大,是血管外细胞容积降低,上述两种因素均使Ve降低,因此PHC组Ve病灶和Ve相对低于DN组(P<0.05)。两组患者Kep病灶和Kep相对比较均差异无统计学意义(P>0.05)。经Spearman秩相关检验,Kep病灶、Kep相对、Ve病灶和Ve相对与分化程度无相关性(P>0.05),而Ktrans病灶和Ktrans相对与分化程度呈正相关(P<0.05)。既往研究发现,随着肿瘤细胞分化程度的增加,耗氧量下降,因此低分化肿瘤需要更丰富的血供,根据上述结果推导其血管通透性最大,导致Ktrans病灶和Ktrans相对增加[10]。本研究尚存在以下2点不足:(1)肝脏为双重供血器官,尽管临床上肝癌组织主要通过肝动脉供血,但仍有部分血流来自于门静脉,因此单输入模型仍与实际存在差异[11];(2)Ktrans病灶和Ktrans相对与分化程度呈正相关,而Ve病灶和Ve相对与分化程度并无相关性,因此血管通透性理论是否存在不足仍有待进一步探究[12]。
综上所述,Gd-DTPA增强MRI可良好地反映肝硬化背景下肝癌与DN间血流灌注的差异,灌注参数作为新的定性指标,为肝癌的诊断和分期提供了有力的依据。
[1]张涛,陆健,张学琴,等.比较钆塞酸二钠和钆喷酸葡胺增强MRI检查对乙肝肝硬化背景肝癌的诊断价值[J].临床放射学杂志,2015,34(9):1500-1504.
[2]BASHIRMR,GUPTART,DAVENPORTMS,etal.HepatocellularcarcinomainaNorthAmericanpopulation:doeshepatobiliaryMrimagingwithGd-EOB-DTPAimprovesensitivityandconfidencefordiagnosis?[J].JMagnResonImaging,2013,37(2):398-406.
[3]赵宝宏,徐倩,曾艳红,等.钆喷酸葡胺对肝实质及肝内常见恶性病变T2加权成像的影响[J].临床荟萃,2016,31(11):1244-1247.
[4]赵骏.21例含脂质肝癌的常规超声、超声造影及增强MRI表现[J].肝脏,2015,20(2):140-142.
[5]章俞,胡红杰,赵振华.动态对比增强MRI功能成像参数对肝细胞肝癌和肝转移瘤的鉴别诊断价值[J].临床放射学杂志,2016,35(9):1376-1380.
[6]拉海阿支.动态增强MRI与CT肝灌注成像在肝癌鉴别诊断中的对比分析[J].实用癌症杂志,2016,31(5):855-857.
[7]陈枫,李宏军,李雪芹,等.多期动态增强CT与MRI对小肝癌诊断的比较分析研究[J].医学影像学杂志,2016,26(9):1634-1638.
[8]PARKMJ,KIMYK,LEEMW,etal.Smallhepatocellularcarcinomas:improvedsensitivitybycombininggadoxeticacid-enhancedanddiffusion-weightedMrimagingpatterns[J].Radiology,2012,264(3):761-770.
[9]玉苏甫·肉孜,王云玲,王红,等.DCE-MRI鉴别肝脏占位性病变的研究[J].中国临床医学影像杂志,2015,26(4):260-263.
[10]王化.肝胆特异性磁共振对比剂Gd-EOB-DTPA的应用现状及展望[J].中国医学影像技术,2012,28(7):1415-1419.
[11]桂平,朱建友,翟慎冈,等.肝细胞癌与肝内周闻型胆管细胞癌的螺旋CT动态增强与病理分析[J].中华肝胆外科杂志,2010,16(4):253-256.
[12]李绍林,张雪林,周杰,等.肝内周围型胆管细胞癌临床表现特点和CT、MRI诊断[J].肝胆外科杂志,2003,11(5):338.
