甘草甜素对体外诱导的酒精性脂肪肝细胞的影响及机制研究*
2018-03-06卜晓芬
卜晓芬,李 骏,朱 虹△
(华中科技大学同济医学院附属武汉中心医院:1综合二科;2重症医学科,武汉 430000)
酒精性脂肪肝(alcoholic fatty liver,AFL)是由于长期、过量的乙醇摄入所导致的肝脏受损疾病,主要的病理表现为肝细胞内脂质的蓄积,并且酒精性肝硬化的预后比较差[1-3]。随着近些年饮酒人群的增加,AFL越来越受到人们的重视。甘草甜素是从中药甘草中分离出来的一种五环三萜皂苷化合物[4]。近年的研究发现甘草甜素能够清除机体内多余的氧自由基,发挥抗氧化作用从而对肝脏起到保护作用[5-6]。但是关于甘草甜素在AFL中的作用尚少见报道。因此,本研究采用构建体外乙醇诱导的AFL肝细胞模型,观察甘草甜素对AFL肝细胞的保护作用及其机制。
1 材料与方法
1.1 材料 尼罗红贮存液购自美国Sigma Aldrich公司;RIPM-1640培养基、胎牛血清、胰蛋白酶均购自美国Gibco公司;丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)、三酰甘油(TG)测定试剂盒与CCK8试剂盒购自南京建成生物有限公司;核受体超家族转录因子γ(PPAR-γ)、含有“碱性螺旋-环-螺旋-亮氨酸拉链”结构的核转录因子1(SREBP-1)、固醇调节元件结合蛋白裂解激活蛋白(SCAP)羊抗人多克隆抗体购自Abcam公司;Trizol Reagent购自Invitrogen公司,逆转录试剂盒和cDNA扩增试剂盒均购自Thermo公司。
1.2 方法
1.2.1 正常肝细胞的培养 人正常肝细胞L02细胞用含10%胎牛血清的RIPM-1640培养基,37 ℃,5%CO2环境下培养。
1.2.2 CCK8筛选乙醇诱导细胞的最佳浓度 实验分为空白对照组、对照组、实验组。取处于生长分裂期的细胞,消化后均匀铺于96孔板中。待细胞完全贴壁向孔板中加入用含1%血清的1640培养基配置的0、0.4%、0.8%、1.6%、3.2%、6.4%、12.8%的乙醇。孵育24 h后,加入10 μL CCK8 ,采用酶标仪450 nm处检测各孔中吸光度值。
1.2.3 AFL肝细胞模型建立 将实验分为对照组和诱导组。诱导组加入含3%乙醇的1640培养基培养。对照组0.4%乙醇诱导培养3 d后,换用正常培养基继续培养3 d,并以6 d作为周期进行诱导,传代。在倒置显微镜下观察细胞质内的变化情况。将细胞分为对照组、继续诱导组、脱离乙醇组,甘草甜素组。对照组:用正常培养基培养;继续诱导组:加入含0.4%乙醇的培养基诱导;脱离乙醇组:L02细胞经乙醇诱导之后换用正常培养基培养;甘草甜素组:L02细胞经乙醇诱导之后换用含1.2 mmol/L甘草甜素的正常培养基培养。
1.2.4 CCK8筛选甘草甜素处理细胞的最佳浓度 实验分组同1.2.2。取处于生长分裂期,乙醇诱导30代的细胞。待细胞完全贴壁后加入含0.4、0.8、1.2、1.6、2.0 mmol/L甘草甜素的1%血清的1640培养基,对照组加入不含甘草甜素的1%血清的1640培养基,孵育24 h后,向每孔中加入10 mL CCK8,采用酶标仪450 nm处检测各孔中吸光度值。
1.2.5 尼罗红染色检测细胞内脂肪蓄积 取对数生长期正常的和经乙醇诱导后的L02细胞,接种细胞待培养24 h后。将染料尼罗红贮存液(1 000 μg/mL)用PBS以1∶100稀释比例稀释后滴加至盖玻片上,避光孵育5 min。通过荧光显微镜观察细胞内脂肪的蓄积程度。
1.2.5 细胞ALT和AST泄漏量的测定 分别取对数生长期的各组细胞,经胰酶消化后,1 500 r/min,离心5 min后取各组细胞上清液,严格按照ALT和AST试剂盒上的说明书操作。
1.2.6 细胞内TG水平的测定 分别取对数生长期的各组细胞,胰酶消化后1 500 r/min,离心5 min。PBS清洗细胞2次,每次5 min,计数,控制细胞密度为106个/mL。向各组细胞中加入1 mL裂解液,裂解30 min后,4 ℃离心25 min,收集各组细胞的上清液送于本院检验科进行检测。
1.2.7 流式细胞仪(FCM)检测细胞凋亡情况 取各组中处于对数生长期的细胞,消化离心后制成单细胞悬液,加入500 μL binding-buffer重悬,依次加入Annexin-V、PI各5 μL。于1 h内在FCM上检测。结果判定:FITC-/PI-为活细胞,FITC-/PI+为坏死细胞,FITC+/PI-为早期凋亡细胞,FITC+/PI+为晚期凋亡细胞。细胞凋亡率计算公式如下:
细胞凋亡率(%)=(早期凋亡细胞数+晚期凋亡细胞数)/全部细胞数×100%。
1.2.8 FCM检测细胞周期情况 取各组中处于对数生长期的细胞,消化离心后制成单细胞悬液,加入含75%乙醇的1×binding buffer重悬,4 ℃固定12 h以上,加入RNaseA反应30 min,5 μL PI室温避光反应20 min。于1 h内在FCM上检测。
1.2.9 Western blot检测细胞PPAR-γ,SREBP-1,SCAP蛋白的表达 取各组中处于对数生长期的细胞,提取细胞中的总蛋白,采用12%的十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)2 h分离蛋白,转膜,室温封闭1 h,一抗 4 ℃过夜,二抗[IgG(1∶2 000)]37 ℃孵育2 h,最后电化学发光显影后用凝胶成像分析系统(Bio-Rad,USA)测蛋白条带光密度值。
1.2.10 RT-PCR检测细胞PPAR-γ、SREBP-1、SCAP mRNA的表达 取各组中处于对数生长期的细胞,提取细胞中的RNA,反转录并扩增成DNA。PPAR-γ引物序列上游:5′-GCC TGC ATC TCC ACC TTA TTA-3′,下游:5′-ATC TCC ACA GAC ACG A-3′;SREBP-1引物序列上游:5′-TGG GTT AGA GAA TGT GTT GGT G-3′,下游:5′-GAA GTA GCC GAT GAG GAT GAT G-3′;SCAP引物序列上游:5′-ACA CAG CAA CCA GAA ACT CAA G-3′,下游:5′-AGT GTG TCC TCC ACC TCA GTC T-3′;以GAPDH作为内参,引物序列上游:5′-CAT GGG GTG TGA ACC ATG AGA-3′;下游:5′-GTC TTC TGG GTG GCA GTG AT-3′。RT-PCR反应条件如下:95 ℃预变性10 min,然后95 ℃变形30 s,50 ℃退火30 s,70 ℃延伸1 min,40个循环,最后70 ℃延伸10 min结束。扩增产物经1%琼脂糖凝胶电泳,凝胶成像分析系统检测条带灰度。
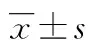
2 结 果
2.1 CCK8筛选乙醇诱导细胞的最佳浓度 随着乙醇浓度的增加,肝细胞的活力随之降低,活细胞的数目也逐渐减少,见图1。

图1 不同浓度乙醇作用肝细胞的CCK8结果
2.2 CCK8筛选甘草甜素处理细胞的最佳浓度 随着甘草甜素处理浓度的增加,细胞活力呈现先升高后降低的趋势,当作用浓度为1.2 mmol/L时,甘草甜素对细胞的促生长作用最大,见图2。

图2 不同浓度甘草甜素作用于AFL肝细胞的CCK8结果
2.3 各组细胞尼罗红染色结果 实验组肝细胞的脂肪蓄积率为(58.85±5.08)%,对照组为(18.12±4.58)%,两组比较差异有统计学意义(P<0.05)。尼罗红染色结果发现,AFL肝细胞中存在大量脂肪的蓄积,见图3。

A:实验组;B:对照组
图3 尼罗红染色显示细胞内脂肪蓄积(×20)
2.4 各组细胞TG水平及ALT、AST泄漏量比较 与对照组比较,脱离乙醇组中TG水平有所降低(P>0.05);甘草甜素组细胞内的TG水平明显降低(P<0.01);继续诱导组细胞内的TG水平有所升高(P>0.05)。与对照组比较,脱离乙醇组细胞内的ALT与AST泄漏量降低(P<0.05);继续诱导组细胞内的ALT与AST泄漏量明显升高(P<0.05);而甘草甜素组细胞内的ALT与AST泄漏量明显降低(P<0.01),见表1。
2.5 各组细胞周期与凋亡情况 对照组中的细胞大部分处于G0/G1期,G2/M期细胞数目少。与对照组比较,甘草甜素组中的细胞,S期细胞明显减少,G2/M期细胞增加,各组比较差异无统计学意义(P>0.05)。与对照组相比,甘草甜素组的细胞凋亡率明显降低(P<0.05),见表2。

表1 各组细胞TG水平及ALT和AST泄漏量 比较
a:P<0.05,b:P<0.01,与对照组比较
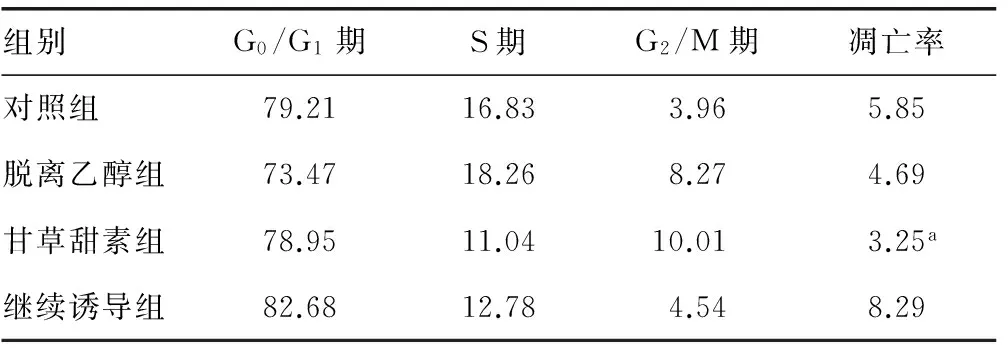
表2 各组细胞周期与凋亡结果比较(%)
a:P<0.05,与对照组比较
2.6 各组细胞中PPAR-γ、SREBP-1、SCAP蛋白的表达 空白对照组中PPAR-γ、SREBP-1、SCAP蛋白的表达低,在乙醇诱导后的AFL肝细胞中3种蛋白的表达出现了明显的升高,经药物甘草甜素治疗后AFL肝细胞内3种蛋白的表达明显降低(P<0.05),见图4。
2.7 各组细胞中PPAR-γ、SREBP-1、SCAP mRNA的表达 空白对照组中PPAR-γ、SREBP-1、SCAP mRNA的表达低,在乙醇诱导后的AFL肝细胞中3种mRNA的表达出现了明显的升高(P<0.05),甘草甜素组肝细胞内3种mRNA的表达明显降低(P<0.05),见表3。

表3 各组细胞中 PPAR-γ、SREBP-1、SCAP mRNA表达比较
a:P<0.01,与空白对照组比较;a:P<0.05,与对照组比较
3 讨 论
近些年,多项研究报道关于甘草甜素在肝炎等肝脏疾病中的作用。研究发现甘草甜素能够对四氯化碳诱导的肝损伤起保护作用,同时临床上采用甘草甜素的脂质体对AFL进行治疗[7]。但关于甘草甜素对酒精性肝损伤的报道少见。
李龙辉等[8]报道通过乙醇诱导L02成功建立了体外AFL模型。而本研究采用CCK8法筛选出了对肝脏细胞无明显损伤作用但又可对细胞活性产生一定影响的乙醇浓度作为亚致死量,通过对诱导前后的细胞进行尼罗红染色,发现诱导后的细胞内脂肪的蓄积率明显高于正常的肝脏细胞,传代后的细胞生长状况良好,证明建模成功并且模型比较稳定[9-10]。
本实验通过CCK8筛选甘草甜素的作用浓度,结果发现当作用浓度为1.2 mmol/L时,甘草甜素对细胞的促生长作用最大,因此选取1.2 mmol/L作为最佳浓度。而在本实验中,亚致死量的乙醇长期作用于肝脏细胞,导致肝细胞受损,细胞内的转氨酶泄露至培养基中,因此,本实验通过检测各组细胞上清液中ALT和AST泄漏量来反映肝脏功能[11-12]。结果发现,甘草甜素作用细胞后ALT和AST泄漏量明显降低(P<0.05),提示甘草甜素一定程度上能够减轻AFL的肝脏损伤。乙醇能够影响肝脏内TG的清除导致肝脏内大量TG蓄积进而形成脂肪肝[13]。本实验结果发现经甘草甜素治疗后TG明显降低(P<0.01),与动物实验结果基本一致[14]。同时本实验通过FCM检测了甘草甜素治疗后细胞的周期情况,发现细胞大部分阻滞在G0/G1期,提示甘草甜素对细胞周期影响不大,但是能够通过降低细胞凋亡率来抑制细胞的增殖。
PPAR-γ是核受体超家族成员中的一员,有研究发现PPAR-γ在肝脏、肾脏等多种高代谢组织中存在表达,可以通过氧化脂肪酸从而清除肝脏内的TG,减少体内TG的蓄积[15]。SREBPs是一种重要的脂质稳态调节因子,当细胞内固醇减少时,SREBPs与SCAP结合由内质网膜转移至高尔基体,调控脂质代谢基因的表达,导致体内脂质的沉积[16]。本研究发现,乙醇诱导后的AFL肝细胞PPAR-γ、SREBP-1、SCAP mRNA的表达明显升高(P<0.01),经甘草甜素治疗后3种mRNA的表达出现了明显下调(P<0.05),同时各组细胞中3种蛋白的表达与mRNA表达一致。结果提示乙醇可以通过调控PPAR-γ、SREBP-1、SCAP表达促进脂质的产生,与YOU等[17]的研究结果一致;甘草甜素可能通过下调PPAR-γ、SREBP-1、SCAP表达,从而抑制脂质的产生,但是具体的机制还需进一步的研究。
[1]李国春,黄新武,尹加珍,等.赶黄草提取物对大鼠酒精性脂肪肝的影响[J].中国临床药理学杂志,2016,32(2):163-165.
[2]PARK J H,LEE D H,PARK M S,et al.CCR5 deficiency exacerbates alcoholic fatty liver disease through pro-inflammatory cytokines and chemokines-induced hepatic inflammation[J].J Gastroenterol Hepatol,2016,32(6):1258-1264.
[3]王宏英,陈林.甘草甜素抑制小鼠慢性支气管炎模型肺组织中炎性细胞因子表达的作用机制[J].中国实验诊断学,2016,20(3):372-374.
[4]李永伟,卢建溪,杨宏志,等.甘草甜素对HepG2.2.15细胞株CCL20的影响[J].中国实验方剂学杂志,2011,17(1):148-150.
[5]刘协,顾呈华,胡启之,等.甘草甜素脂质
体对小鼠急性酒精性肝损伤的保护作用[J].中国临床康复,2004,8(36):8260-8261.
[6]张建,唐红敏,刘厚钰,等.甘草甜素多相脂质体对非酒精性脂肪肝肝功能的影响[J].肝脏,2003,8(3):30-32.
[7]马中春.甘草甜素对四氯化碳诱发大鼠肝脏损伤的作用及其机制[J].毒理学杂志,2005,19(3):250-251.
[8]李龙辉,李龙江,汤为学,等.甘利欣作用前后体外酒精性脂肪肝细胞模型甘油三酯水平变化及其可能作用机制[J].重庆医科大学学报,2010,35(2):179-182.
[9]张红锋,杨慧萍,王耀发.乙醇和软脂酸诱导的脂肪肝离体细胞模型[J].华东师范大学学报(自然科学版),2002(4):88-95.
[10]阮雪青.体外酒精性脂肪肝模型的建立和评价[D].杭州:浙江大学,2010.
[11]SHI D,ZHAN X,YU X,et al.Inhibiting CB1 receptors improves lipogenesis in an in vitro non-alcoholic fatty liver disease model[J].Lipids Health Dis,2014,13(1):173.
[12]KAPIL S,DUSEJA A,SHARMA B K,et al.Genetic polymorphism in CD14 gene,a co-receptor of TLR4 associated with non-alcoholic fatty liver disease[J].World J Gastroenterol,2016,22(42):9346-9355.
[13]BOONVISUT S,NAKAYAMA K,MAKISHIMA S,et al.Replication analysis of genetic association of the NCAN-CILP2 region with plasma lipid levels and non-alcoholic fatty liver disease in Asian and Pacific ethnic groups[J].Lipids Health Dis,2016,15(1):8.
[14]DA SILVA R P,KELLY K B,LEONARD K A,et al.Creatine reduces hepatic TG accumulation in hepatocytes by stimulating fatty acid oxidation[J].Biochim Biophys Acta,2014,1841(11):1639-1646.
[15]TOMIZAWA M,KAWANABE Y,SHINOZAKI F,et al.Elevated levels of alanine transaminase and triglycerides within normal limits are associated with fatty liver[J].Exp Ther Med,2014,8(3):759-762.
[16]SHI H,LUO J,ZHU J,et al.PPAR γ regulates genes involved in triacylglycerol synthesis and secretion in mammary gland epithelial cells of dairy goats[J].PPAR Res,2013,2013(6):310948.
[17]YOU M,JOGASURIA A,TAYLOR C,et al.Sirtuin 1 signaling and alcoholic fatty liver disease[J].Hepatobiliary Surg Nutr,2015,4(2):88-100.
