寄主植物对不同基因型麦长管蚜解毒酶活性的影响
2018-03-06李时荣葛朝虹刘德广崔晓宁黄贤亮
李时荣,葛朝虹,刘德广,崔晓宁,黄贤亮,王 达
(西北农林科技大学 植物保护学院,陕西杨凌 712100)
植物与植食性昆虫在长期的协同进化中形成关系密切的相互适应和防御机制[1]。一方面,植物次生物质(总酚、单宁酸和香豆素等)对昆虫取食行为、生长发育及繁殖可产生不利影响[2-3],甚至对昆虫产生毒杀作用,如芦竹碱对麦长管蚜[Sitobionavenae(Fabricius)]的毒杀作用随着浓度升高而增强[4]。另一方面,昆虫可通过忌避取食方式来应对植物防御,也可通过解毒代谢产物对植物产生一定适应性[2,5-6]。例如,麦长管蚜通过增强其体内羧酸酯酶 (Carboxylesterase,CarE)活性来提高对高含量吲哚生物碱小麦品种的适应性[7]。桃蚜[Myzuspersicae(Sulzer)]体内谷胱甘肽-S-转移酶 (Glutathione-S-transferase,GST)有助于其适应含不同次生物质的寄主植物[8]。CarE和GST是昆虫体内较重要的解毒酶系,对很多有毒次生物质及具有杀虫活性的植物提取物都具有解毒活性,在昆虫应对植物次生防御中起关键作用[9-13]。昆虫体内另一种关键酶是乙酰胆碱酯酶 (Acetylcholinesterase,AChE),在昆虫解毒代谢中同样起重要作用[14-15]。一些具有杀虫活性的植物次生物质能诱导昆虫体内AChE活性改变,如酚类物质能改变麦长管蚜体内AChE活性[16]。不同寄主植物次生代谢物质组成有很大差异,会通过昆虫取食对昆虫体内解毒酶活性产生不同的诱导效果,进而影响昆虫的寄主适应性[17]。有研究表明棉蚜[Aphisgossypii(Glover)]在棉花上的酯酶活力是花椒上的2.4倍,在石榴和木槿上的酯酶活力是花椒上的1.3~1.5倍[18]。苹果黄蚜(AphiscitricolaVander Goot) 的GST、AChE和CarE活性在不同寄主植物上强弱顺序均表现为苹果>梨树 > 李子 > 杏树[19]。此外,次生物质在不同植物中的含量也是影响昆虫解毒酶活性的重要因子。例如,单宁酸对麦长管蚜和棉铃虫[Helicoverpaarmigera(Hubner) ]的GST诱导作用具有明显的剂量效应[20],2-十三烷酮对棉蚜GST及槲皮素对棉蚜CarE的诱导作用也具有显著剂量效应[21]。
麦长管蚜是一种世界性谷物害虫,也是中国麦类作物上的优势种,主要为害小麦(TriticumaestivumL.)穗部和旗叶,导致小麦灌浆不足,给小麦生产造成严重危害[22-24]。麦长管蚜寄主范围广泛,主要危害小麦、大麦(HordeumvulgareL.)和燕麦(AvenasativaL.)等麦类作物,还取食黑麦草(LoliummultiflorumLam.)、鸭茅等多种禾本科杂草[25]。研究表明,寄主植物所含次生物质能显著影响麦长管蚜解毒酶活性,如丁布能降低麦长管蚜GST活性[26];麦长管蚜CarE活性随着吲哚生物碱含量升高而增强,呈正相关[27]。不同基因型麦长管蚜在小麦、大麦、燕麦和黑麦草上的生物学特性、寄主适应性均存在差异,甚至会产生一定程度的寄主专化性[28-29]。植食性昆虫对寄主植物的适应性,在一定程度上取决于其对寄主植物次生防御的克服力[30]。目前,不同基因型麦长管蚜在多个寄主植物上的适应性与解毒代谢的关系仍不清晰。本研究测试 4 种寄主植物对 8 种基因型麦长管蚜体内 3 种解毒酶的诱导作用,对探讨蚜虫的寄主适应性及发展科学的生态调控策略有重要意义。
1 材料与方法
1.1 试验材料
供试虫源:2014年4月采自陕西杨凌周边小麦田的麦长管蚜,分单克隆系在小麦‘矮抗58’上饲养。小麦幼苗培育在塑料杯中,用圆筒形透明塑胶片(d=6 cm,h=15 cm)罩住,圆筒顶部粘有60目的纱网。饲养温度为(20±1) ℃,光周期为L∶D =16 h∶8 h。试验中通过6个微卫星位点对所采蚜虫基因型进行检测[31](表1),选取其中8个不同基因型蚜虫用于试验。
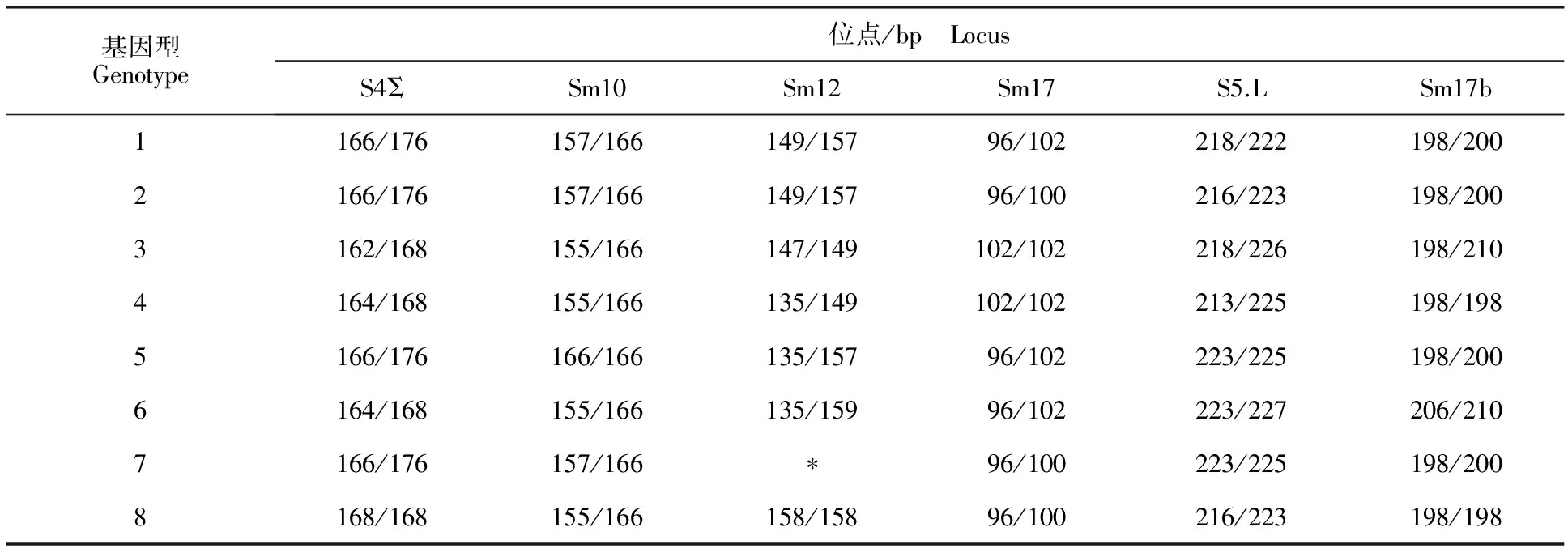
表1 8个麦长管蚜基因型各微卫星位点的等位基因长度Table 1 Allele sizes of microsatellite loci for eight genotypes of Sitobion avenae
注:“*”表示该位点等位基因缺失。
Note: “*” indicates the loss of microsatellite alleles.
供试植物:小麦(‘矮抗58’)、大麦(‘西安91-2’)、 燕麦(‘sandle’)和黑麦草(LoliummultiflorumLam. )。
主要仪器:紫外可见分光光度计(UV-1100型,上海美谱达仪器有限公司)、高速冷冻离心机(TGL16型,上海安亭科学仪器厂)。
主要试剂:α-醋酸萘酯(α-NA) 和碘化硫代乙酰胆碱(Asch)(分析纯级,试剂一厂,上海);二硫双对硝基苯甲酸 (DTNB)(化学纯级,试剂三厂,上海);1-氯-2,4-二硝基苯(CDNB) 和毒扁豆碱(Eserine)(分析纯级,Sigma 公司,美国)。
1.2 方 法
1.2.1 酶原液的提取及蛋白质量浓度测定 选取分别在小麦、大麦、燕麦和黑麦草幼苗上饲养的1代和3代无翅成蚜作为供试蚜虫。每处理设3~6个重复,每个重复3 mg麦长管蚜。把蚜虫放入1 mL磷酸缓冲液中,在冰浴条件下匀浆处理,匀浆液4 ℃ 离心,取上清液作为酶原液。根据所测酶的种类选用不同浓度磷酸缓冲液及离心条件[32]:CarE(磷酸缓冲液,0.04 mol·L-1、pH 7.0;10 000 r·min-1离心10 min);GST(磷酸缓冲液,66 mmol·L-1、pH 7.0;9 000 r·min-1离心20 min);AChE(磷酸缓冲液,0.1 mol·L-1、pH 7.4; 9 000 r·min-1离心20 min)。酶原液的蛋白质质量浓度根据 Bradford[33]的方法测定,取0.1 mL 酶原液加入5 mL考马斯亮蓝溶液,充分混匀后,静置2 min,测定OD595 nm值。以牛血清白蛋白为标准蛋白,通过标准曲线计算酶原液中蛋白质的质量浓度。
1.2.2 酶活性测定 参照吕朝军等[19]的方法优化后测定CarE活性。反应总体积6 mL,其中包括5 mL 浓度为3×10-4mol·L-1的α-醋酸萘酯(内含10-4mol·L-1毒扁豆碱)、0.5 mL磷酸缓冲液(0.04 mol·L-1,pH 7.0)和0.5 mL酶液。充分混匀后,在30 ℃ 水浴条件下放置30 min。随后,立即加入1 mL显色剂(坚固蓝B盐与SDS按体积比2∶5配制),混匀后室温静置30 min,用紫外分光光度计测定OD600 nm值。以不同浓度的α-萘酚制作标准曲线,根据制作的标准曲线和酶原蛋白质量浓度,以每分钟每毫克蛋白与底物反应产生产物的摩尔数表示酶活性。计算公式: 酶活力(μmol·mg-1·min-1) = 产物生成量(μmol)/ [ 反应酶液量(mL)× 酶源蛋白质量浓度(mg·mL-1)× 反应时间(min)],下同。
参照刘玉坤等[34]的方法优化后测定GST活性。反应总体积为3 mL,其中包括2.1 mL的磷酸缓冲液(66 mmol·L-1,pH 7.0)、0.3 mL的谷胱甘肽(50 mmol·L-1)、0.1 mL的CDNB(0.03 mol·L-1)及0.5 mL酶液。充分混匀后,在340 nm下测定2 min内OD的变化值。
参照Wu等[32]的方法优化后测定AChE活性。在玻璃试管中依次加入1.8 mL的磷酸缓冲液(0.1 mol·L-1,pH 7.4)、0.1 mL碘化硫代乙酰胆碱(Asch)与二硫双对硝基苯甲酸(DTNB)的混合溶液(按体积比1∶2配制)和0.8 mL酶液。将上述试管中的溶液充分混匀后,在27 ℃ 水浴条件下放置15 min后,立即加入0.5 mL毒扁碱溶液(1×10-3mol·L-1),充分混匀后,用紫外分光光度计测定OD412 nm值。以不同浓度的谷胱甘肽制作标准曲线。
1.2.3 数据分析 所有数据均用分析软件SAS (ver. 8.0)进行分析,若数据不符合正态分布和方差齐性,对其进行对数转换,符合检验条件后进行后续分析。麦长管蚜解毒酶活性的方差来源分析采用嵌套方差分析。同种寄主不同代数之间CarE和GST差异分析采用Student’st-test进行比较。同种基因型麦长管蚜在不同寄主上的酶活性和同种寄主上不同基因型麦长管蚜的酶活性数据采用单因素方差分析,然后用Tukey检验进行多重比较,数据用“平均值±标准误”表示。
2 结果与分析
2.1 麦长管蚜解毒酶活性诱导的方差来源分析
寄主植物(简称寄主)、繁衍世代数(简称世代)和蚜虫基因型(简称基因型)对麦长管蚜AChE、 CarE和 GST酶活力都有影响(表2)。寄主对各解毒酶比活力总方差的贡献率较小,但其作用达到显著水平。世代或寄主与世代的交互作用对CarE和GST酶活力的影响达到极显著水平。世代对CarE酶活力总方差的贡献率为4.43%。寄主与世代的交互作用对GST酶比活力总方差的贡献率为10.24%。基因型对AChE、CarE和GST酶比活力总方差的贡献率在各因子中最高,分别是65.08%、60.81%和46.45%。
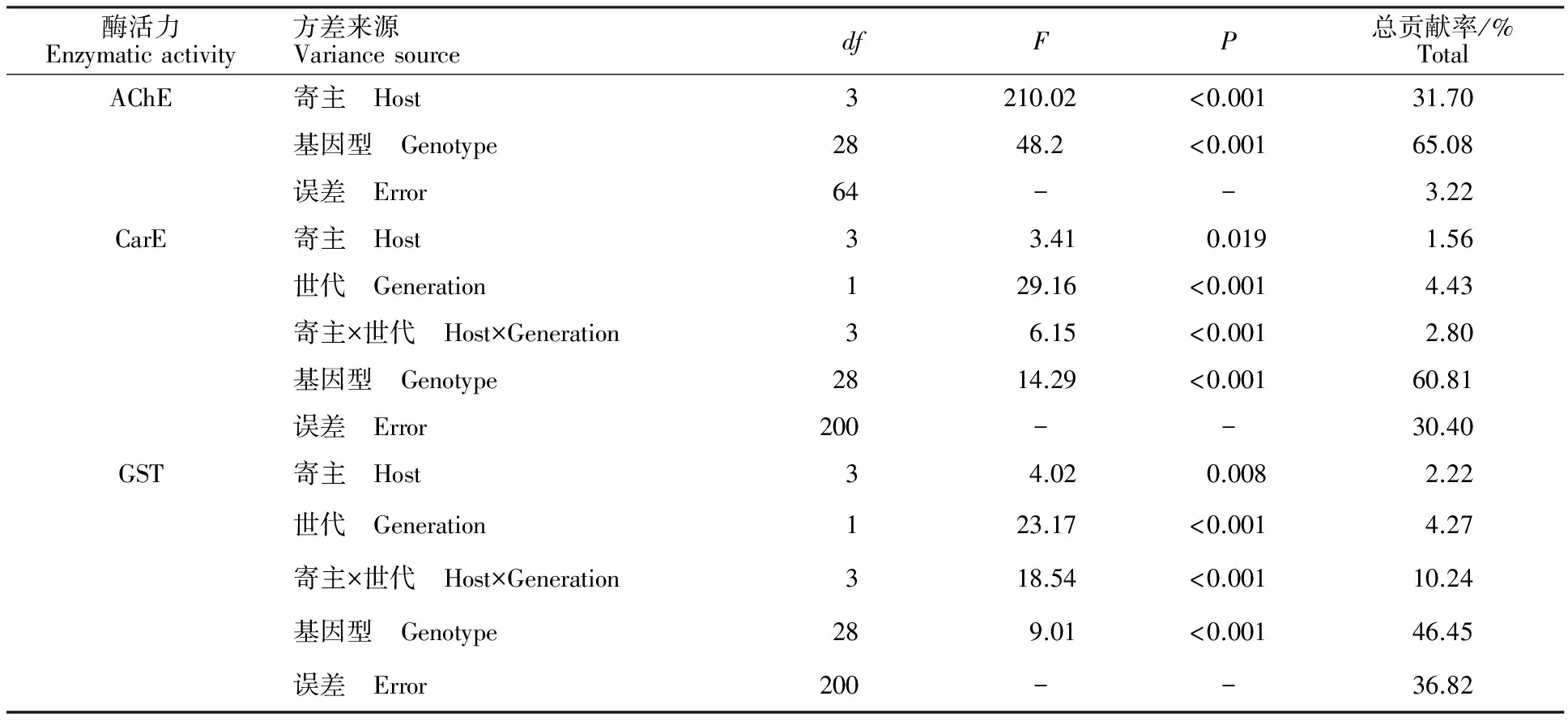
表2 麦长管蚜AChE、 CarE和 GST活性的方差来源Table 2 Sources of variance for AChE,CarE,GST activities in S.avenae
2.2 寄主和世代对解毒酶活性的影响
麦长管蚜在各供试寄主植物上取食1代后,大麦上蚜虫的AChE活性较高(图1),且与燕麦、黑麦草差异极显著(F=6.65;df=3, 92;P<0.001),但小麦、燕麦和黑麦草的AChE活性差异不显著。
麦长管蚜羧酸酯酶 (CarE)(图2-A) 和谷胱甘肽-S-转移酶 (GST) (图2-B) 的活性在不同寄主之间和世代之间都存在差异。分别比较一代和三代麦长管蚜CarE活性在四种供试寄主植物之间差异不显著。从一代试虫GST的活性来看,取食大麦的试虫较高,取食黑麦草的较低,且两者之间存在极显著差异(F=4.23;df=3,92;P<0.001)。从三代麦长管蚜GST的活性来看, 黑麦草的诱导效果显著高于大麦和小麦(F=7.54;df=3,136;P<0.001)。

柱上不同字母表示差异显著(P<0.05) Different letters above bars indicate significant differences(P<0.05)
图1不同寄主植物上1代麦长管蚜AChE的活性
Fig.1AChEactivitiesoffirstgenerationofS.avenaeondifferenthosts
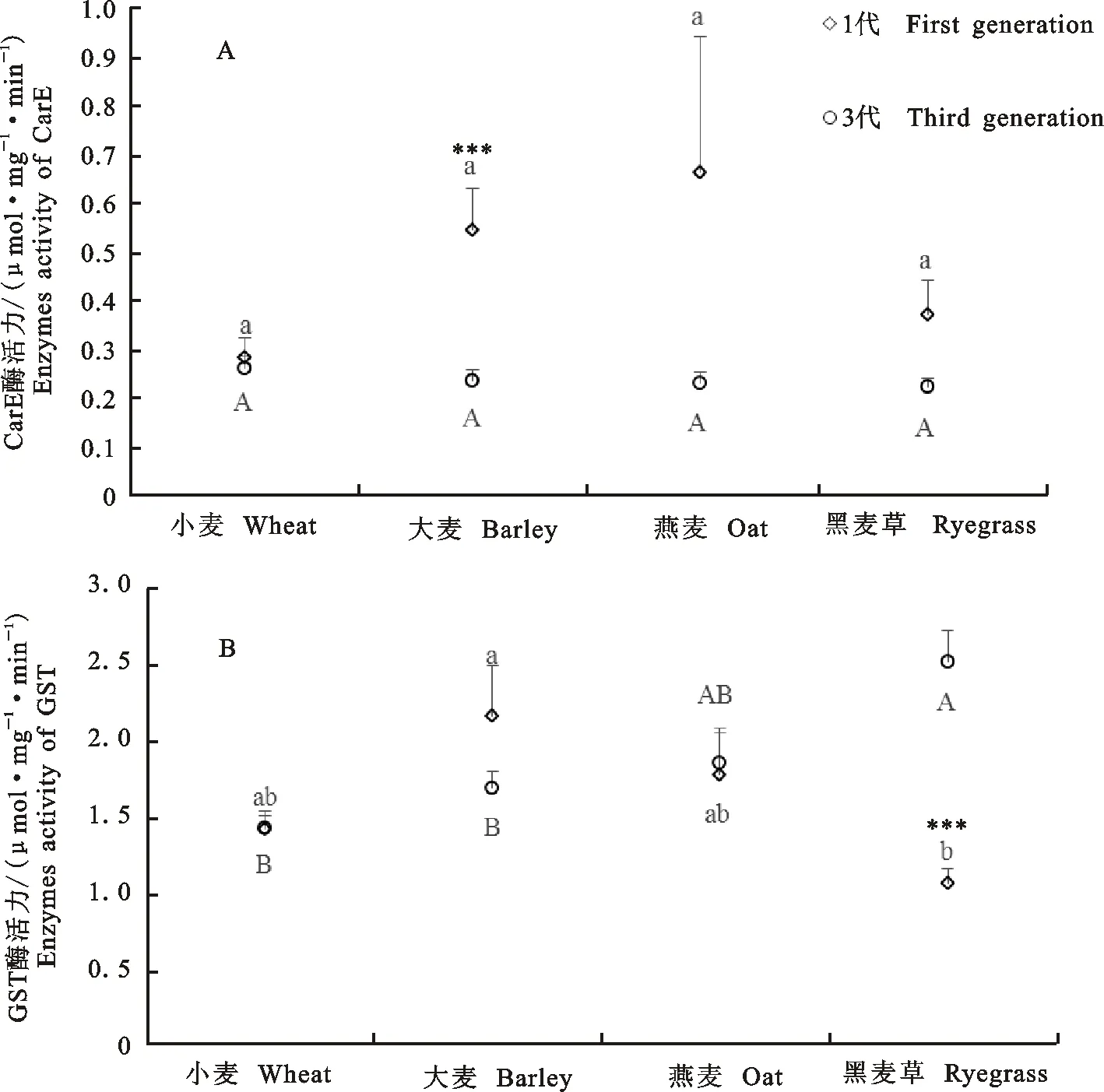
不同小写字母表示1代的差异显著(P<0.05);不同大写字母表示3代的差异显著(P<0.05);“***”表示不同世代间差异极显著(P<0.001) 。
Different lower and lowercase letters indicate significant differences for first and third generation(P<0.05),respectively; “***”indicates significant differences(P<0.001) between generations.
图2不同寄主植物上1代和3代麦长管蚜CarE(A)、GST(B)的活性
Fig.2CarEandGSTactivitiesoffirstandthirdgenerationsofS.avenaeondifferenthostplants
四种供试寄主植物上,一代试虫CarE的活性高于三代试虫,但只有大麦对该酶活性的诱导效果在一代和三代之间存在显著差异(t= 4.17,P<0.001)。黑麦草对三代试虫GST的活性的诱导效果显著高于一代试虫(t=5.90,P<0.001), 其它寄主对该酶活性的诱导效果在一代和三代之间差异不显著。
2.3 寄主和基因型对AChE活性的影响
同一基因型麦长管蚜取食不同寄主植物后,其体内AChE活性在各寄主间存在显著差异(表3)。基因型1(F=70.52;df=3,8;P<0.001)、2(F=114.35;df=3,8;P<0.001)、3(F=179.59;df=3,8;P<0.001)和8(F=50.51;df=3,8;P<0.001)在大麦上的活性都显著高于其他供试寄主;基因型4在黑麦草上的活性显著高于小麦(F=4.09;df=3,8;P=0.049 5);基因型5在大麦或小麦上的活性显著高于黑麦草(F=13.31;df=3,8;P=0.001 8);基因型6在小麦上的活性最高(F=63.79;df=3,8;P<0.001);基因型7在大麦、燕麦和黑麦草上的活性都显著高于小麦(F=31.07;df=3,8;P<0.001)。
不同基因型麦长管蚜取食同种寄主植物后,其体内AChE活性在各基因型间存在明显差异(表3)。取食小麦后,基因型3蚜虫体内的活性较高,基因型4和7较低,其他基因型居中(F=39.09;df=7,16;P<0.001);取食大麦后,基因型3体内的活性最高(F=99.77;df=7,16;P<0.001);燕麦对基因型3、4、5、6、7体内该酶活性的诱导效果较好(F=7.20;df=7,16;P<0.001)。取食黑麦草后,基因型7体内的活性最高(F=29.43;df=7,16;P<0.001)。

表3 4种寄主植物上不同基因型麦长管蚜AChE的活性Table 3 AChE activities among different genotypic aphids(S.avenae) on four kinds of hosts
注:同列数据不同小写字母表示差异显著(P<0.05);同行数据不同大写字母表示差异显著(P<0.05);下同。
Note: Different lowercase letters indicate significant differences in the same column(P<0.05); different uppercase letters indicate significant differences in the same row(P<0.05);the same below.
2.4 寄主和基因型对CarE活性的影响
同一基因型麦长管蚜在各供试寄主上取食1代后,其体内CarE活性的差异如表4 所示。基因型1在燕麦上的活性显著低于其他供试寄主(F=64.11;df=3,8;P<0.001);基因型3在燕麦上的活性显著高于其他供试寄主(F=274.02;df=3,8;P<0.001);基因型2(F=150.86;df=3,8;P<0.001)、4(F=4.76;df=3,8;P=0.034 5)、5(F=25.88;df=3,8;P<0.001)、6(F=24.52;df=3,8;P<0.001)和8(F=5.83;df=3,8;P=0.02)体内CarE活性都是大麦诱导效果较为显著;基因型3和5在大麦和黑麦草上的活性显著高于小麦;基因型7的活性在小麦上显著高于黑麦草(F=7.39;df=3,8;P=0.01),其他供试寄主间差异不显著。
同一基因型麦长管蚜在各供试寄主上取食3代后,其体内CarE活性在各寄主间存在明显差异(表4)。基因型1(F=4.16;df=3,19;P=0.02)、2(F=35.10;df=3,15;P<0.001)、5(F=38.06;df=3,14;P<0.001)、7(F=31.77;df=3,8;P<0.001)和8(F=1 117.33;df=3,8;P<0.001)在燕麦上的活性显著高于黑麦草,基因型3(F=52.51;df=3,20;P<0.001)和6(F=4.27;df=3,16;P=0.02)的活性与之相反;基因型2和3在小麦上的活性显著高于燕麦和黑麦草;基因型4的活性在各供试寄主间无显著差异; 基因型5和8在燕麦上的活性显著高于小麦和黑麦草。
不同基因型麦长管蚜取食同种寄主植物1代或3代后,其体内CarE活性的差异如表4所示。不同基因型麦长管蚜取食同种寄主1代后,大麦(F=43.10;df=7,16;P<0.001)和黑麦草(F=167.98;df=7,16;P<0.001)对基因型3体内该酶活性的诱导效果最为显著,燕麦(F=5.96;df=7,16;P=0.001 5)次之;小麦对基因型1和6的诱导效果最好(F=115.36;df=7,16;P<0.001)。麦长管蚜在各供试寄主取食3代后,小麦(F=155.11;df=7,31;P<0.001)和大麦(F=98.70;df=7,29;P<0.001)对基因型3体内该酶活性的诱导效果最为显著;燕麦对基因型1和8的诱导效果显著(F=46.72;df=7,21;P<0.001);黑麦草对基因型1、3、6和8的诱导效果显著(F=141.09;df=7,27;P<0.001)。
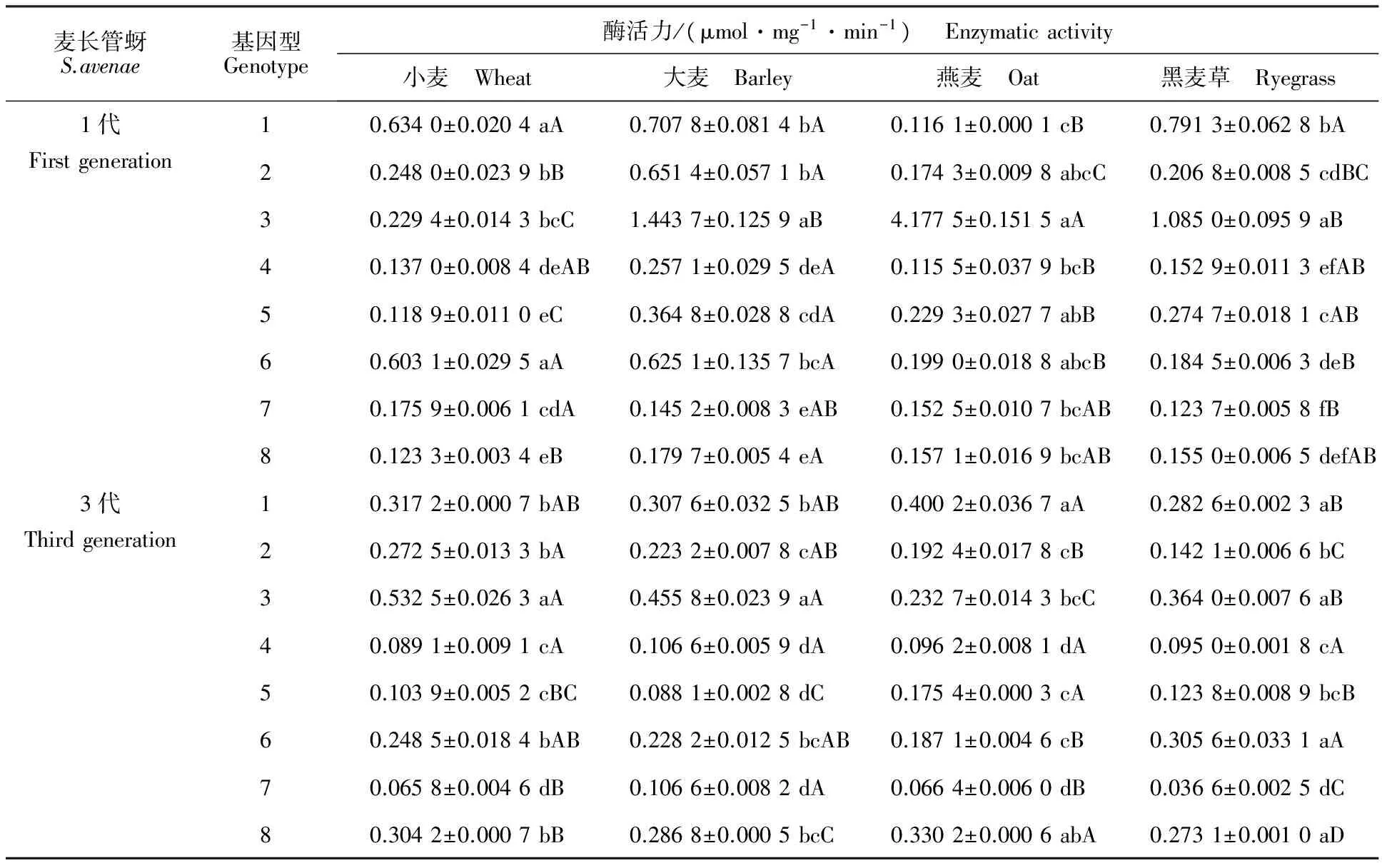
表4 4 种寄主植物上1 代和3 代麦长管蚜CarE活性在不同基因型之间的比较Table 4 Comparison of CarE activities among different genotypic S.avenae on four kinds of hosts
2.5 寄主和基因型对GST活性的影响
同一基因型麦长管蚜在各供试寄主上取食1代后,其体内GST活性在各寄主间的差异如表5所示。基因型1(F=173.61;df=3,8;P<0.001)和5(F=145.83;df=3,8;P<0.001)在大麦上的活性显著高于其他供试寄主;基因型2在黑麦草上的活性显著低于其他供试寄主(F=12.20;df=3,8;P=0.002 4);基因型3(F=52.29;df=3,8;P<0.001)和6(F=31.27;df=3,8;P<0.001)在大麦和小麦上的活性较高;基因型7在燕麦上的活性最高(F=249.65;df=3,8;P<0.001);基因型8在小麦上的活性较高(F=12.43;df=3,8;P=0.002);基因型4的活性在各供试寄主间差异不显著。
同一基因型麦长管蚜在各供试寄主上取食3代后,其体内GST活性在各寄主间存在显著差异(表5)。基因型4(F=86.02;df=3,8;P<0.001)、7(F=43.12;df=3,8;P<0.001)、8(F=47.76;df=3,8;P<0.001)在大麦上的活性显著高于其他供试寄主;基因型1(F=168.24;df=3,20;P<0.001)、5(F=51.50;df=3,13;P<0.001)和6(F=23.75;df=3,16;P<0.001)在黑麦草上的活性最高;基因型2(F=424.65;df=3,15;P<0.001)和3(F=3.85;df=3,20;P=0.025)在燕麦上的活性较高。
不同基因型麦长管蚜取食同种寄主植物1代或3代后,其体内该酶活性的差异如表5所示。不同基因型麦长管蚜取食同种寄主1代后,小麦对基因型3体内酶活性的诱导效果较好(F=23.32;df=7,16;P<0.001);大麦对基因型1的诱导效果最好(F=140.47;df=7,16;P<0.001);燕麦对基因型7的诱导效果最强(F=96.63;df=7,16;P<0.001);黑麦草对基因型1和7的诱导效果显著(F=118.50;df=7,16;P<0.001)。麦长管蚜取食同种寄主3代后,小麦对基因型1、3和4的诱导效果显著(F=147.69;df=7,31;P<0.001);大麦对基因型1、4和8的诱导效果显著(F=75.60;df=7,30;P<0.001);燕麦对基因型2的诱导效果最好(F=74.93;df=7,20;P<0.001);黑麦草对基因型1和2的诱导效果显著(F=129.38;df=7,27;P<0.001)。
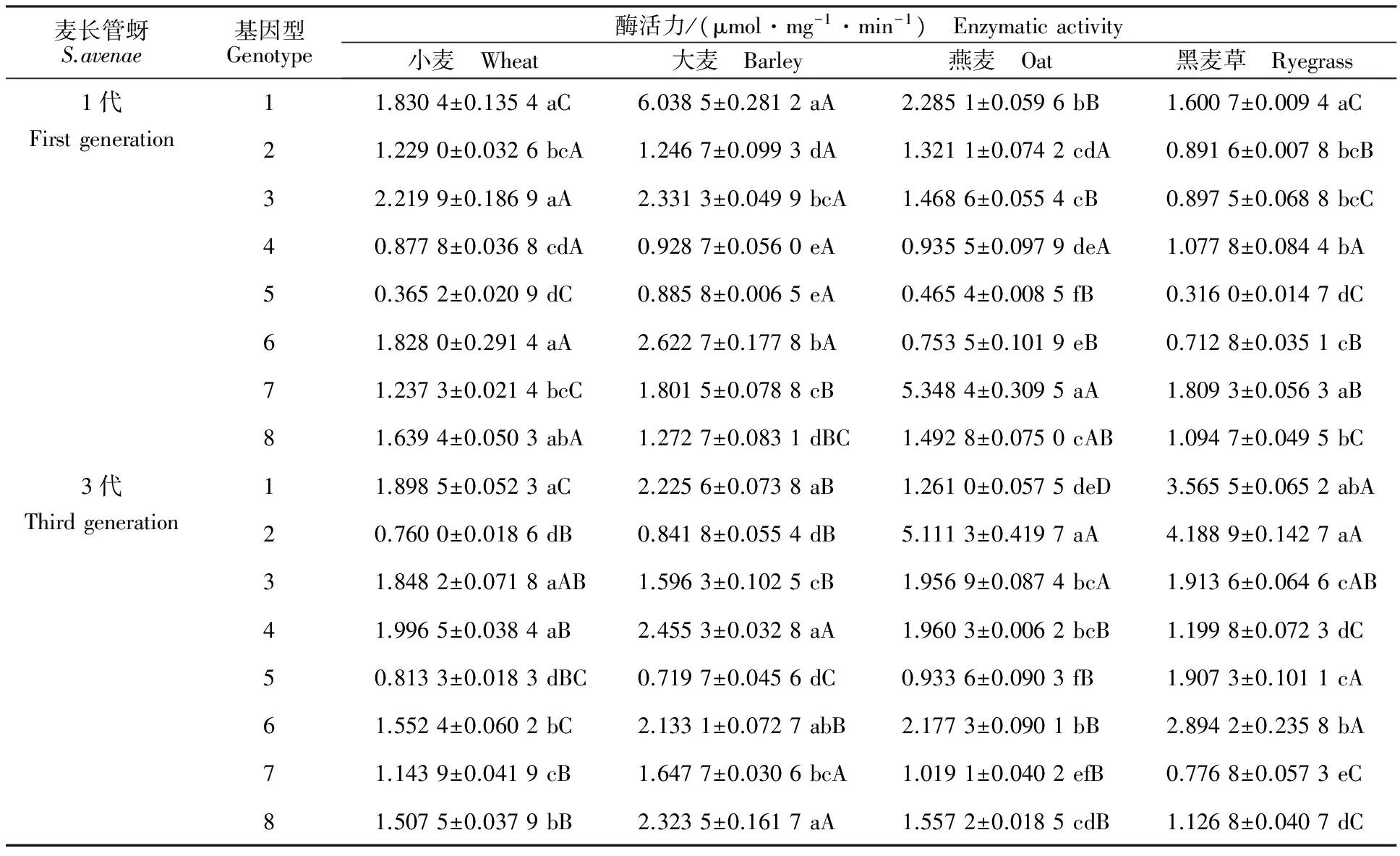
表5 4 种寄主植物上1代和3代麦长管蚜GST在不同基因型之间的比较Table 5 Comparison of GST activities among different genotypic S.avenae on four kinds of hosts
3 讨 论
麦类作物含有酚类、生物碱、氧肟酸和非蛋白氨基酸等多种植物次生化合物[35],它们在这些作物抵御各种害虫的过程中能发挥重要作用。如抗蚜小麦品种中单宁、(甲氧基)酚酸类、阿魏酸等酚类化合物的含量明显高于感蚜品种[36-37]。本研究中,大麦上的 1 代麦长管蚜AChE活性高于其他寄主。1 代试虫CarE活性在燕麦上较高,在小麦上较低;而 GST的活性在大麦上较高,在黑麦草上较低。已有研究表明,同取食低抗小麦品种相比,取食中度抗蚜小麦品种的麦长管蚜表现出较高的GST活性[38]。取食抗性小麦品种的蚜虫体内CarE活性高于取食感性品种[39-40]。麦长管蚜取食含不同浓度氧肟酸的寄主植物后,其GST 的活性随着氧肟酸浓度的增加而增加,但其他解毒酶系如CarE等并没有被诱导[41-42],表明CarE和GST参与麦长管蚜应对特定寄主植物的次生防御。本研究中,除GST和CarE外,AChE也参与该蚜虫应对寄主植物的防御反应,但它们的功能可能存在一定区别。因此,这三大酶系在麦长管蚜适应各种寄主植物的过程中能发挥关键作用,但各个酶系应对特定寄主植物次生物质的具体功能需进一步探讨。
昆虫解毒酶活性诱导表达不仅受寄主植物的影响,还可能受到昆虫遗传背景的影响。本研究结果表明,黑麦草对基因型7蚜虫体内AChE活性的诱导效果显著高于其他基因型;大麦或黑麦草对 1 代基因型3蚜虫体内CarE活性的诱导作用显著强于其他基因型,而小麦对基因型1和6的诱导效果较显著;小麦上1代基因型1、3和6的GST活性较高,大麦上基因型1的活性最高,燕麦对基因型7的诱导作用最强,黑麦草上基因型1和7 的活性较高。因此,同种寄主植物对不同基因型蚜虫体内AChE、CarE或GST的诱导作用存在显著差异。一些基因型在特定寄主上CarE或GST的活性很低,这可能是由于该寄主植物对这些基因型蚜虫取食产生一定的忌避作用[43]。但有研究[44]显示,麦长管蚜取食含不同氧肟酸浓度的寄主植物后,蚜虫的遗传背景对其体内GST活性没有影响,其原因可能是该研究中采用的蚜虫基因型数量较少,且采样地蚜虫种群分化程度较低。本研究结果表明,基因型和寄主植物间的互作也会影响麦长管蚜体内解毒酶活性,增加更多基因型蚜虫,有助于进一步探讨遗传背景对麦长管蚜解毒酶活性的影响。
本研究结果表明,麦长管蚜CarE(图2-A) 和GST)(图2-B) 的活性在世代间存在一定差异。Loayza-Muro 等[45]通过研究小麦(含氧肟酸)和燕麦(不含氧肟酸)上不同世代麦长管蚜GST活性,发现该酶活性随着世代数增加而增加,这与本研究结果一致。说明麦长管蚜可能通过一些解毒酶(如GST)活性的增加来提高对特定寄主植物(如黑麦草)的适应性,但该蚜虫GST对大麦作用较小。本研究中CarE和GST的差异反映不同酶系在具体功能和可塑性等方面存在差异,并且这些酶系间可能发生一定交互作用。
综上所述,寄主植物、蚜虫世代和基因型都能对麦长管蚜体内解毒酶(如CarE和GST等)活性变化有极显著的影响,而且寄主植物与蚜虫世代之间的交互作用也达到极显著水平。麦长管蚜在抵御植物次生物质和适应各种寄主植物的过程中,其体内解毒酶能发挥重要作用。深入探讨各解毒酶系对特定植物次生物质的代谢作用,并弄清酶系相关基因的功能,将有助于采用现代分子生物学手段来保持和提高害虫对寄主次生物质的敏感性,探明次生物质对昆虫解毒酶系的诱导调控机制,进而揭示昆虫与植物的协同进化关系。
Reference:
[1] 郝 娅,娄永根.虫害诱导植物挥发物的研究进展[J].长江大学学报,2013,10(11):12-15.
HAO Y,LOU Y G.The research progress of pest inducing plant volatiles[J].JournalofYangtzeUniversity,2013,10(11):12-15.
[2] 陈澄宇,康志娇,史雪岩,等.昆虫对植物次生物质的代谢适应机制及其对昆虫抗药性的意义[J].昆虫学报,2015,58(10):1126-1139.
CHEN CH Y,KANG ZH J,SHI X Y,etal.Metabolic adaptation mechanisms of insects to plant secondary metabolites and their implications for insecticide resistance of insects[J].ActaEntomologicaSinica,2015,58(10):1126-1139.
[3] 陈巨莲,倪汉祥,孙京瑞,等.小麦几种主要次生物质对麦长管蚜几种酶活力的影响[J].昆虫学报,2003,46(2):144-149.
CHEN J L,NI H X,SUN J R,etal.Effects of major secondary chemicals of wheat plants on enzyme activity inSitobionavenae[J].ActaEntomologicaSinica,2003,46(2):144-149.
[4] CAI Q N,HAN Y,CAO Y Z,etal.Detoxification of gramine by the cereal aphidSitobionavenae[J].JournalofChemicalEcology,2009,35:320-325.
[5] 董钧锋,张继红,王琛柱.植物次生物质对烟青虫和棉铃虫食物利用及中肠解毒酶活性的影响[J].昆虫学报,2002,45(3):296-300.
DONG J F,ZHANG J H,WANG CH ZH.Effects of plant allelochemicals on nutritional utilization and detoxication enzyme activities in twoHelicoverpaspecies[J].ActaEntomologicaSinica,2002,45(3):296-300.
[6] LINDROTH R L.Chemical ecology of the luna moth:effects of host plant on detoxification enzyme activity[J].JournalofChemicalEcology,1989,15(7):2019-2029.
[7] CAI Q N,ZHANG Q W,CHEO M.Contribution of indole alkaloids toSitobionavenae(F.) resistance in wheat[J].JournalofAppliedEntomology,2004,128(8):517-521.
[8] FRANCIS F,VANHAELEN N,HAUBRUGE E.Glutathione S-transferases in the adaptation to plant secondary metabolites in theMyzuspersicaeaphid[J].ArchivesofInsectBiochemicalandPhysiology,2005,58(3):166-174.
[9] 汪英英,胡兆农.杠柳新苷P和E对粘虫和小地老虎中肠3种解毒酶的影响[J].西北农业学报,2016,25(6):939-944.
WANG Y Y,HU ZH N.Effects of periplocoside P and E fromPeriplocasepiumon activities of three detoxification enzymes in midgut ofMythimnaseparateandAgrotisypsilon(Lepidoptera:Noctuidae) [J].ActaAgriculturaeBoreali-occidentalisSinica,2016,25(6):939-944.
[10] 尹显慧,吴青君,李学锋,等.多杀菌素亚致死浓度对小菜蛾解毒酶系活力的影响[J].农药学学报,2008,10(1):28-34.
YIN X H,WU Q J,LI X F,etal.Effect of sublethal concentrations of spinosad on the activities of detoxifying enzymes in the larvae of diamondback mothPlutellaxylostell[J].ChineseJournalofPesticideScience,2008,10(1):28-34.
[11] DESPRES L,DAVID J,GALLET C.The evolutionary ecology of insect resistance to plant chemicals[J].TrendsinEcologyandEvolution,2007,22(6):298-307.
[12] LEON C T.Induction of detoxication enzymes in insects[J].AnnualReviewofEntomology,1984,29(1):71-88.
[13] PETRE H.Insect cytochromes P450:topology of structural elements predicted to govern catalytic versatility[J].JournalofInorganicBiochemistry,2011,105(10):1354-1364.
[14] 王瑞龙,孙玉林,梁笑婷,等.6 种植物次生物质对斜纹夜蛾解毒酶活性的影响[J].生态学报,2012,32(16) :5191-5198.
WANG R L,SUN Y L,LIANG X T,etal.Effects of 6 kinds of plant secondary metabolites on detoxification enzyme activity ofSpodopteralitura[J].ActaEcologicaSinica,2012,32(16):5191-5198.
[15] 燕赛英,杜孟芳,尹新明,等.烟蚜茧蜂寄生对麦二叉蚜体内解毒酶和保护酶活性的影响[J].河南农业大学学报,2015,49(4):488-493.
YAN S Y,DU M F,YIN X M,etal.Effect of parasitism byAphidiusgifuensison the activity of protective and detoxification enzymes inSchizaphisgraminum[J].JournalofHenanAgriculturalUniversity,2015,49(4):488-493.
[16] 李贤庆,郭线茹,曹雅忠.不同小麦品种对麦蚜抗性机制研究进展[C]∥成卓敏.农业生物灾害预防与控制研究.北京:中国农业科学技术出版社,2006:394-398.
LI X Q,GUO X R,CAO Y ZH.Development of mechanism of resistance of grain aphids to various wheat[C]∥CHENG ZH M.Agricultural Biological Disaster Prevention and Control Research.Beijing:China Agricultural Science and Technology Press,2006:394-398.
[17] 尹 飞,陈焕瑜,李振宇,等.取食不同寄主植物小菜蛾对氯虫苯甲酰胺敏感性及体内解毒酶活性的变化[J].应用昆虫学报,2013,50(5):1335-1340.
YIN F,CHEN H Y,LI ZH Y,etal.Changes in susceptibility to chlorantraniliprole and detoxification enzymes ofPlutellaxylostellafeeding on different host plants[J].ChineseJournalofAppliedEntomology,2013,50(5):1335-1340.
[18] 冯国蕾,赵章武,李 梅,等.不同寄主植物与棉蚜酯酶活性的关系[J].昆虫学报,2001,44(3):304-310.
FENG G L,ZHAO ZH W,LI M,etal.Relationship between esterase activities of the cotton aphid(Aphisgossypii) and overwintering host plants[J].ActaEntomologicaSinica,2001,44(3):304-310.
[19] 吕朝军,韩巨才,刘慧平,等.寄主植物对苹果黄蚜药剂敏感性及解毒酶活性的影响[J].植物保护学报,2007,34(5):534-538.
LÜ CH J,HAN J C,LIU H P,etal.Influence of host plants to detoxification enzymes and susceptibilities to insecticides onAphiscitricoiavon der Goot[J].ActaPhytophylacicaSinica,2007,34(5):534-538.
[20] 陈凤菊,高希武,雷明庆,等.单宁酸对棉铃虫谷胱甘肽 S-转移酶的影响[J].2003,46(6):684-690.
CHEN F J,GAO X W,LEI M Q,etal.Effect of tannic acid on glutathione-S-transferases inHelicoverpaarmigera(Hubner) [J].ActaEntomologicaSinica,2003,46(6):684-690.
[21] 汤 方,梁 沛,高希武.2-十三烷酮和槲皮素诱导棉铃虫谷胱甘肽S-转移酶组织特异性表达[J].自然科学进展,2005,15(7):805-810.
TANG F,LIANG P,GAO X W.2-tridecane ketone and quercetin induce tissue specific expression of glutathione S-transferase inHelicoverpaarmigera(Hubner)[J].ExhibitionofNaturalScience,2005,15(7):805-810.
[22] GAO S X ,LIU D G.Differential performance ofSitobionavenae(Hemiptera:Aphididae) clones from wheat and barley with implications for its management through alternative cultural practices[J].JournalofEconomicEntomology,2013,106(3):1294-1301.
[23] 张方梅,李祥瑞,张云慧,等.麦长管蚜有翅型与无翅型外部形态比较研究[J].植物保护,2015,41(4):56-62.
ZHANG F M,LI X R,ZHANG Y H,etal.Morphological examination of winged and wingless forms of the grain aphidSitobionavenae[J].PlantProtection,2015,41(4):56-62.
[24] MULLER C B,WILLIAMS I S,HARDIE J.The role of nutrition,crowding and interspecific interactions in the development of winged aphids[J].EcologicalEntomology,2001,26(3):330-340.
[25] 胡国强,李晓凤,王长娜.麦长管蚜的研究[J].安徽农业科学,2012,40(18):9748-9750.
HU G Q,LI X F,WANG CH N.The study of grain aphid [J].JournalofAnhuiAgriculture,2012,40(18):9748-9750.
[26] LESZCZYNAKI B,DIXO A F G.Resistance of cereals to aphids:the interaction between hydroxamic acids and glutathione S-transferase in the grain AphidSitobionavenae(F.)(Hom.Aphididae) [J].JournalApplication,Entomology,1992,113(1/5):61-67.
[27] 蔡青年,张青文,高希武,等.小麦体内次生物质对麦蚜的抗性作用研究[J].中国农业科学,2003,36(8):910-915.
CAI Q N,ZHANG Q W,GAO X W,etal.Effect of the secondary substances on wheat resistance toSitobionavenae(F.) [J].ScientiaAgriculturaSinica,2003,36(8):910-915.
[28] 高素霞,黄贤亮,刘德广,等.不同寄主植物上麦长管蚜生活史的比较[J].西北农林科技大学学报(自然科学版),2014,42(10):45-50.
GAO S X,HUANG X L,LIU D G,etal.Life-history comparison ofSitobionavenaeon different host plants[J].JournalofNorthwestA&FUniversity(NaturalScienceEdition),2014,42(10):45-50.
[29] GAO S X,LIU D G,CHEN H,etal.Fitness traits and underlying genetic variation related to host plant specialization in the aphidSitobionavenae[J].InsectScience,2014,21(3):352-362.
[30] 高希武,董向丽,赵 颖,等.槲皮素对棉铃虫体内一些解毒酶系和靶标酶的诱导作用[J].农药学学报,1999,1(3):56-60.
GAO X W,DONG X L,ZHAO Y,etal.Induction of carboxylesterase,glutathione S-transferase and acetylcholinesterase by quercetin inHelicoverpaarmigera[J].ChineseJournalofPesticideScience,1999,1(3):56-60.
[31] HUANG X L,LIU D G,WANG D,etal.Molecular and quantitative genetic differentiation inSitobionavenaepopulations from both sides of the Qinling mountains[J].PlosOne,2015,10(3):1-15.
[32] WU G,MIYATA T.Susceptibilities to methamidophos and enzymatic characteristics in 18 species of pest insects and their natural enemies in crucifer vegetable crops[J].PesticideBiochemistryandPhysiology,2005,82(1):79-93.
[33] BRADFORD M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J].AnalyticalBiochemistry,1976,72(1/2):248-254.
[34] 刘玉坤,王渭霞,傅 强,等.寄主植物对3种稻飞虱解毒酶和保护酶活性的影响[J].中国水稻科学,2011,25(6):659-666.
LIU Y K,WANG W X,FU Q,etal.Effects of host plants on activities of detoxification and protection enzymes in three rice plant hoppers[J].ChineseJournalofRiceScience,2011,25(6):659-666.
[35] 蔡青年,张青文,周明牂.小麦旗叶和穗部吲哚生物碱含量与抗麦长管蚜关系研究[J].植物保护,2002,28(2):11-13.
CAI Q N,ZHANG Q W,ZHOU M Z.Correlation between indole alkaloid content in flag leaves and ears of wheat and its resistance toSitobionavenae(F.) [J].PlantProtection,2002,28(2):11-13.
[36] 陈巨莲,孙京瑞,丁红建,等.主要抗蚜小麦品种(系)的抗性类型及其生化抗性机制[J].昆虫学报,1997,40(增刊):190-195.
CHEN J L,SUN J R,DING H J,etal.The resistant patterns and mechanism of biochemical resistance in various wheat cultivars(lines) [J].ActaEntomologicaSinica,1997,40(Suppl.):190-195.
[37] 胡 远,韩 颖,赵 欣,等.小麦不同抗蚜品种中3种酚酸类化合物的含量变化及其作用评价[J].应用与环境生物学报,2008,14(6):753-756.
HU Y,HAN Y,ZHAO X,etal.Dynamics and effect evaluation of three phenolic compound contents in wheat varieties with different resistances toSitobionavenae[J].ChineseJournalofAppliedandEnvironmentalBiology,2008,14(6):753-756.
[38] LESZCYNSKI B,MATOK H,DIXON A F G.Detoxification of cereal plant allelochemicals by aphids:activity and molecular weight of glutathione-S-transferase in three species of cereal aphids[J].JournalofChemicalEcology,1994,20(2):387-394.
[39] 陈建新,宋敦伦,采长群,等.小麦抗禾谷缢管蚜的生化研究[J].昆虫学报,1997,40(1):186-189.
CHEN J X,SONG D L,CAI CH Q,etal.Biochemical studies on wheat resistance to the grain aphid,Rhopalosiphumpadi(lines) [J].ActaEntomologicaSinica,1997,40(1):186-189.
[40] CAI Q N,ZHANG Q W,CHEN M.Contribution of indole alkaloids toSitobionavenae(F.) resistance in wheat[J].JournalofAppliedEntomology,2004,128(8):517-521.
[41] CASTANEDA L E,FIGUEROA C C,NESPOLO R F.Do insect pests perform better on highly defended plants costs and benefits of induced detoxification defences in the aphidSitobionavenae[J].JournalofEvolutionaryBiology,2010,23(11):2474-2483.
[42] CASTANEDA L E,FIGUEROA C C,FUENTES-CONTRERAS E,etal.Energetic costs of detoxification systems in herbivores feeding on chemically defended host plants:a correlational study in the grain aphid,Sitobionavenae[J].JournalofExperimentalBiology,2009,212(8):1185-1190.
[43] FIGUEROA C C,SIMON J C,LE G,etal.Genetic structure and clonal diversity of and introduced pest in Chile,the cereal aphidSitobionavenae[J].Heredity,2005,95(1):24-33.
[44] FIGUEROA C C,SIMON J C,LE G ,etal.Effect of host defense chemicals on clonal distribution and performance of different genotypes of the cereal aphidSitobionavenae[J].JournalofChemicalEcology,2004,30(12):2515-2525.
[45] LOAYZA-MURO R,FIGUEROA C C,NIEMEYER H M.Effect of two wheat cultivars differing in hydroxamic acid concentration on detoxification metabolism in the aphidSitobionavenae[J].JournalofChemicalEcology,2000,26(12):2725-2736.
