小切口直视应用双侧乳内动脉冠状动脉旁路移植术与不停跳冠状动脉旁路移植术的对比研究
2018-03-06许志锋凌云鹏崔仲奇杨航宫一辰傅元豪万峰
许志锋,凌云鹏,崔仲奇,杨航,宫一辰,傅元豪,万峰
随着冠状动脉(冠脉)旁路移植术(CABG)不断成熟,在一些大的心脏中心,常规CABG死亡率已经下降到1%以下[1],如何在微创下安全实施手术以及获得更好的远期效果成为研究热点。桥血管的通畅率决定着患者的远期生存率及生活质量。与传统的左乳内动脉(LIMA)加大隐静脉相比,应用双侧乳内动脉CABG患者10年的病死率及心肌梗死等心脏事件明显减少[2]。然而常规正中开胸双侧乳内动脉的取材后由于胸骨血运减少,会明显增加术后胸骨骨髓炎的发生[3]。小切口直视下应用双侧乳内动脉行多支CABG可以避免胸骨劈开,即使在高龄、糖尿病、骨质疏松患者中也可以避免胸骨愈合不良并发症的发生,有利于减轻患者痛苦,加快患者恢复。本研究总结我院应用小切口直视下获取双侧乳内动脉行多支CABG早期经验及临床价值。
1 资料与方法
一般资料:研究纳入本中心2015-05至2017-01期间在我院接受左前外侧小切口获取双侧乳内动脉行多支CABG患者38例(小切口组),入选标准:冠脉两支或多支病变主要累及左冠脉患者;排除标准:严重肺气肿患者(不能耐受单肺通气);胸膜黏连;左心室射血分数(LVEF)<40%,左心室舒张末期内径(LVDd)>60 mm;严重心律失常,血流动力学不稳定患者。并选取同一时期由同一术者完成的常规胸部正中切口开胸择期非体外循环冠脉旁路移植术(OPCAB)236例患者作为正中切口组。本研究共入选患者274例,男性160例(58.4%)。
手术方法:全身麻醉,双腔气管插管。仰卧位,左胸垫高30°。右前及左后胸壁贴自动除颤电极,连接体外自动除颤仪。左前外侧第4或者第5肋间行5 cm左右小切口进胸,术前根据X线胸部正位片或胸部计算机断层摄影术(CT)结合冠脉造影确定切口位置,选择心脏前面左前降支(LAD)与后面的左回旋支(LCX)两靶血管之间手术入路[4](图1)。入胸腔后,放置悬吊式乳内动脉牵开系统(图2A-a),根据胸壁的角度调整拉钩方向。在剑突下做另一个切口1.5 cm,使用Rultract固定杆及牵引装置从剑突下切口向上牵引胸骨下段(图2A-b)以提供更好的视野。先游离右乳内动脉(RIMA):通过左前外侧小切口应用长柄电刀剔除胸骨后脂肪分离前纵膈,打开右侧胸膜,左肺单肺通气,调整Rultract牵引装置及体位,从乳内动脉中段无脂肪肌肉覆盖区应用电刀(30瓦)向上、向下小心游离,钛夹夹闭分支,避免出血及动脉主干损伤。游离范围上至第1肋下至第5或6肋乳内血管分叉处。根据不同冠脉血管移植策略选择保留原位带蒂RIMA,或在RIMA根部离断血管剔除血管周围多余组织形成骨骼化血管放置于动脉保存液(尼卡地平10 mg+肝素100 mg+动脉血30 ml)中备用。处理完RIMA后,改用右侧单肺通气,同样在原来左前外侧小切口下应用电刀完成LIMA的游离。根据靶血管位置,有3种冠脉血管移植策略备选:(1)RIMA- LAD、LIMA-对角支(D)或者钝圆支(OM);(2)取下RIMA吻合于LIMA成“Y”形复合桥,吻合口位置须根据所移植血管的情况而定,一般于LIMA第1吻合口近侧3~4 cm处,用8-0缝线行端侧吻合,吻合口径约为动脉口径的1.5倍,以保证足够的血流量,血管移植为LIMA-LAD,LIMARIMA-D或OM或者左心室后支。(3)乳内动脉序贯多支CABG。所有手术均在非体外循环心脏跳动下完成,血管吻合在腔镜型心脏稳定器辅助下完成。该稳定器通过原剑突下1.5 cm小切口放置,不占操作空间,其头端可360°旋转并可以任意角度固定靶血管。冠脉切开后,常规放置冠脉分流栓以避免冠脉缺血诱发心室颤动或严重血流动力学紊乱,应用8-0聚丙烯缝线(polypropylene)进行血管吻合(图2B-c)。完成桥血管吻合后马上应用即时血流测量技术,监测桥血管流量和桥血管通畅情况。

图1 根据计算机断层扫描结果选择手术切口
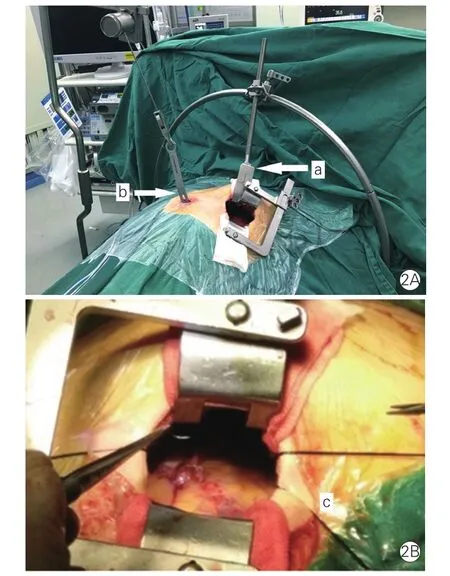
图2 左前外侧小切口直视下应用双则乳内动脉进行多支冠状动脉旁路移植术
围手术期管理:(1)术前常规监测:血常规、肝肾功能、凝血功能、电解质、心电图、X线胸片、彩色超声多普勒(心脏彩超);(2)完善锁骨下动脉血管彩超或电子计算机断层扫描血管造影(CTA)检查以了解乳内动脉情况;(3)术前7天停氯吡格雷,继续口服阿司匹林(100 mg ,每天一次)直到术前1天;(4)术后入心脏监护病房,密切观察心电图及心肌酶变化,保持平均动脉压70 mmHg(1 mmHg=0.133 kPa)以上的灌注压,并应用硝酸酯类药物扩冠治疗,术后拔除气管插管即开始口服阿司匹林(100 mg,qd)和氯吡格雷(75 mg,qd)双联抗血小板治疗。有高危心肌梗死风险因素患者术后6 h或切口引流减少后加用肝素抗凝(0.25 mg/kg,q 6 h,iv),维持活化全血凝固时间(ACT)160~180 s。术后1周完善X线胸片、心脏彩超检查及冠脉造影检查了解桥血管通畅情况。
统计学方法:采用 SPSS 19.0软件进行统计学处理。连续变量使用均数±标准差()表示,使用两个独立样本t检验分析。非连续变量使用百分比(%)表示,使用两个独立样本非参数检验。以P<0.05 为差异有统计学意义。
2 结果
两组患者的基线资料比较(表1):与正中切口组比较,小切口组男性患者较多(68.4% vs 55.9%),冠脉病变≥3支(15.8% vs 78.8%)患者较少,差异均有统计学意义(P<0.05),两组患者的一般情况、危险因素及心功能指标等资料的差异均无统计学意义(P>0.05)。

表1 两组患者基线资料比较[例(%)]
小切口组患者术中情况:(1)双侧乳内动脉获取:小切口组患者左前外侧小切口直视下利用Rultract牵引装置及悬吊式乳内动脉牵开系统成功获取双侧乳内动脉36例,成功率94.7%(36/38),2例患者获取RIMA时出现桥血管中段夹层。平均获取RIMA时间(42.3±10.5)min,获取LIMA时间(35.2±8.3)min,手术切口长(4.2±0.8)cm,伤口不良愈合率0%(0/38)。(2)多支冠脉血管移植情况:94.7%(36/38)患者成功应用双侧乳内动脉完成多支冠脉血管移植,2例患者获取RIMA时出现桥血管夹层,改用大隐静脉。38例共完成血管移植78支,平均(2.05±0.31)支/例;其中LAD 38支,第一对角支15支,第二对角支5支,左回旋支 8支,左心室后支2支,钝圆支10支。即时血流测量显示78支桥血管流量均>25 ml/min,平均血流量(34.5±7.3)ml。冠脉血管移植的方式包括:(1)原位双侧乳内动脉双支血管移植7例;(2)LIMA-RIMA“Y”型复合血管桥25例,(3)乳内动脉序贯血管移植4例;(4)LIMA+大隐静脉2例。小切口组患者无术中循环不稳定需要主动脉内球囊反搏(IABP)支持,无中转常规开胸CABG。
两组患者术中情况比较:与正中切口组相比,小切口组术中平均出血[(325.2±145.3)ml vs(405.7±253.2)ml]和自体血液回输 [(248.3±103.5)ml vs (380.1±201.2)ml]均较少;获取LIMA时间[(35.2±8.3)min vs (25.7±6.2)min]及总手术时间[(332.2±45.3)min vs (246.7±56.2)min] 均较长,差异均有统计学意义(P均<0.05)。
两组患者围手术期情况比较(表2):与正中切口组相比,小切口组术后呼吸机使用时间、术后监护病房住院时间及住院时间均较短,差异均有统计学意义(P均<0.001);术后24小时引流量、红细胞使用量、二次开胸止血、围手术期主要不良心脑血管事件(MACCE,包括死亡、非致死性心肌梗死、再次血运重建以及脑卒中、脑出血事件)发生率及术后心房颤动发生率的差异均无统计学意义(P均>0.05)。
表2 两组患者围手术期情况比较

表2 两组患者围手术期情况比较
注:MACCE:主要不良心脑血管事件
术后造影及随访情况:术后1周造影:小切口组所有患者均行冠脉造影检查,吻合口通畅率100%(38/38),1例患者LIMA-LAD吻合口轻度狭窄(狭窄30%)。正中切口组随机抽取38例患者(38/236,16.1%)进行冠脉造影,吻合口通畅率100%。平均随访3个月,小切口组患者无再次入院、心绞痛、心肌梗死或死亡,MACCE发生率为0%。正中切口组2例患者因切口感染再次入院,236例患者均无心绞痛、心肌梗死或死亡发生,MACCE发生率0%,两组患者差异无统计学意义。
3 讨论
传统小切口冠脉血管移植获取双侧乳内动脉通常需借助胸腔镜或者机器人技术,然而由于设备、费用及场地、技术操作学习曲线长等限制,一定程度上限制了其在临床的推广应用[5]。我们通过左前外侧小切口借助悬吊式乳内动脉牵开系统在直视下完成双侧乳内动脉获取,成功实施多支CABG,平均总手术时间[(332.2±45.3)min],略长于正中切口组[(246.7±56.2) min],考虑主要原因是小切口下双侧乳内动脉获取时间较长所致。小切口组术后呼吸机使用时间,监护室停留时间,住院时间,围手术期死亡率、心肌梗死发生率以及切口愈合不良等并发症发生率均低于正中切口组,取得良好的近期手术效果。
小切口多支冠脉血管移植的切口位置选择非常重要,会影响术中血管的暴露,在手术前需通过仔细阅读患者的X线胸片结合冠脉造影提示的LAD血管移植位置来选择合适的肋间入路,通常在左胸前外侧第4或5肋间,女性患者选择乳房下缘弧形切口,切开皮下组织和肌肉后根据情况选择第4或5肋间进入胸腔。借助胸部CT定位则更为精确,定好进胸的肋间之后,根据CT横断面上靶血管位置可以更为精确的定位切口在该肋间的具体位置及长度。需要注意的是,为避免牵开器引起的肋骨骨折或胸肋关节脱位,应尽可能向切口外侧面切断肋间肌肉减少牵拉力量,充分肌松及镇痛有利于减少肌肉对抗。切口撑开时应逐步牵开肋骨避免暴力引起骨折。分离切口内侧肋间肌肉时应注意避免误伤乳内血管。
如何在小切口有限视野下充分暴露双侧乳内动脉,特别是右侧乳内动脉是应用双侧乳内动脉小切口多支冠脉血管移植的难点。悬吊式乳内动脉牵开系统可多角度调整牵拉抬起左胸前壁,配合剑突下小切口置入的紧贴胸骨背面的牵引拉钩,通过对抗患者自身重量向上牵引胸壁,能获得较为良好的视野,使双侧乳内动脉近、远端均能得以显露。乳内动脉损伤是每位术者可能会面临的情况,部分术者可能会被迫选择更改为常规切口。本研究38例患者中有2例出现RIMA损伤,我们借鉴Chan 等[6]的经验通过左前外侧小切口成功完成升主动脉-大隐静脉近端吻合,使用静脉桥完成冠脉血管移植手术,避免了更改常规大切口CABG。小切口下大隐静脉近端吻合难点在于升主动脉的暴露。我们的经验是:(1)通过心血管活性药物管理及容量管理,减少右心室充盈;(2)调整体位及增加右肺呼气末正压和潮气量,以易于心脏的左抬;(3)多级心包悬吊;(4)在上腔静脉与升主动脉右后方之间填塞纱布,使主动脉向左、前位移;(5)在右心室流出道左后方放置心肌稳定器将右心室流出道向左后下方牵开。经过以上处理,升主动脉能较好显露,通过侧壁钳部分阻断升主动脉,可完成桥血管近端吻合。另外,也有报道通过增加锁骨下小切口行左侧腋动脉-大隐静脉-LAD的血管移植方式,也可避免正中开胸,减少手术创伤[7]。
原位RIMA由于小切口下视野及操作受限用于右冠及左回旋支系统血管移植比较困难,对于单纯LAD、对角支病变,我们一般选择原位RIMA-LAD、原位LIMA-D血管移植,较为方便。但对于合并其他血管病变,原位乳内动脉桥血管长度往往不够,这时候可采用游离RIMA,与LIMA组成“Y”形复合血管桥,LIMA桥远端完成LAD或对角支的血管吻合,RIMA桥与LIMA中段端侧吻合形成Y型桥后其长度能到达与右冠脉的后降支,途中可以与钝缘支及左心室后支序贯吻合,可以实现冠脉完全再血管化[8,9]。
因本研究为小切口直视下多支冠脉血管移植前期探索性研究,病例数相对较少,选择病例相对简单,平均冠脉移植血管2支,未能达到对非选择性患者进行冠脉全部血管化要求。但本研究38例患者靶血管涉及LAD、第一对角支、第二对角支、钝圆支、左心室后支,冠脉血管移植方法有原位双乳内动脉桥、LIMA-RIMA“Y”形桥,LIMA序贯桥,取得较为满意的初步结果。然而由于例数少,随访时间较短,其临床价值尚需大样本随机对照研究及长期随访研究进一步证实。
[1] 郑宝荣, 王联群, 刘建实, 等. 探讨SinoSCORE系统对非体外循环下冠状动脉旁路移植术风险评估的价值[J]. 中国循环杂志, 2013,28(5): 375-378. DOI: 10. 3969/j. issn. 1000-3614. 2013. 05. 016.
[2] BARI Investigators. The final 10-Year follow-up results from the BARI randomized trial[J]. J Am Coll Cardiol, 2007, 49(15): 1600-1606. DOI: 10. 1016/j. jacc. 2006. 11. 048.
[3] Dai C, Lu Z, Zhu H, et al. Bilateral internal mammary artery grafting and risk of sternal wound infection: evidence from observational studies[J]. Ann Thorac Surg, 2013, 95(6): 1938-1945. DOI: 10. 1016/j.athoracsur. 2012. 12. 038.
[4] Watanabe G, Misaki T, Kotoh K, et al. Multiple minimally invasive direct coronary artery bypass grafting for the complete revascularization of the left ventricle[J]. Ann Thorac Surg, 1999, 68(1): 131-136.
[5] 华琨, 郑哲, 王巍, 等. 2010年~2012年中国心血管外科微创技术的开展情况分析[J]. 中国循环杂志, 2014, 29(8): 590-593. DOI:10. 3969/j. issn. 1000-3614. 2014. 08. 009.
[6] Chan V, Lapierre H, Sohmer B, et al. Handsewn proximal anastomoses onto the ascending aorta through a small left thoracotomy during minimally invasive multivessel coronary artery bypass grafting: a stepwise approach to safety and reproducibility[J]. Semin Thorac Cardiovasc Surg, 2012 , 24(1): 79-83. DOI: 10. 1053/j. semtcvs. 2011.12. 010.
[7] Coulson AS, Glasgow EF, Bonatti J. Minimally invasive subclavian/axillary artery to coronary artery bypass (SAXCAB): review and classification[J]. Heart Surg Forum, 2001, 4(1): 13-25.
[8] Nambiar P, Mittal C. Minimally invasive coronary bypass using internal thoracic arteries via a left minithoracotomy: "the Nambiar Technique"[J]. Innovations (Phila), 2013, 8(6): 420-426. DOI: 10.1097/IMI. 0000000000000035.
[9] 杨俊峰, 顾承雄, 韦华, 等. 非体外循环下双侧乳内动脉Y型桥的冠状动脉旁路移植术125例[J]. 中华外科杂志, 2006, 44(22):1529-1531. DOI: 10. 3760/j: issn: 0529-5815. 2006. 22. 005.
