超高效液相色谱-串联质谱测定饲料中镇静剂类和β-受体激素类药物残留
2018-03-05孙珊珊朱丽君胡延喜刘玉峰
孙珊珊, 朱丽君, 胡延喜, 刘玉峰,2*, 徐 亮,2*
(1. 辽宁大学药学院, 辽宁 沈阳 110036; 2. 辽宁省天然产物制药工程技术研究中心, 辽宁 沈阳 110036)
近年来,随着养殖业的快速发展,镇静剂和β-受体激素类药物被广泛用作畜禽饲料添加剂,以获得非法利益。镇静剂是一类对中枢神经系统有抑制作用的药物,在动物饲养过程中可作为麻醉剂和止痛剂减轻或消除动物的狂躁不安和兴奋,使其恢复安静,便于工作或治疗[1],近年来,一些不法饲料生产企业在利益的驱使下,擅自在畜禽饲料中添加此类药物以达到催眠、增重催肥、缩短出栏时间的目的,或在运输过程中使用此类药物以减少动物死亡和体重下降等应激反应带来的损失。β-受体激素类药物又称β-兴奋剂,俗称“瘦肉精”,是一种人工合成药物,主要用于防治人、兽支气管哮喘和支气管痉挛,此类物质可以促进体脂分解、增加蛋白质合成、显著提高动物的瘦肉率,因此被添加至饲料中用作畜禽的促生长剂[2-4],造成以上药物以其原形和代谢产物的形式最终潜伏在动物源食品中,目前医学实验已证明其残留会对人的中枢神经系统等造成不良影响,导致过敏性反应,引起体位性低血压、运动障碍、心悸、肝损害、恶性综合征,甚至诱变致癌[5-7]。因此许多国家都将此类药物列为禁用药物,我国农业部235号公告已明确规定氯丙嗪等镇静剂和β-受体激素类药物只允许治疗使用,不得在动物源食品中检出[8],国际食品法典委员会(CAC)、欧盟、澳大利亚等国家和地区均对畜肉中镇静剂和β-受体激素的检出和限量值做出了相关规定[9,10]。但由于镇静剂和β-受体激素类药物品种众多,且我国饲料生产企业较多,很难掌握在饲料生产时药物添加的情况,因此开发筛查饲料中镇静剂和β-受体激素类药物的方法尤为重要。
目前检测镇静剂类和β-受体激素类药物的方法,包括酶联免疫法[11]、高效液相色谱法[12]及液相色谱-质谱联用法[13,14]。酶联免疫法作为快速检测的方法可以用于前期筛查,但存在一定的假阳性,无法作为确证方法[3,15]。随着液相色谱-质谱技术的发展,液相色谱-串联质谱法正越来越广泛地应用于违禁药物的分析中,其分析范围广,背景干扰少,灵敏度高,选择性强,结果精确可靠,即可定性、又可定量,是对复杂样本中药物残留快速检测的首选方法[16-19]。针对饲料市场上镇静剂类和β-受体激素类药物泛滥使用的现象,本文同时选取这两类药物作为研究对象。经文献检索,仅见镇静剂类[20]和β-受体激素类[3,21]单一类别药物的报道,尚未发现对这两大类药物同时检测的报道。本研究利用超高液相色谱-串联三重四极杆质谱(UHPLC-QqQ-MS)技术,建立了饲料中具有代表性的8种镇静剂类和15种β-受体激素类药物的筛查检测方法,该分析方法较上述报道[3,20,21]在样品处理上操作更简单,分析时间更短,为同时监控动物饲料中的镇静剂类和β-受体激素类药物提供了技术支持。
1 实验部分
1.1 仪器、材料与试剂
Agilent 1290-6460液相色谱-串联质谱仪(Agilent公司); XS303S分析天平(Mettler Toledo公司); Centrifuge 5810R型离心机(Eppendorf公司); T25型均质器(IKA公司); MMV-1000W振荡器(ETELA公司); N-EVAP氮吹仪(Organomation公司); MS basic涡流混匀器(IKA公司);PCX混合型阳离子交换固相萃取柱(60 mg/3 mL,Agilent公司)。乙腈、甲醇均为色谱纯(美国Fisher公司),三氯乙酸、氨水均为分析纯(烟台市双双化工有限公司),甲酸为色谱纯(美国Tedia公司),水采用GB/T 6682规定的一级水。
标准物质:8种镇静剂类药物(乙酰丙嗪、氯丙嗪、氟哌啶醇、丙酰二甲氨基丙吩噻嗪、甲苯噻嗪、阿扎哌隆、阿扎哌醇、咔唑心安)、15种β-受体激素类药物(莱克多巴胺、苯乙醇胺A、齐帕特罗、喷布特罗、班布特罗、妥罗特罗、克伦特罗、沙丁胺醇、马喷特罗、塞布特罗、特布他林、马布特罗、溴布特罗、氯丙那林、盐酸溴代克伦特罗)和4种内标(氯丙嗪-d6、莱克多巴胺-d3、克伦特罗-d9、沙丁胺醇-d3),均购自德国Dr. Ehrenstorfer公司,纯度均大于95%。
1.2 标准溶液配制
用甲醇配制23种药物、4种内标的100 mg/L的标准储备液,避光于4 ℃下保存。系列标准溶液用初始流动相配制,现用现配。
1.3 样品前处理
1.3.1 样品提取
称取试样2.0 g,置于100 mL聚丙烯离心管中,加入20 mL乙腈-1%(体积分数,下同)三氯乙酸水溶液(7∶3, v/v)均质提取2 min,然后于10 000 r/min离心10 min,并将上清液全部转移至新的100 mL离心管中。再加入10 mL乙腈-1%三氯乙酸水溶液(7∶3, v/v),涡旋混合1 min,于10 000 r/min离心10 min,将上清液合并入100 mL离心管,涡旋混合,待净化。
1.3.2 样品净化
混合阳离子交换固相萃取柱在使用前依次用3 mL甲醇、3 mL水和3 mL 1%(体积分数,下同)甲酸水溶液活化,保持柱体湿润。将上清液加入到活化后的混合阳离子交换固相萃取柱上,自然重力下流出,依次用5 mL 1%甲酸水溶液、5 mL水、5 mL甲醇淋洗,最后用5 mL氨水-甲醇(5∶95, v/v)洗脱液洗脱至10 mL玻璃管中,在45 ℃水浴中用氮气吹干。准确加入1 mL乙腈-0.1%甲酸水溶液(3∶7, v/v),涡旋溶解,过0.2 μm滤膜,供液相色谱-串联质谱测定。
1.4 色谱-串联质谱条件
1.4.1 液相色谱条件
色谱柱:Zorbax Eclipse Plus C18柱(100 mm×3.0 mm, 1.8 μm);流动相:0.1%甲酸水溶液(A)-甲醇(B)。梯度洗脱程序:0~3.0 min, 10%B~30%B; 3.0~5.0 min, 30%B~70%B; 5.0~7.0 min, 70%B~90%B; 7.01 min, 10%B,平衡3 min。柱温:40 ℃;流速:0.3 mL/min;进样量:20 μL。
1.4.2 质谱条件
离子源:电喷雾电离源,正离子模式ESI(+);扫描方式:多反应监测(MRM)扫描;干燥气温度:350 ℃;干燥气流速:10 L/min;喷雾针压力:275.8 kPa;电子倍增器电压:4 000 V;碰撞气:氮气,纯度99.999%。
1.4.3 定量
8种镇静剂类药物以氯丙嗪-d6为内标,15种β-受体激素类药物以莱克多巴胺-d3、克伦特罗-d9、沙丁胺醇-d3为内标,具体见表1。
2 结果与讨论
2.1 质谱条件的优化
对于串联质谱,一个母离子和两个特征子离子即可满足质谱确证的需要。在本实验中,分别将8种镇静剂类和15种β-受体激素类药物及4种内标的标准储备液配成一定浓度的标准溶液,不接色谱柱,直接进行质谱分析。首先在正离子模式下进行全扫描,确定化合物的分子离子,即为母离子。用高纯氮气作为碰撞气体,选取干扰较小、丰度较强的子离子作为定性和定量离子,即特征子离子。同时优化碎裂电压和碰撞能量,23种目标物及4种内标的质谱参数优化结果见表1。

表 1 8种镇静剂类、15种β-受体激素类药物和4种内标的质谱参数Table 1 MS parameters of eight sedatives, fifteen β-receptor hormones and four internal standards
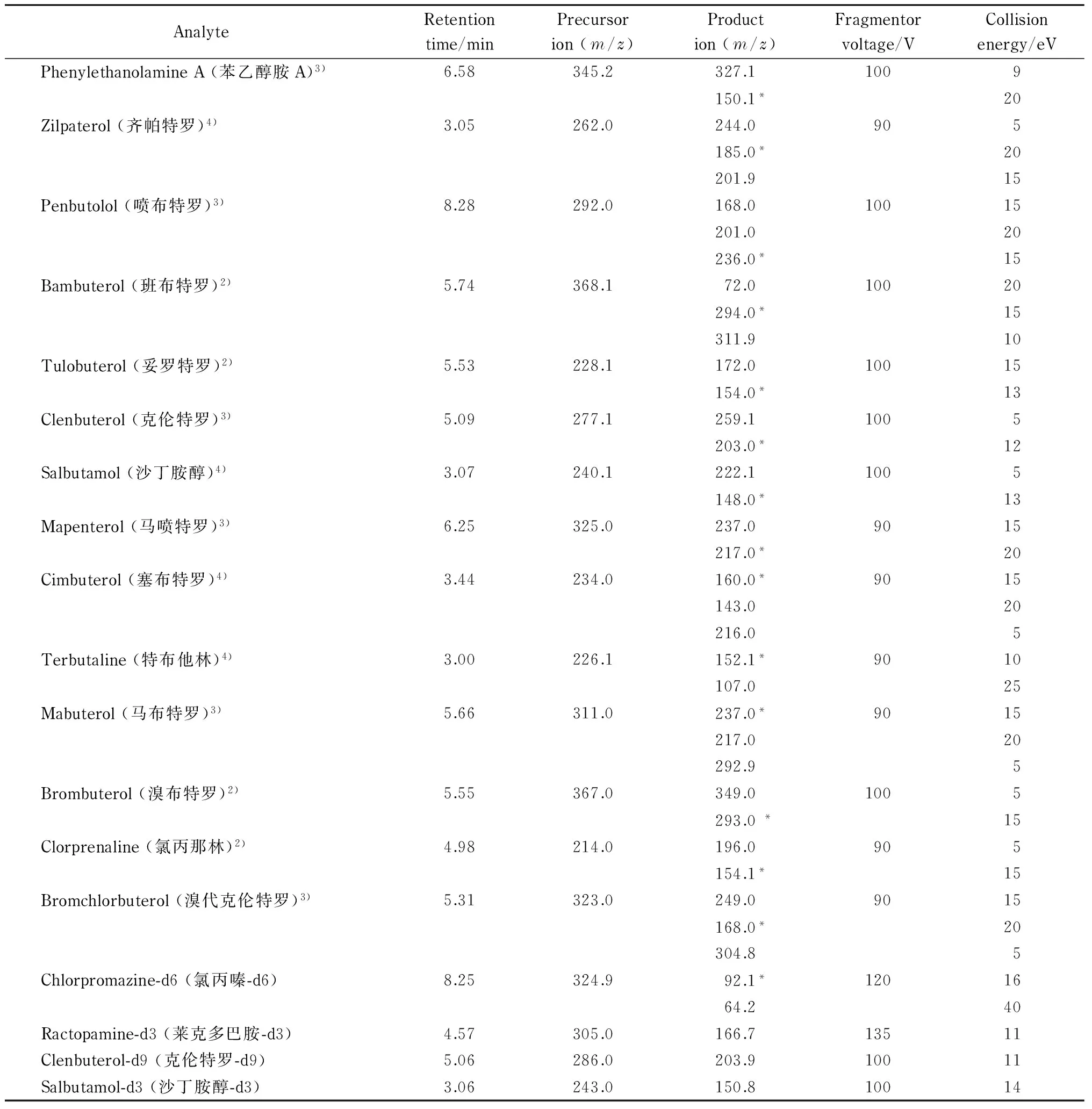
表 1 (续)Table 1 (Continued)
* Quantitative ion. Quantitative internal standard: 1) chlorpromazine-d6; 2) ractopamine-d3; 3) clenbuterol-d9; 4) salbutamol-d3.
2.2 前处理条件的优化
2.2.1 提取液的选择
动物源食品中β-受体激素类药物与组织结合,需要通过蛋白酶酶解的方式提取出来[22,23],饲料样品中β-受体激素类药物主要以原形态存在,因此在提取饲料样品过程中未加入酶解试剂。镇静剂类药物在动物体内除以原形态药物存在以外还可能以代谢物形式存在,但饲料当中主要检测其原形态药物[24]。
提取试剂的选择在样品前处理过程中至关重要,不仅要考虑萃取效率,还要尽可能使其他基质或杂质干扰物不溶解或少溶解,本实验选取了兽药残留检测常用的有机溶剂作为提取试剂(主要包括乙酸乙酯、乙腈、甲醇),选取相同的饲料样品,分别添加相同浓度的标准物质,以外标法比较其回收率,结果表明:乙酸乙酯74.6%~81.7%,乙腈80.3%~86.9%,甲醇79.6%~84.1%。饲料的样品基质较为复杂,考虑到饲料样品中蛋白质的含量较高,在提取试剂中加入1%三氯乙酸能够更好地起到沉淀蛋白的作用,通过试验比较,乙腈较其他两种试剂药物提取效率更高,因此对比优化后用乙腈-1%三氯乙酸水溶液(7∶3, v/v)作为提取液。
2.2.2 净化条件的选择
饲料成分较为复杂,各种杂质含量较高,对检测影响很大。镇静剂类药物在GB 20763-2006中采用液液萃取的方式净化,β-受体激素类药物净化在文献[21,25]报道中主要有强阳离子交换柱净化、C18柱净化、QuEChERS方法净化。相对于传统的净化方式,强阳离子交换柱净化效率高,提高了浓缩倍数,降低了检出限[26,27]。本实验选取相同的待净化样品,利用外标法对上述4种净化方法进行比较,检测药物的回收率,结果如下:强阳离子交换柱82.1%~87.4%, C18柱77.6%~82.7%, QuEChERS方法74.5%~80.1%,液液萃取69.0%~74.3%。因此在选择净化方面最终选用强阳离子交换柱净化。本实验比较了甲酸水溶液、水、甲醇、氨水-甲醇作为淋洗液和洗脱液的净化效果,结果表明,按照5 mL 1%甲酸水溶液、5 mL水和5 mL甲醇的顺序进行淋洗,净化效果好,5 mL氨水-甲醇(5∶95, v/v)作为洗脱液回收率高。
2.3 色谱条件的优化
2.3.1 色谱柱的选择
镇静剂类和β-受体激素类部分药物在极性方面相近,因此色谱分离方面要尽可能选择合适的色谱柱,以提高分离速度和灵敏度。在色谱柱的选择性方面,分别比较了Agilent Zorbax Eclipse Plus C18系列1.8 μm填料的色谱柱(50 mm×2.1 mm、100 mm×2.1 mm、100 mm×3.0 mm)以及C18与C8(100 mm×3.0 mm, 1.8 μm)两种相同规格、不同性质的色谱柱。结果表明,规格为100 mm×3.0 mm, 1.8 μm的C18色谱柱柱效更高,分离效率、灵敏度更好。同时,选用的0.3 mL/min的柱流速与本实验中电喷雾离子化方式所要求的流速也具有良好的匹配。
2.3.2 流动相的选择
为获得最佳的分辨率和灵敏度,分别比较了甲醇-水、乙腈-水、甲醇-0.1%甲酸水溶液、乙腈-0.1%甲酸水溶液、乙腈-10 mmol/L乙酸铵、甲醇-10 mmol/L乙酸铵溶液6种流动相配比方式,最终发现,在ESI(+)方式下,在甲醇-0.1%甲酸水溶液组成的流动相中,质谱的离子化效率优于其他试剂,因此本文选择甲醇-0.1%甲酸水溶液作为流动相。通过调整流动相比例,进行梯度洗脱。在本文的液相色谱条件下,23种化合物的总离子流色谱图(TIC)和多反应监测(MRM)色谱图见图1。

图 1 目标物的总离子流色谱图和多反应监测色谱图Fig. 1 Total ion chromatogram (TIC) and multiple reaction monitoring chromatograms of the targets

图 1 (续)Fig. 1 (Continued)
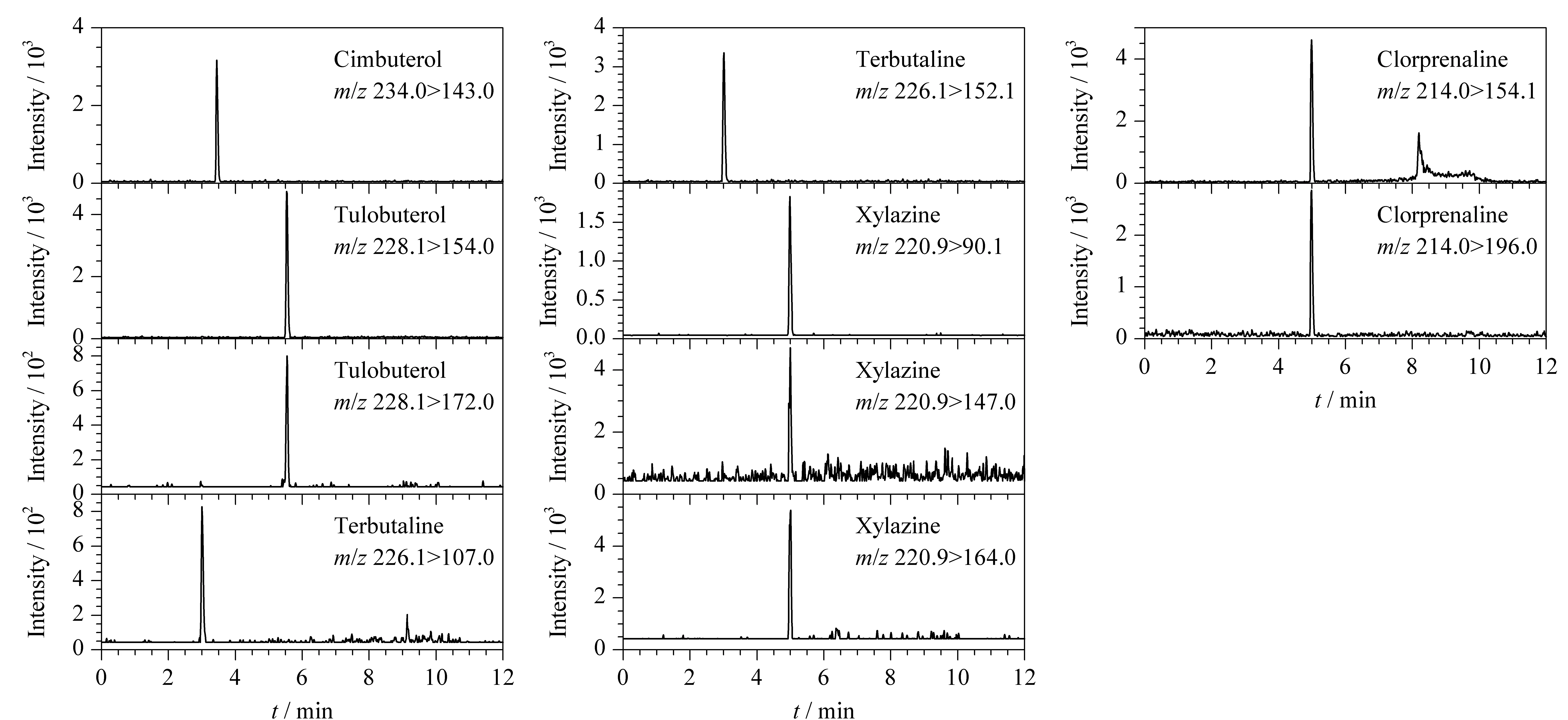
图 1 (续)Fig. 1 (Continued)

AnalyteLinearequationr2LOD/(μg/kg)LOQ/(μg/kg)Recoveries/%(n=6)5.0μg/kg10μg/kg50μg/kgRSDs/%(n=6)5.0μg/kg10μg/kg50μg/kgAcetopromaiziney=0.676x+0.0030.999131.13.081.287.884.66.86.27.7Chlorpromaziney=0.819x-0.0060.999330.72.091.390.289.76.810.211.7Haloperidoly=24.403x+0.6670.999131.23.086.484.288.712.711.914.3Propionylpromaziney=40.323x+0.1140.999521.33.090.991.292.37.98.79.3Xylaziney=9.047x+0.1980.999001.23.086.789.888.94.65.87.2Azaperoney=0.473x-0.0070.999321.13.086.187.685.89.210.28.7Azaperoly=0.570x-0.0010.999331.13.091.189.693.48.79.17.8Carazololy=0.433x+0.0080.999721.33.091.789.186.29.610.28.7Ractopaminey=11.979x+0.5100.999170.72.092.394.791.89.68.58.1PhenylethanolamineAy=49.604x+1.5420.999821.96.078.477.178.710.18.911.2Zilpateroly=5.822x+0.3750.998920.93.089.490.287.98.98.27.9Penbutololy=18.322x+0.3800.999661.03.084.385.686.15.26.86.0Bambuteroly=15.117x+0.1130.999860.93.090.291.694.79.68.710.2Tulobuteroly=25.523x+0.0630.999411.03.091.499.698.18.68.19.7Clenbuteroly=13.640x+1.5160.999300.51.599.8102.4100.14.36.25.0Salbutamoly=20.965x+0.6880.999760.61.596.898.6101.46.46.15.9Mapenteroly=21.285x+0.7490.999290.93.096.192.194.811.210.89.7Cimbuteroly=1.836x+0.1130.999560.83.079.678.475.18.99.89.9Terbutaliney=18.991x+0.0490.999810.73.096.498.693.76.28.77.6Mabuteroly=20.075x+0.7860.999890.83.089.190.792.89.69.910.8Brombuteroly=7.746x+0.0140.999541.03.077.879.680.76.45.97.1Clorprenaliney=0.473x-0.0070.999331.13.092.993.890.75.65.86.0Bromchlorbuteroly=10.563x+0.5620.999411.23.080.177.976.211.210.010.3
y: peak area ratio of analyte to the internal standard;x: mass concentration of analyte, μg/L.
2.4 方法的线性范围、检出限和定量限
以各物质定量离子峰面积与相应内标物定量离子峰面积的比值为纵坐标,被测组分的质量浓度为横坐标,分别绘制标准曲线,得到镇静剂类和β-受体激素类药物的线性方程、相关系数(r2)、检出限和定量限,结果见表2。由表2可知,23种目标物在2.0~200.0 μg/L内线性关系良好,相关系数均大于0.99。
2.5 准确度和精密度试验
以空白饲料为样品,在5.0、10、50 μg/kg 3个水平下进行加标回收试验,每个样品重复测定6次,考察本方法的准确度和精密度,结果见表2。饲料中镇静剂类和β-受体激素类药物的平均回收率为75.1%~102.4%,相对标准偏差(RSD)为4.3%~14.3%(n=6)。回收率和精密度等均满足分析要求。
2.6 实际样品测定
用本方法对从市场上抽检的10份饲料样品进行检测,均为阴性样品。
3 结论
本文建立了同时测定饲料中8种镇静剂类和15种β-受体激素类药物残留的超高效液相色谱-串联质谱法,并对样品的前处理条件和分析条件进行了优化。本实验在样品净化时采用强阳离子交换柱,使得被检测的药物回收率更高,检出限和定量限更低,液相色谱-串联质谱的检测条件使样品的分析时间也更短。因此可认为该方法对饲料中残留的药物具有提取率高、选择性强、灵敏度高、筛选速度快等优点。随着人们对食品安全关注度的增加,对畜产品及其饲料中添加的有毒有害物质的筛查也会越来越重视。该方法实现了对饲料中多种镇静剂类和β-受体激素类药物的同时分析检测,为检测饲料中镇静剂类和β-受体激素类药物残留提供了技术支持。
[1] Deng Y B. Hunan Agriculture, 1996(8): 5
邓云波. 湖南农业, 1996(8): 5
[2] Ding H Z, Chen Z L, Yang Z L. Veterinary Pharmaceuticals & Feed Additives, 2002(1): 18
丁焕中, 陈杖榴, 杨志凌. 兽药与饲料添加剂, 2002(1): 18
[3] Liu J, Liang G R, Li S H, et al. Journal of Food Safety & Quality, 2015, 6(4): 1167
刘佳, 梁桂荣, 李少晖, 等. 食品安全质量检测学报, 2015, 6(4): 1167
[4] Wang P L. Quality and Safety of Agro-Products, 2014(1): 44
王培龙. 农产品质量与安全, 2014(1): 44
[5] Bi Y F. [PhD Dissertation]. Beijing: China Agricultural University, 2014
毕言锋. [博士学位论文]. 北京: 中国农业大学, 2014
[6] Zhang Q L. [PhD Dissertation]. Nanchang: Nanchang University, 2011
张秋兰. [博士学位论文]. 南昌: 南昌大学, 2011
[7] Smith D J. J Anim Sci, 1998, 76(1): 173
[8] Ministry of Agriculture of the People’s Republic of China. The Maximum Residue Limit of Veterinary Drugs in Animal Origin Food. No. 235 Bulletin-2002 of the Ministry of Agriculture of the People’s Republic of China. (2002-12-24). http://www.foodmate.net/law/shipin/163968.html
中华人民共和国农业部. 动物性食品中兽药最高残留限量. 中华人民共和国农业部235号公告-2002. (2002-12-24). http://www.foodmate.net/law/shipin/163968.html
[9] Codex Alimentarius Commission (CAC). Codex Alimentarius Commission Maximum Residue Limits for Veterinary Drugs in Foods Updated as at the 35thSession of the Codex Alimentarius Commission (July 2012). [2017-10-25]. http://doc.mbalib.com/view/45cbdbed1ebc3d5acc6179e485c2de d0.html
[10] European Parliament and Council (EC). Regulation (EC) No. 470/2009 of the European Parliament and of the Council. (2009-05-06). http://down.foodmate.net/standard/sort/44/28727.html
[11] Wan Y P, Liu N, Tao G C, et al. Journal of Henan Agricultural Science, 2013, 42(2): 132
万宇平, 刘宁, 陶光灿, 等. 河南农业科学, 2013, 42(2): 132
[12] Wang L, Li Y Q, Zhou Y K. Chinese Journal of Analysis Laboratory, 2009, 28(3): 78
王炼, 黎源倩, 周运柯. 分析试验室, 2009, 28(3): 78
[13] Lu Y F, Xu L J, Wang H, et al. Journal of Chinese Mass Spectrometry Society, 2012, 33(5): 280
卢艳芬, 徐丽君, 王辉, 等. 质谱学报, 2012, 33(5): 280
[14] Miyaguchi H, Kuwayama K, Tsujikawa K, et al. Forensic Sci Int, 2006, 157(1): 57
[15] Liu Y P, Leng K L, Wang Q Y, et al. Marine Sciences, 2009, 33(4): 34
刘艳萍, 冷凯良, 王清印, 等. 海洋科学, 2009, 33(4): 34
[16] Jia T, Liu H. Feed Research, 2014(3): 55
贾涛, 刘辉. 饲料研究, 2014(3): 55
[17] Sun L, Liu Q, Zhang L, et al. Chinese Journal of Veterinary Drug, 2008(4): 15
孙雷, 刘琪, 张骊, 等. 中国兽药杂志, 2008(4): 15
[18] De Wasch K, De Brabander H, Courtheyn D. Analyst (Cambridge, U. K.), 1998, 123(12): 2270
[19] Juan C, Lgualada C, Moragues F, et al. J Chromatogr A, 2010, 1217(39): 6061
[20] Wang N P, Ban F G, Peng L, et al. Journal of Chinese Mass Spectrometry Society, 2012, 33(2): 94
吴宁鹏, 班付国, 彭丽, 等. 质谱学报, 2012, 33(2): 94
[21] Zheng L, Wu Y J, Zhao Y F, et al. Chinese Journal of Chromatography, 2014, 32(8): 869
郑玲, 吴玉杰, 赵永锋, 等. 色谱, 2014, 32(8): 869
[22] GB/T 22286-2008
[23] Ministry of Agriculture of the People’s Republic of China. No. 1025 Bulletin-18-2008 of the Ministry of Agriculture of the People’s Republic of China. (2008-04-29). http://down.foodmate.net/standard/sort/9/17197.html
中华人民共和国农业部. 中华人民共和国农业部1025号公告-18-2008. (2008-04-29). http://down.foodmate.net/standard/sort/9/17197.html
[24] Sun L, Zhang L, Xu Q, et al. Chinese Journal of Chromatography, 2010, 28(1): 38
孙雷, 张骊, 徐倩, 等. 色谱, 2010, 28(1): 38
[25] Zeng H H, Li S Y, Feng Y J, et al. Journal of Medical Pest Control, 2009, 25(12): 940
曾红惠, 黎少映, 冯耀基, 等. 医学动物防制, 2009, 25(12): 940
[26] Tan W, Zhang Y, Hong A H, et al. Chinese Journal of Spectroscopy Laboratory, 2013, 30(2): 850
谭微, 张毅, 洪爱华, 等. 光谱实验室, 2013, 30(2): 850
[27] Liu X Y, Pan C P, Liu S. Chinese Journal of Pesticide Science, 2008(2): 166
