高效液相色谱-串联质谱法同时测定蜂王浆中7种高风险农药残留
2018-03-05李樱红徐权华邵巧云
李樱红, 周 萍, 徐权华, 赵 焕, 邵巧云
(1. 浙江省食品药品检验研究院, 浙江 杭州 310052; 2. 杭州蜂之语蜂业股份有限公司, 浙江 桐庐 311500)
蜂王浆是由工蜂咽下腺和上腭腺分泌的,为乳白色、淡黄色或浅橙色浆状物质,主要用于饲喂蜂王和蜂幼虫。我国是蜂王浆生产大国,占有世界蜂王浆产量的90%。蜂王浆具有多种生理和药理作用,被广泛应用于保健食品、食品和日化用品。自2001年以来,以蜂蜜和蜂王浆为代表的蜂产品中的农药残留问题被世人所关注,农残限度升级为出口蜂产品的常规质量要求,也成为蜂产品出口贸易的绿色壁垒。
虽然经过多年努力,但是我国仍然没有彻底解决农药残留问题。在国内,蜂产品中检出违禁药物的报道时有发生[1]。为进一步规范蜂产品食品安全监督抽检工作,《国家食品安全监督抽检实施细则(2017年版)》中明确规定蜂蜜产品中增加氟胺氰菊酯(tau-fluvalinate)和双甲脒两个检测指标[2]。为了保证国内消费市场和进出口市场中蜂产品的质量,蜂产品企业必须要加强源头质量管理和质量检测。因此,亟须开发方便有效的检测蜂产品中农药残留的方法,以提高蜂产品的质量。
食品中农药的主要检测方法有气相色谱法(GC)[3-5]、气相色谱-串联质谱法(GC-MS/MS)[6-8]、高效液相色谱法(HPLC)[9-11]、高效液相色谱-串联质谱法(HPLC-MS/MS)[12-14]等。随着强极性、热不稳定、难挥发农药种类的不断增加,高效液相色谱-质谱联用技术被广泛应用于需要高灵敏度、宽适用范围、复杂基质的多农药残留快速筛选工作中[15-17]。蜂王浆基质复杂,对样品前处理要求高,其农药残留的检测方法国内外虽有报道[4,9,13,18,19],但农残的品种和类别较为单一。2017年,国家卫生计生委发布了6个蜂王浆中农药残留量测定的食品安全国家标准[20],分别是GB 23200.98-2016、GB 23200.99-2016、GB 23200.100-2016、GB 23200.101-2016、GB 23200.102-2016和GB 23200.103-2016,大大增强了对蜂王浆中有机磷类、氨基甲酸酯类、菊酯类农药残留的质控力度。由于这些标准方法的前处理过程和检测手段各不相同,覆盖的农药品种有限,亟须从蜂农用药实际情况出发,增加不同类别的农药品种,开发出更简单、快捷、高效的蜂王浆中农药残留的检测方法。
本文根据我国蜂王浆中农药残留的状况,筛选出7种高风险农药品种,建立了高效液相色谱-串联质谱检测蜂王浆中7种高风险农药残留的分析方法。该法具有灵敏度高、准确性好的特点,能满足蜂王浆质量把关和出口检验的要求。
1 实验部分
1.1 仪器与试剂
Agilent 1200高效液相色谱仪(美国Agilent公司); API 3200串联四极杆质谱仪(美国Applied Biosystems公司); Sartorius B S224S分析天平(德国Sartorius公司); PHS 23C雷磁精密pH计(上海自动化仪表公司); RJ-TDL-40B低速台式大容量离心机(无锡市瑞江分析仪器有限公司); N-EVAP 111氮吹仪(美国Organomation公司)。
标准品:氟胺氰菊酯(CAS No.: 102851-06-9,纯度:94.0%)、三唑醇(triadimenol, CAS No.: 55219-65-3,纯度:99.0%)、蝇毒磷(coumaphos, CAS No.: 56-72-4,纯度:98.0%)、吡氟氯禾灵(haloxyfop, CAS No.: 69806-34-4,纯度:99.0%)、多菌灵(carbendazim, CAS No.: 10605-21-7,纯度:99.0%)、乙基硫菌灵(thiophanate-ethyl, CAS No.: 23564-06-9,纯度:98.5%)、甲基硫菌灵(thiophanate-methyl, CAS No.: 23564-05-8,纯度:99.0%)、氘代多菌灵(carbendazim-d4, CAS No.: 291765-95-2,纯度:98.5%)和氘代蝇毒磷(coumaphos-d10, CAS No.: 287397-86-8,纯度:99.0%)均购自德国Dr. Ehrenstorfer公司。甲醇、乙酸铵、甲酸和乙腈均为色谱纯(德国Merck公司);水为双重蒸馏水;氨水、无水硫酸钠、正丙醇均为分析纯。N-丙基乙二胺(PSA)、石墨化炭黑(GCB)、C18填料、C18固相萃取小柱(500 mg/3 mL)、HLB固相萃取小柱(200 mg/6 mL)均购自美国Waters公司。
蜂王浆样品由蜂农提供。
1.2 标准溶液的配制
以乙腈为溶剂分别配制7种农药的标准储备液(质量浓度均为1 mg/L);以乙腈为溶剂分别配制2种内标储备液(质量浓度均为1 mg/L)。用空白蜂王浆基质提取液将上述标准溶液稀释为内标含量相同的系列混合标准工作液(内标含量均为50 μg/kg, 7种农药的含量为5~100 μg/kg)。
1.3 样品前处理
准确称取蜂王浆试样2.00 g(精确至0.001 g),置于50 mL塑料离心管中,准确加入1 mg/L氘代多菌灵100 μL、1 mg/L氘代蝇毒磷100 μL和10 mL水,充分涡旋分散后,加入300 μL氨水,涡旋分散均匀后,加入10 mL乙腈,用力振摇3 min(约250次),使试样完全乳化溶解、无颗粒物。加入15 g无水硫酸钠,用力振摇5 min,以6 000 r/min离心5 min,收集上清液。残留物再用5 mL乙腈用力振摇提取3 min,以6 000 r/min离心5 min,合并两次上清液并完全转移至梨形瓶中,加入5 mL正丙醇,混合均匀后,于40 ℃减压浓缩至近干。
向上述梨形瓶中加入10 mL 50%(v/v)乙腈水溶液,超声5 min溶解残渣,以4 000 r/min离心5 min。用5 mL甲醇和5 mL水活化HLB固相萃取柱,取上述上清液上样,控制流速为1滴/s,用3 mL水淋洗小柱,再用2 mL空气吹干小柱,加入10 mL乙腈洗脱,收集全部洗脱液,于40 ℃氮吹至近干。用85%(v/v)乙腈水溶液复溶并定容至1 mL,过0.22 μm油系微孔滤膜,待测。
1.4 分析条件
色谱柱:Venusil MP C18色谱柱(150 mm×4.6 mm, 3 μm,美国Agela公司);柱温:30 ℃;流动相:A相为0.5 mmol/L乙酸铵水溶液(含0.1%(v/v)甲酸), B相为甲醇(含0.1%(v/v)甲酸);流速:0.7 mL/min。梯度洗脱程序:0~6.5 min, 95%A~50%A; 6.5~7.5 min, 50%A~5%A; 7.5~12.0 min, 5%A; 12.0~12.1 min, 5%A~95%A; 12.1~16.0 min, 95%A。进样量:40 μL。
离子源:电喷雾离子(ESI)源,正离子扫描;离子源温度:500 ℃;多反应监测(MRM)模式;雾化气、气帘气、辅助加热气、碰撞气均为高纯氮气;雾化气压力:414 kPa;辅助加热气压力:345 kPa;气帘气压力:69 kPa;碰撞气压力:35 kPa;电喷雾电压:4 500 V。7种农药的其他质谱参数见表1。

表 1 7种农药的监测离子对、去簇电压、碰撞室出口电压、碰撞能量、保留时间及对应的内标Table 1 Monitoring ion pairs, declustering potentials, collision cell exit potentials, collision energies, retention times and internal standards of the seven pesticides
* Quantitative ion.
2 结果与讨论
2.1 高风险农药品种的筛选
我国现行的食品中农药残留限量标准是《食品安全国家标准 食品中农药最大残留限量》(GB 2763-2016),其中没有明确规定蜂产品中的最大农药残留限量。但是从实际情况看,多菌灵被广泛使用在诸如油菜、玉米、柑橘、苹果、枣等蜜源植物中,而氟胺氰菊酯是养蜂过程中除螨的良好杀虫剂,被蜂农广泛使用。蜂王浆进口大国如日本、欧盟等对蜂王浆中农药残留的要求越来越严格,日本[21]很早就规定了蜂王浆中氟胺氰菊酯、蝇毒磷和三唑醇的限量要求;欧盟[22]规定了包括多菌灵在内的近137项农药残留要求。根据多批次蜂王浆实际检测情况,结合客户反馈的检测结果信息,确定了7种蜂王浆高风险农药残留品种。
2.2 基质效应的校正
当样品基质复杂时,在农药残留分析检测过程中基质易对检测结果造成干扰,难以对目标物进行准确定量。正确的前处理方法和分析手段可降低基质效应[23-25]。本文采用不含目标物的空白蜂王浆样品提取液配制系列基质标准溶液来校正回收率,并采用内标法定量,尽可能地降低基质效应对结果的影响。
2.3 提取溶剂的选择
常用的农药残留提取溶剂有二氯甲烷、三氯甲烷、丙酮、正己烷、乙腈和甲苯等。蜂王浆成分复杂,含有大量的蛋白质、脂类、脂肪酸和维生素等,pH范围为3.5~4.5。王祥云等[4]用正己烷-丙酮(1∶1, v/v)提取蜂王浆和蜂蜜中的氟胺氰菊酯残留;董盛月[9]用正己烷-二氯甲烷(1∶1, v/v)提取蜂王浆中的氟胺氰菊酯残留。因此本实验选用正己烷-丙酮(1∶1, v/v)、正己烷-二氯甲烷(1∶1, v/v)和乙腈作为提取溶剂,提取后不经净化直接测定7种农药的回收率,结果见表2。

表 2 采用不同提取溶剂时7种农药的回收率Table 2 Recoveries of the seven pesticides using different extraction solvents
The recoveries for the seven pesticides were obtained only by extraction procedure without purification.
由表2可知,3种提取溶剂的提取效果差异较大,以乙腈为最佳。这可能是由于正己烷-丙酮(1∶1, v/v)和正己烷-二氯甲烷(1∶1, v/v)易提取出蜂王浆中的脂质成分,与蜂王浆形成乳液,不易分层,导致农药残留被包合在蛋白质中而难以分离,而乙腈沉淀蛋白质的效果较好,对脂类物质的提取效率也低,提取时样液不容易乳化。因此选择乙腈作为提取溶剂。
2.4 净化条件的优化
用乙腈提取蜂王浆时,虽然7种农药残留的绝对回收率较其他溶剂高,但是由于基质效应的影响,仍然满足不了产品中农药残留限量的要求,因此必须对样品进行净化。
2.4.1 氨水体积的选择
根据前面的分析,研究了不同pH条件下7种农药的绝对回收率。依据经验[13],分别向样品中添加200、300和500 μL的氨水,样品与氨水混合后的pH值分别为6.5、8.0和8.7。通过比较,发现加入300 μL氨水时7种农药的绝对回收率最高,故选为实验所用。
2.4.2 无水硫酸钠添加量的选择
由于样品中含有水,在乙腈提取后,上层样液仍然含有水,溶于水的极性化合物会影响样品的净化效果。本研究考察了无水硫酸钠的添加量(10、15和20 g)对净化效果的影响。发现无水硫酸钠添加量为15 g时,可以完全脱除样液中的水,故选为实验所用。

表 3 采用不同固相萃取小柱时7种农药的回收率Table 3 Recoveries of the seven pesticides using different SPE cartridges
2.4.3 净化方式的选择
为进一步提高净化效果,在乙腈提取后,减压浓缩至近干,然后用50%(v/v)乙腈水溶液溶解,溶解液中加入填料PSA、GCB和C18等常用农药残留净化剂,发现质谱图中杂峰响应值无明显降低,净化效果不够明显,因此考虑用固相萃取小柱进行净化。向空白蜂王浆中添加混合标准工作液,使得7种农药的含量为50 μg/kg,以乙腈为提取液、减压浓缩至近干后用50%(v/v)乙腈水溶液复溶,然后分别采用C18固相萃取小柱和HLB固相萃取小柱进行净化,7种农药的回收率结果见表3。可以看出,采用HLB固相萃取小柱时7种农药的回收率更高、更稳定。因此选择HLB固相萃取小柱为净化柱。
2.5 色谱条件的优化
2.5.1 色谱柱的选择
采用高效液相色谱-串联质谱法检测药物残留,高效液相色谱条件是影响灵敏度的关键因素。分别采用Intersil C8-3(150 mm×4.6 mm, 5 μm,日本Shimadzu公司)、Venusil MP C18(150 mm×4.6 mm, 3 μm,美国Agela公司)、Atlantis C18(150 mm×4.6 mm, 5 μm,美国Waters公司)、Zorbax Eclipse XDB-C18(150 mm×4.6 mm, 5 μm,美国Agilent公司)和Ultimate XB-C18(200 mm×4.6 mm, 5 μm,美国Welch公司)色谱柱对目标物的分离效果进行考察,发现采用Venusil MP C18色谱柱时可完全分离7种目标物,峰形尖锐,灵敏度好,且色谱柱使用寿命长。故实验选择Venusil MP C18色谱柱。

表 4 7种农药的线性范围、回归方程、相关系数、检出限和定量限Table 4 Linear ranges, regression equations, correlation coefficients (r2), LODs and LOQs of the seven pesticides
y: peak area ratio of quantitative ions of analytes to the internal standard;x: content, μg/kg.
2.5.2 流动相的选择
考察了不同的有机相(甲醇或乙腈)和有机相、水相中分别添加甲酸、甲酸铵、乙酸铵对7种农药色谱峰形、分离度和离子化效率的影响。结果发现,水相为0.5 mmol/L乙酸铵(含0.1%(v/v)甲酸水溶液)、有机相为甲醇(含0.1%(v/v)甲酸)时,7种农药的峰响应最强,灵敏度最好,可达到基线分离。最优色谱条件下加标蜂王浆样品中7种农药(20 μg/L)的总离子流色谱图见图1。

图 1 加标蜂王浆样品中7种农药(20 μg/L)的总离子流色谱图Fig. 1 Total ion chromatogram of the seven pesticides spiked in a royal jelly sample (20 μg/L) 1. carbendazim; 2. thiophanate-methyl; 3. thiophanate-ethyl; 4. triadimenol; 5. coumaphos; 6. haloxyfop; 7. tau-fluvalinate.
2.6 质谱条件的优化
在ESI+模式下分别对7种农药标准溶液进行全扫描,确定准分子离子峰[M+H]+,调节离子源电压、去簇电压和碰撞室出口电压参数;以分子离子峰作为母离子进行子离子扫描,调节碰撞能量参数,以母离子的响应强度占子离子响应强度的1/3~1/4为最佳,谱图中选择2~4个信号较强的子离子作为定性离子,离子丰度最强的子离子作为定量离子,再进行锥孔电压和碰撞能量等质谱参数的优化。质谱参数确定后,取10 μg/L的混合标准溶液在优化后的色谱条件下逐个进行微调优化,使各种物质的灵敏度、峰形达到最佳。优化后的质谱参数见表1。
2.7 标准曲线和检出限
在1.3节和1.4节实验条件下,以空白蜂王浆基质提取液配制系列质量浓度的混合标准溶液进行测定。以目标物与内标物定量离子峰面积的比值(y)及其对应的含量(x, μg/kg)分别进行线性回归;以特征定量离子对色谱峰的信噪比(S/N)为3时计算检出限(LOD),以S/N=10时计算定量限(LOQ),结果见表4。结果表明,7种农药在5~100 μg/kg范围内线性关系良好,相关系数(r2)为0.992 1~0.999 6;方法的检出限和定量限分别为0.5~2.0 μg/kg和1.0~5.0 μg/kg,能够满足定量分析要求。
2.8 回收率和精密度
在蜂王浆空白样品中添加3个水平(5、20和50 μg/kg)的混合标准溶液,按照1.3节方法处理后进行加标回收试验,每个添加水平重复测定3次,加标回收率及其相对标准偏差见表5。3个添加水平下7种农药的加标回收率为80.5%~101.3%,相对标准偏差(RSD)为3.6%~9.4%。

表 5 加标蜂王浆样品中7种农药的回收率和精密度(n=3)Table 5 Recoveries and precisions of the seven pesticides spiked in blank royal jelly samples (n=3)
2.9 实际样品检测
按本文建立的方法对68批次蜂王浆样品进行测定,氟胺氰菊酯、多菌灵均有不同程度的检出,残留范围分别为10~170 μg/kg和9.5~83 μg/kg;蝇毒磷检出1批次,残留量较低,为5.2 μg/kg。其余4种农药均未检出。多菌灵和氟胺氰菊酯阳性样品的总离子流色谱图见图2。
该方法的建立,不仅能帮助蜂产品企业加强源头管理,把蜂产品质量隐患杜绝在萌芽中,也能指导合作社蜂农科学养蜂、合理用药,以便从源头上解决蜂产品农药残留超标问题。
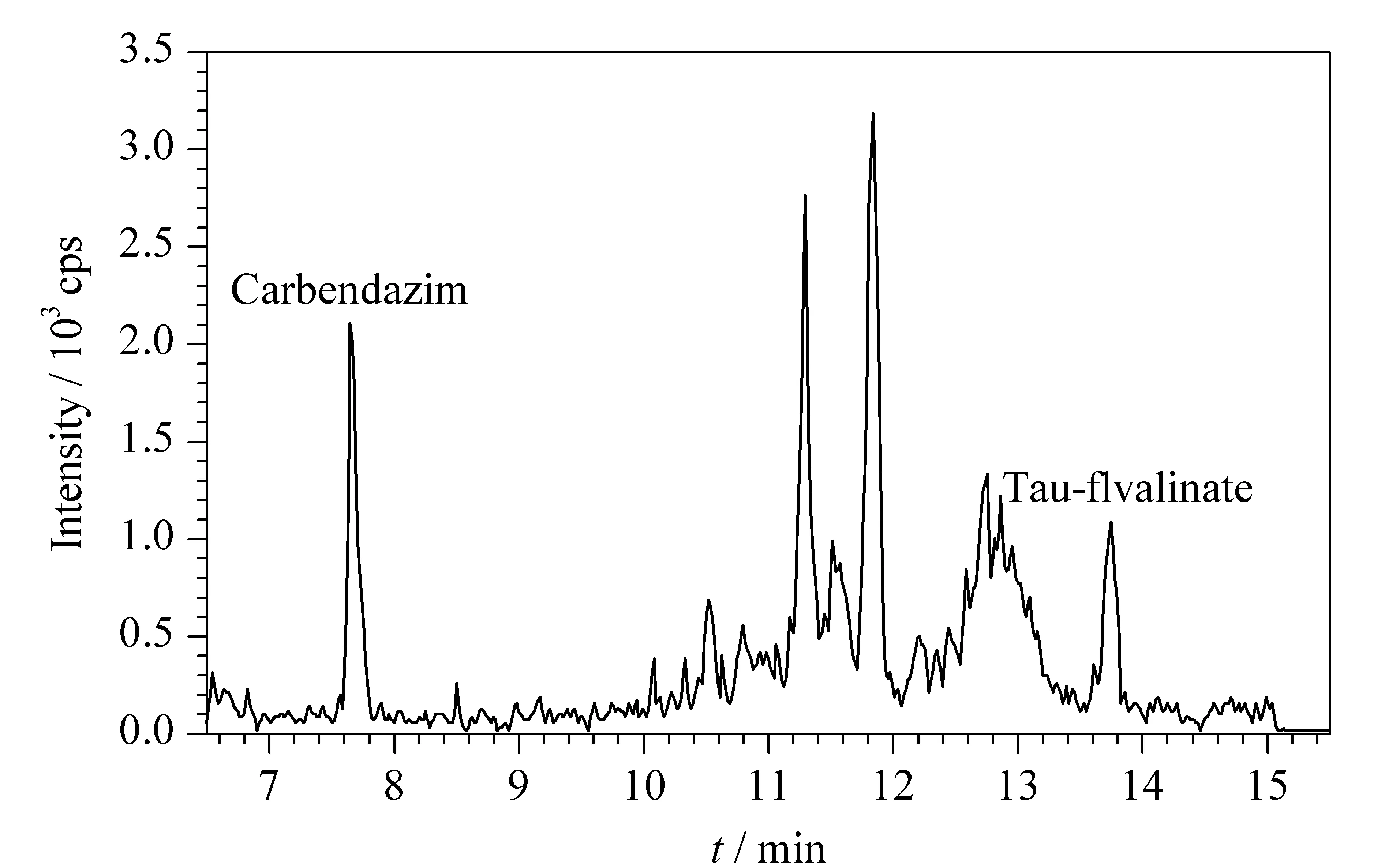
图 2 多菌灵、氟胺氰菊酯阳性样品的总离子流色谱图Fig. 2 Total ion chromatogram of a royal jelly samplein which carbendazim and tau-fluvalinate were detected
3 结论
本文建立了HLB固相萃取小柱净化,高效液相色谱-串联质谱同时测定蜂王浆中7种农药残留的检测方法。本方法简便、快速,重复性好,准确度高,是检测蜂王浆中7种农药残留的有效方法。
[1] China Food and Drug Administration. Bulletin on the four Batches of Unqualified Foods (No. 92 in 2016) by China Food and Drug Administration. (2016-05-31) [2017-09-15]. http://www.sda.gov.cn/WS01/CL1687/154420.html
国家食品药品监督管理局. 总局关于4批次食品不合格情况的通告(2016年第92号). (2016-05-31) [2017-09-15]. http://www.sda.gov.cn/WS01/CL1687/154420.html
[2] China Food and Drug Administration. Enforcement Regulation for National Food Safety Spot-Check Supervision (2017 Edition). (2017-02-21) [2017-09-15]. http://www.sda.gov.cn/directory/web/WS01/images/ufq80sqzxrewssirvOC2vbP pvOzKtcqpz7jU8qOoMjAxN8TqsOajqS5wZGY=.pdf
国家食品药品监督管理局. 国家食品安全监督抽检实施细则(2017年版). (2017-02-21) [2017-09-15]. http://www.sda.gov.cn/directory/web/WS01/images/ufq80sqzxrewssirvOC2 vbPpvOzKtcqpz7jU8qOoMjAxN8TqsOajqS5wZGY=.pdf
[3] Hu Y Q, Xi C X, Cao S R, et al. Chinese Journal of Chromatography, 2014, 32(7): 784
胡业琴, 郗存显, 曹淑瑞, 等. 色谱, 2014, 32(7): 784
[4] Wang X Y, Jin Y Y, Wang Z W, et al. Apiculture of China, 2017, 68(1): 54
王祥云, 金银银, 汪志威, 等. 中国蜂业, 2017, 68(1): 54
[5] Li S S, Li J T, Li C A, et al. Chinese Journal of Health Laboratory Technology, 2009, 19(2): 318
李四生, 李家涛, 李昌安, 等. 中国卫生检验杂志, 2009, 19(2): 318
[6] Xue X F, Zhao J, Qiu J, et al. Modern Scientific Instruments, 2005(1): 65
薛晓锋, 赵静, 邱静, 等. 现代科学仪器, 2005(1): 65
[7] Qu L, Li Y, Zeng J, et al. Chinese Journal of Chromatography, 2017, 35(7): 778
曲栗, 李优, 曾静, 等. 色谱, 2017, 35(7): 778
[8] Wang J, Ai L F, Ma Y S, et al. Chinese Journal of Chromatography, 2015, 33(11): 1175
王敬, 艾连峰, 马育松, 等. 色谱, 2015, 33(11): 1175
[9] Dong S Y. Food Science, 2009, 30(8): 272
董盛月. 食品科学, 2009, 30(8): 272
[10] Gu X Y, Qiu M Z, Liu Y Z, et al. Physical Testing and Chemical Analysis (Part B: Chemical Analysis), 2010, 46(7): 797
辜雪英, 仇满珍, 刘云珠, 等. 理化检验: 化学分册, 2010, 46(7): 797
[11] Zhao Z Y, Wu B, Shen C Y, et al. Apiculture of China, 2005, 56(5): 4
赵增运, 吴斌, 沈崇钰, 等. 中国养蜂, 2005, 56(5): 4
[12] Liu Y Q, Liu S, Xu W J, et al. Chinese Journal of Chromatography, 2017, 35(9): 941
刘永强, 刘胜, 许文娟, 等. 色谱, 2017, 35(9): 941
[13] Zhou P, Li Y H, Hu F L, et al. Food Science, 2013, 34(18): 180
周萍, 李英华, 胡福良, 等. 食品科学, 2013, 34(18): 180
[14] Liu Q, Liu L L, Zhou Y. Pesticide Science and Administration, 2014, 35(2): 22
刘谦, 刘丽丽, 周杨. 农药科学与管理, 2014, 35(2): 22
[15] Li C. Auhui Agricultural Science Bulletin, 2013, 19(8): 127
李畅. 安徽农学通报, 2013, 19(8): 127
[16] Timofeeva I, Shishov A, Kanashina D, et al. Talanta, 2017, 167(5): 761
[17] Behniwal P K, She J W. Int J Environ An Ch, 2017, 97(6): 548
[18] Martínezdomínguez G, Romerogonzález R, Garrido F A. Anal Methods, 2014, 6(14): 5376
[19] Martínezdomínguez G, Romerogonzález R, Garrido F A. Food Chem, 2016, 197(Part A): 907
[20] National Health and Family Planning Commission. Bulletin on the 107 National Food Safety Standards such as the National Food Safety Standard on Maximum Residue Limits (MRLs) in Food (GB 2763-2016) (No. 16 in 2016). (2017-02-09) [2017-09-15]. http://www.nhfpc.gov.cn/sps/s7891/ 201702/ed7b47492d7a42359f839daf3f70eb4b.shtml
国家卫生计生委. 关于发布《食品安全国家标准食品中农药最大残留限量》(GB 2763-2016)等107项食品安全国家标准的公告(2016年第16号). (2017-02-09) [2017-09-15]. http://www.nhfpc.gov.cn/sps/s7891/201702/ed7b47492d7a42359 f839daf3f70eb4b.shtml
[21] Japan Food Chemical Research Foundation. Positive List System for Agricultural Chemical Residues in Foods. (2016-09-16) [2017-09-15]. http://www.ffcr.or.jp/zaidan/ffcr-home.nsf/TrueMainE?OpenFrameSet
[22] EC 396/2005
[23] Li Y, Xu D M, Yi X H, et al. Chinese Journal of Chromatography, 2017, 35(4): 398
李优, 徐敦明, 伊雄海, 等. 色谱, 2017, 35(4): 398
[24] Zhao Z, Xu Y B, Liu X H, et al. Chinese Journal of Chromatography, 2017, 35(10): 1086
赵庄, 许杨彪, 刘向红, 等. 色谱, 2017, 35(10): 1086
[25] Bester K, Bordin G, Rodriguez A, et al. Fresen J Anal Chem, 2001, 371(4): 550
