绝经后女性膝骨关节炎性激素水平及其与年龄和病变程度的关系
2018-03-05刘亚平杜凯月郭洪敏聂志奎李健
刘亚平,杜凯月,2*,郭洪敏,聂志奎,李健*
(1.济宁市第一人民医院内分泌科,山东 济宁 272011;2.济南大学山东省医学科学院医学与生命科学学院,山东 济南 250062;3.济宁市第一人民医院骨关节外科,山东 济宁 272011)
近年来发现,卵泡刺激素受体(follicle-stimulating hormone receptor,FSHR)、黄体生成素受体(1uteinizing hormone receptor,LHR)可存在于性腺外组织,如脂肪[1]、肾脏[2-3]、平滑肌细胞、胃壁细胞[4]、胰腺[5]、颌下腺[6]、某些恶性肿瘤细胞表面[7]等,骨组织中也有表达[8]。绝经后女性体内雌激素水平下降,容易罹患骨质疏松症和骨关节炎,均是增龄性疾病,给人们生活带来极大困扰。增龄是骨关节炎发生发展的主要生物学因素,而肥胖是造成承重关节如膝关节发生骨关节炎的重要机械性因素。研究表明,雌激素水平下降而高促性腺激素分泌的绝经后女性,其体内潜在的卵泡刺激素(follicle-stimulating hormone,FSH)直接作用于成骨细胞和破骨细胞造成骨量明显减少,导致骨质疏松的发生发展[9]。那么绝经后女性FSH水平突然升高是否对膝关节骨关节炎(knee osteoarthritis,KOA)的发生及严重程度造成影响,目前未见报道。因此,作者观察绝经后女性膝关节骨关节炎不同年龄分层人群的性激素水平、KOA的临床症状和磁共振的变化,探讨FSH与临床症状和影像学严重程度的关系,评估其在KOA发病中的作用,为KOA的发病机制提供依据。
1 资料与方法
1.1 研究对象 选取自2016年1月至2016年12月在济宁市第一人民医院骨关节外科行膝关节置换术或保守治疗的50岁以上绝经后女性患者215例,按10岁为一组,分为三组。本研究纳入标准:符合1995年美国风湿病学会修订的膝关节骨关节炎诊断标准[10],对临床确诊为膝关节骨关节炎的患者进行WOMAC量表评分、X线拍片、膝关节磁共振T2-mapping成像。WOMAC量表可评估膝关节骨关节炎临床症状,包括疼痛积分(0~20分),僵硬积分(0~8分)和躯体功能积分(0~68分)3部分,24个参数,积分小于80分为轻度,积分80~120分为中度,积分大于120分为重度,积分越高表示骨关节炎的症状越重。按照Kellgren-Lawrence分级将X线片分为0-Ⅳ级(由2名独立的影像学医生按随机顺序分别对患者评级),其中0级正常,Ⅳ级关节破坏最严重。T2-mapping成像应用SIEMENS TrioTim 3.0T磁共振扫描仪,采用8回波FSE轴位扫描,扫描参数:TR=1 000 ms,TE=26 ms,层厚4.0 mm,层间距2 mm,FOV 16 cm×16 cm,矩阵320×192,NEX=1,扫描时间15 min。在GE ADW 4.5工作站上处理图像,由Functool软件包生成T2-mapping色阶图,由同一个人分别测量股骨内侧髁、外侧髁、髌骨内、外侧软骨的T2值,取四个部位的平均T2值,在T2-mapping图对应区域勾画兴趣区(region of interest,ROI),测量时尽量包括软骨全层。排除标准为:任何患有甲状腺功能亢进症、甲状旁腺功能亢进症、肝肾疾病、糖尿病、血脂异常等影响骨代谢疾病及服用雌激素治疗者、近3个月内有类固醇药物应用史予以排除。该研究获得医院伦理委员会批准,所有患者在纳入本研究之前均给予详细解释,并签署知情同意书。
1.2 检测指标 取空腹血清标本,采用罗氏Cobase 601免疫测定分析仪的电化学发光法检测卵泡刺激素(follicle-stimulating hormone,FSH)、黄体生成素(1uteinizing hormone,LH)、雌二醇(estradiol,E2),采用罗氏Cobas 8000全自动生化分析仪的酶比色法测定空腹血糖(fasting plasma glucose,FPG)、甘油三酯(triglyceride,TG)、总胆固醇(total cholesterol,TC)。
2 结 果
2.1 不同年龄分层人群的身高、体重、BMI、WOMAC评分、T2-mapping比较 绝经后女性KOA患者随着年龄增加,身高、体重、体重指数无显著变化,WOMAC评分、平均T2值显著增加(见表1)。
2.2 不同年龄分层人群的血糖、血脂、性激素水平变化 绝经后女性KOA患者随着年龄增加,甘油三酯、胆固醇、血糖无显著变化;血清FSH水平在50~60岁组最高,之后随着年龄增加,血清FSH浓度显著下降,与此同时,我们检测同期绝经前40~49岁女性KOA患者血清FSH水平(7.74±2.61)mIU/mL,与绝经后KOA患者各年龄组均有显著性差异。血清LH、E2在绝经后随年龄增加逐渐降低,LH下降有显著性,E2下降无显著性(见表2)。
2.3 不同血清FSH水平下WOMAC评分、T2值的变化 血清FSH按照高低分为两组,高FSH组(>40 mIU/mL)、低FSH组(<40 mIU/mL),高FSH组有50~60岁患者42例,61~70岁患者45例,大于70岁患者26例,低FSH组有50~60岁患者37例,61~70岁患者40例,大于70岁患者25例,与FSH>40 mIU/mL组比较,FSH<40 mIU/mL组的年龄差异无统计学意义,但WOMAC评分、T2值显著增加(见表3)。

表1 各年龄组研究对象的一般临床特征

表2 各年龄组研究对象的血脂、血糖、性激素水平比较

表3 FSH高低组的年龄、WOMAC评分、T2值比较

图1 矢状位T2-mapping示髌骨软骨形态规整,髌骨外侧处软骨增厚,信号均匀,相对应区域软骨下骨可见片状高信号影

图3 矢状位T2-mapping示髌骨外侧及股骨滑车外侧髁软骨缺损,为MRI Ⅳ级软骨病变
2.4 典型病例 a)54岁患者,右膝关节疼痛半年,上下楼及蹲起受限,FSH>40 mIU/mL,影像学资料见图1~2;b)68岁患者,右膝关节疼痛5年,活动受限,FSH<40 mIU/mL,影像学资料见图3~4。
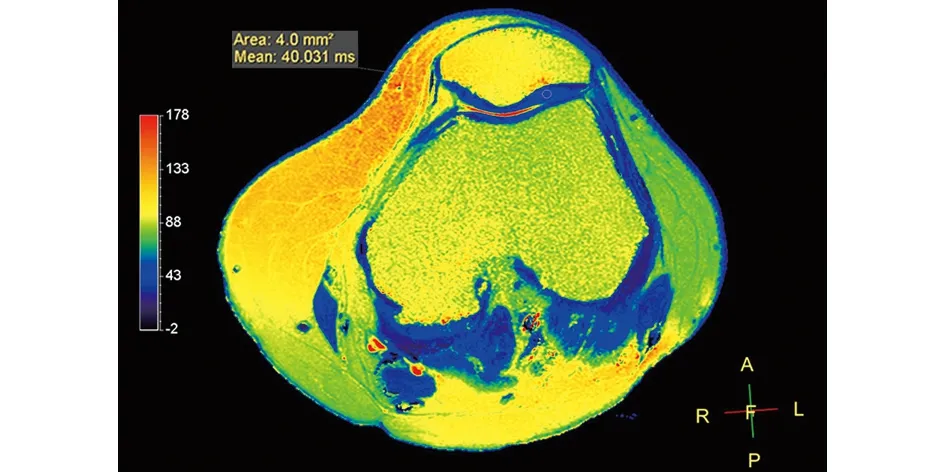
图2 轴位T2-mapping示髌骨软骨信号色阶均匀,边缘光滑,ROI T2值分别为35.027 ms、40.031 ms
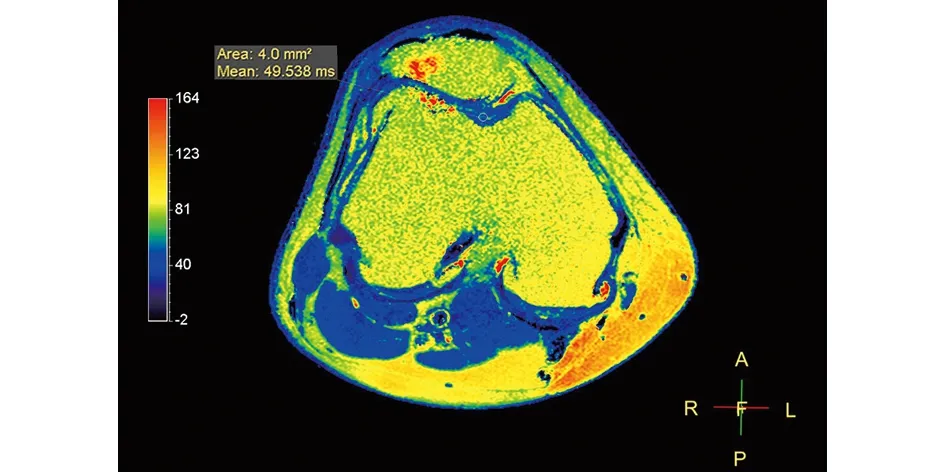
图4 轴位T2-mapping示髌骨软骨及股骨滑车外侧髁信号色阶不均匀,轮廓不整,髌骨外侧及股骨滑车外侧软骨局部缺损,邻近软骨T2值分别为47.536 ms、49.538 ms
3 讨 论
随着年龄增长,局部骨赘形成及骨关节炎患病率呈增高趋势,说明增龄是骨关节炎发生发展的主要生物学因素,而肥胖是造成骨关节炎发病的重要机械性因素。季锦飞[11]将35~70岁膝骨关节炎患者按照5岁为一组分组进行统计,发病年龄较早的骨关节炎患者比发病年龄较晚的患者BMI小,研究表明,随年龄增长,膝骨关节炎的BMI增加,发病年龄在60~70岁之间的BMI达到峰值,表明发病年龄越大,膝骨关节炎患者的机械因素影响越大。但这篇文章没有区分男女。另有彭小丁[12]观察长沙地区绝经前后女性FSH水平,将20~82岁女性以10岁为一组分组统计,BMI未见显著性差异。本研究观察到50岁以上绝经后女性膝骨关节炎患者,身高、体重、BMI未见显著性差异,与彭小丁观察一致。
FSH和LH是垂体分泌的糖蛋白激素,FSH刺激卵泡分泌雌激素,同时受雌激素负反馈调节。绝经时卵巢功能衰退,雌激素水平骤降,下丘脑-垂体轴负反馈调节降低,垂体前叶分泌的FSH大量增加,因此FSH升高也被看做绝经期标志。中国成年女性血清FSH大约在40岁之前处于较低水平,之后随年龄增长而快速增加,并达到一生中的最大值。大约从60岁开始又随年龄增长而下降,绝经后FSH是绝经前的7.3倍。彭小丁的报道也同样指出50~59岁年龄组的绝经后女性FSH水平最高。本研究观察绝经后女性KOA患者体内性激素水平,按年龄分层,50~60岁组、61~70岁组、大于70岁组FSH、LH呈显著下降趋势,E2水平低下,各组间差异无统计学意义。与前人研究结果相同,提示女性绝经后雌激素水平骤降,受负反馈影响FSH水平升高,但50~60岁呈现高峰,此后随年龄增长逐渐下降。
骨关节炎诊断通过临床表现及X线片、采用KL分级评估KOA严重程度。但传统的X线片无法直接显示膝关节软骨,尤其对早期KOA的诊断不敏感[13]。而膝关节磁共振T2mapping成像采用多回波序列测量组织的T2值,在KOA早期软骨没有发生形态学改变时T2值就会升高[14]。关节软骨早期损伤主要表现为胶原蛋白丢失、胶原纤维排列方式改变、水分增加,随着基质成分丢失,软骨表面摩擦及水分子通透性增高,均导致T2值升高。本研究观察绝经后女性KOA患者随年龄增加,WOMAC评分、平均T2值均显著增加,说明骨关节炎是随年龄增加的慢性、退行性、进行性疾病。
传统认为,绝经后雌激素水平下降是唯一的导致骨质疏松原因,骨吸收大于骨形成;垂体分泌的FSH,虽然受体内性腺激素负反馈,但其能直接增强破骨细胞的形成和功能,绝经后体内增高的FSH水平加速骨质疏松的发生[15]。Devleta B等人研究继发性闭经对骨密度的影响,绝经后女性根据FSH水平高低,分为高促性腺激素分泌组(FSH>40 mIU/mL)和低促性腺激素分泌组(FSH<40 mIU/mL),正常对照组为年龄40岁以下月经正常女性,研究发现绝经后女性腰椎骨密度明显低于正常组,高促性腺激素分泌组的腰椎骨密度明显低于低促性腺激素分泌组,高促性腺激素分泌组的FSH与腰椎骨密度呈明显负相关,而低促性腺激素分泌组并未发现明显相关性,结果提示高促性腺激素分泌的绝经后女性,其体内潜在的FSH直接作用于骨代谢造成骨量明显减少。但FSH是否对骨关节炎的发生造成影响未见报道。本研究观察到与高促性腺激素分泌组相比,绝经后女性低促性腺激素分泌组的WOMAC评分和T2值增高,同时排除年龄、雌激素的影响,提示FSH水平的下降,骨关节炎症状加重,具体作用机理目前不清楚。膝关节骨关节炎(KOA)相关的信号通路主要调控软骨细胞的增殖和凋亡,与软骨细胞增殖相关的信号通路主要是Notch信号通路[16-17]和Wnt信号通路[18-19];与软骨细胞凋亡相关的信号通路主要有趋化因子(基质细胞衍生因子1)/趋化因子受体4信号通路、TLR4信号通路、MAPKs信号通路;而同时调节软骨细胞增殖和凋亡的信号通路有Hippo-YAP信号通路和ERK 1/2信号通路。绝经后女性体内FSH与其受体相互作用是否干扰软骨增殖或凋亡的信号通路,从而减弱软骨细胞的增殖或加速软骨细胞的凋亡,加重KOA的发生,需要进一步研究证实。
[1]蔡婕.卵泡刺激素受体在脂肪组织和卵巢颗粒细胞的表达及其功能[D].杭州:浙江大学,2008.
[2]张哲,郑清莲.FSHR、LHR在大鼠肾脏组织的表达及相关研究[J].中医杂志,2009,50(S1):240-241.
[3]张哲,郑清莲,刘永惠.去卵巢大鼠肾脏组织表达FSHR、LHR[J].基础医学与临床,2012,32(10):1179-1182.
[4]白宏伟,陈蕾孙,绪德,等.大鼠胃促黄体生成素及其受体的免疫组化及原位杂交研究[J].第四军医大学学报,2008,29(15):1410-1412.
[5]初晨宇,吕葆真,孙岚,等.卵泡刺激素及其受体在大鼠胰腺的共定位观察[J].解剖学报,2005,36(3):303-304.
[6]陈蕾,白宏伟,孙绪德,等.大鼠颌下腺黄体生成素及其受体的定位、核心片段的克隆及序列分析[J].解剖学报,2007,38(5):572-576.
[7]Parrott JA,Doraiswamy V,Kim G,et al.Expression and action of both the follicle stimulating hormone receptor and the luteinizing hormone receptor in normal ovarian surface epithetlium and ovarian cancer[J].Mol Cell Endocrinol,2001,172(1-2):213-222.
[8]Sun L,Peng Y,Sharrow AC,et al.FSH directly regulates bone mass[J].Cell,2006,125(2):247-260.
[9]Devleta B,Adem B,Senada S.Hypergonadotropic amenorrhea and bone density:new approach to an old problem[J].J Bone Miner Metab,2004,22(4):360-364.
[10]Altman R,Asch E,Bloch D,et al.Development of criteria for the classification and reporting of osteoarthritis.Classification of osteoarthritis of the knee.Diagnostic and therapeutic criteria committee of the American rheumatism association[J].Arthritis Rheum,1986,29(8):1039-1049.
[11]季锦飞,戴进,史冬泉.遗传因素和机械因素与膝骨性关节炎发病年龄的关系[J].中华医学遗传学杂志,2010,27(6):672-674.
[12]彭小丁,袁凌清.长沙地区女性促卵泡刺激素水平与骨密度和骨质疏松患病率的关系[J].中国组织工程研究与临床康复,2009,13(33):6573-6576.
[13]Raynauld JP.Quantitative magnetic resonance imaging of articular cartilage in knee osteoarthritis[J].Curr Opin Rheumatol,2003,15(5):647-650.
[14]Li X,Benjamin MC,Link TM,et al.In vivo T(1rho) and T(2)mapping of articular cartilage in osteoarthritis of the knee using 3T MRI[J].Osteoarthritis Cartilage,2007,15(7):789-797.
[15]Devleta B,Adem B,Senada S.Hypergonadotropic amenorrhea and bone density:new approach to an old problem[J].J Bone Miner Metab,2004,22(4):360-364.
[16]Hosaka Y,Saito T,Sugita S,et al.Notch signaling in chondrocytes modulates endochondral ossification and osteoarthritis development[J].Proc Natl Acad Sci USA,2013,110(5):1875-1880.
[17]Fujimaki R,Toyama Y,Hozumi N,et al.Involvement of Notch signaling in initiation of prechondrogenic condensation and nodule formation in limb bud micromass cultures[J].J Bone Miner Metab,2006,24(3):191-198.
[18]Weng X,Lin P,Liu F,et al.Achyranthes bidentata polysaccharides activate the Wnt/β-catenin signaling pathway to promote chondrocyte proliferation[J].Int J Mol Med,2014,34(4):1045-1050.
[19]Li X,Peng J,Wu M,et al.BMP2 promotes chondrocyte proliferation via the Wnt/β-catenin signaling pathway[J].Mol Med Rep,2011,4(4):621-626.
