乳腺癌实验动物模型的研究进展
2018-03-05李日飞冶冬阳李日勇李姚涵左儒楠李引乾
李日飞,袁 娜,冶冬阳,3,李日勇,李姚涵,左儒楠,时 晰,陈 强,李引乾*
(1.西北农林科技大学动物医学院,陕西 杨凌 712100; 2.徐州医科大学,听觉与平衡医学研究所,江苏 徐州 221004; 3.江苏沿海地区农业科学研究所,江苏 盐城 224002; 4.北京大学医学部,北京 100191)
乳腺癌是全球第二大最常见的癌症,2012年全球乳腺癌新发病例达1670万[1],且乳腺癌的发病率每年呈逐渐攀升趋势。据美国癌症协会统计,2015年仅美国女性乳腺癌新发病例已经超过231000人,男性患者乳腺癌新发病例约为2350人[2]。随着乳腺癌相关研究的不断深入,乳腺癌动物模型得到了广泛应用,在严格控制有关条件的情况下,进行乳腺癌发生发展规律以及药物作用机制等基础实验研究,然后进一步作临床观察,以寻找预防治疗乳腺癌的有效措施。一个理想的动物模型对研究人类疾病有及其重要的作用,本文就乳腺癌实验动物模型的制作与评价研究现状作一综述。
1 自发性实验动物乳腺癌模型
自发性乳腺癌是指未经人工干预,在一定年龄阶段自然发生的一类癌症。目前已培育出小鼠自发性乳腺癌品系有C3H系、A系、CBA/J系以及TA2系等,大鼠自发性乳腺癌品系有F334系、ACI系、Wistar大鼠以及SD大鼠等[3]。TA2小鼠是天津医科大学培育的近交系小鼠,基因表型稳定,在无任何外来化学药物等诱癌刺激下,具有很高的自发性乳腺癌发生率,且病理学分析表明TA2小鼠乳腺癌细胞呈三阴性[3]。经产TA2小鼠自发性乳腺癌发病率达84.1%,乳腺癌发生的平均时间为330 d以内;处女TA2小鼠自发性乳腺癌发病率达41.4%,乳腺癌发生的平均时间为450 d以内;雄性TA2小鼠乳腺癌发病率达32%,乳腺癌发生的平均时间为479 d以内[3]。SP1细胞系来源于自发性的无免疫原性和无转移性患有管内乳腺癌的18月龄CBA/J雌性小鼠体内,这种小鼠模型非常适合具有转移性和免疫原性乳腺癌的相关研究[4]。来自于BALB/C处女雌性小鼠M05肿瘤细胞是另一种含有被证实染色体组型的自发性乳腺癌模型[5],M05肿瘤含有两个不同的细胞系:具有上皮细胞特征的细胞系(LM05-E)和成纤维细胞系(LM05-F)[4]。C3H小鼠自发性乳腺癌发病率高,6~10个月龄雌性小鼠乳腺癌自然发生率达85%~100%,乳腺癌通过乳汁而不是胎盘途径传播[6],因而是常用的自发性乳腺癌模型动物。
自发性乳腺癌动物模型有其极大的优势,这种动物最大的特点是无需经人工干预,在一定年龄阶段就可自然发生。从乳腺癌发生学上来看,这些自发性乳腺癌与人体乳腺癌相近,应用自发性乳腺癌实验动物可进行乳腺癌病因、发病、防治及抗癌药物筛选的研究。但自发性乳腺癌动物模型也有缺点,不同实验动物个体因受到各种因素的影响,乳腺癌发生存在差异,实验周期长,花费较多。
2 诱发性实验动物乳腺癌模型
人工诱导(物理、化学及生物因素等)实验动物发生乳腺癌最常用的方式是化学诱导。诱导性乳腺癌动物模型可通过给动物注射二甲基苯蒽(7, 12-dimethylbenz(a)anthracene,DMBA)或N-甲基-N-亚硝基脲(N-nitoso-N-methylurea,NMU)而建立[7]。处女雌性(BALB/cDBA/2) F1代杂交小鼠注射二甲基苯蒽(DMBA)可诱发潜伏期为7个月的乳腺癌[4]。SD大鼠尾静脉注射NMU (50 mg/kg), 乳腺肿瘤约在14~21周出现,醋酸甲羟孕酮(medroxyprogesterone acetate,MPA)与二甲基苯蒽(DMBA)联合应用可使乳腺癌发生的潜伏期缩短至3个月,增加了乳腺癌的发病率[4]。致癌物质二甲基苯蒽(DMBA)可诱导乳腺癌中细胞周期蛋白1(cyclin D1)和原癌基因(c-Myc)的表达增加[8]。BALB/c小鼠持续使用醋酸甲基孕酮(MPA)可诱导具有1年潜伏期乳腺癌的发生,且发病率为79%[9]。盛佳钰等[10]选择顺铂(DDP)低剂量诱导及体内外交叉致瘤结合的方法建立三阴性乳腺癌耐药小鼠模型,该模型的特点是在传统的化疗药物单纯诱导的基础上进行改进,增加了体内外交叉致瘤的方法,逐步提高耐药性,并缩短了致瘤时间,为三阴性乳腺癌临床个体化治疗及耐药逆转研究等提供参考。骨化三醇处理的乳腺癌大鼠模型,其肿瘤潜伏期明显扩大,肿瘤的发生率及多样性降低,同时导致用NMU处理的肿瘤也大量发生退化[11]。
诱发性乳腺癌实验动物模型较容易制作,诱变剂选择范围大且较稳定,我们可以根据研究的需要,使用不同的诱变剂,从而制作出所需的实验动物模型。注射化学药物一段时间后,肿瘤便会出现,但是肿瘤的发生位点却是不可预知的,同一动物可能有多个肿瘤出现。此外,因实验动物个体差异以及诱变剂的类型,肿瘤的发生和潜伏期都存在差异,诱发模型参差不齐,对人体乳腺癌的精准研究造成了一定影响。化学诱导模型主要用于乳腺癌预防及早期致癌因素的研究,但通常不用于抗癌药物的研究[7]。
3 移植性实验动物乳腺癌模型
移植性实验动物乳腺癌模型是将乳腺癌组织或细胞接种于实验动物而培养出来的模型,其有很多优点[7]:①可获得乳腺癌细胞系;②肿瘤细胞可以在同一天移植入实验动物的一个特异性位点;③肿瘤细胞生长可在不同动物间进行复制。移植性模型是目前最常用实验动物肿瘤模型,尤其是人类异种移植物模型[12],其根据移植物来源不同可分为同种移植物模型和异种移植物模型。
3.1 同种移植物模型
同种移植物模型是将实验动物(如啮齿类动物)乳腺癌的细胞系或组织接种至同种或同品系免疫功能正常的动物体内[13]。目前已经建立了一些同种移植物模型,如小鼠4T1模型,4T1细胞系是从来源于自发性乳腺癌Balb/cfC3H小鼠品系的一个亚群体系中分离得到的[7]。有证据表明,4T1小鼠乳腺癌细胞系移植入免疫功能正常的同品系小鼠体内,从而来模拟人乳腺癌发展和转移情况,此种方法比将人乳腺癌细胞系(异种移植物)移植入免疫功能缺陷小鼠体内,以此来观察肿瘤发展和转移情况更加有效[14]。源自于小鼠乳腺癌的细胞系(如来源于BALB/c近交系小鼠的4T1细胞或C57/BLk6近交系小鼠的E0771细胞)已经在相关文献中广泛报道和利用,从而使具有这种细胞系的同品系小鼠模型的适用性得到了该领域学术界的认可和接受[14]。
这种模型将来源于小鼠的乳腺癌细胞移植入同品系小鼠体内有两个好处[14]:首先,同种移植物模型利用免疫功能正常的小鼠,从而来评价在乳腺癌发生发展进程和转移过程中免疫应答的作用[15];其次,同种移植物模型可使实验动物产生相同的肿瘤,这些肿瘤体积大,肿瘤生长速度和转移速度也较异种移植物模型快,临床应用效果较异种移植更有效。同种移植模型是模拟癌症发生发展的重要策略,对研究人类乳腺癌有很重要的作用。然而,同种移植物模型也有一定的局限性:小鼠乳腺癌与人类乳腺癌存在一定的差异,小鼠乳腺癌是以癌症研究工具为手段人工制作的疾病模型,而不是自然发生的疾病。此外,人和小鼠的乳腺癌基质细胞也存在差异,例如间充质干细胞(masenchymal stem cells)的恶性转化程度也不一样[16]。
3.2 异种移植物模型
异种移植物模型是将人类的乳腺癌细胞或组织移植入免疫缺陷型实验动物体内[13]。目前,在大多数乳腺癌临床前试验研究中,MCF-7、T47-D和MDA-MB-231这3种人类乳腺癌细胞系应用的最广[7]。实验动物多为免疫缺陷型品系的啮齿类动物,两种最常用的品系分别是重症联合免疫(severe combined immune deficiency,SCID)小鼠和裸鼠品系[17]。Ji等[18]在人类乳腺癌异种移植小鼠上研究了持续使用TM208药物治疗乳腺癌的耐药性情况,并且鉴定了肿瘤pEGFR表达水平与肿瘤生长抑制的关系。Yen等[19]研究了将良性和恶性的肿瘤移植物植入裸鼠体内来制造裸鼠移植物模型,从而通过造影剂为恶性肿瘤的病变提供一个初步筛选的工具。具体做法是将具有分裂特征的纤维瘤细胞的恶性移植物(细胞和MDA-MB231细胞)和良性移植物同时移植入裸鼠的两侧,移植成功率可达90%。5周之后,声波图上显示,良性和恶性移植物的体积达到4 cm3(直径约2 cm),使人的肿瘤在裸鼠体内得到了较好的复制,该研究为人类疾病的治疗提供了参考。Xin等[20]将200 μL MCF-7细胞悬液(5×106)注射入雌性裸鼠左胸廓乳腺脂肪垫中,一段时间后肿瘤的大小可达到100~300 mm3,以此为动物模型来研究槲皮素(Qu)在乳腺癌治疗上的作用。
在癌症研究中,将永生化的人乳腺癌细胞系移植入免疫功能不全鼠科动物体内制作的乳腺癌动物模型是最简单、最常用的模型系统[4]。细胞系异种移植物模型是连接体内和体外研究重要的桥梁[21]。细胞系异种移植物模型明显的优势表现在以下3个方面:①清楚的了解人乳腺癌细胞系的特征;②模拟人肿瘤的特征;③降低研究成本,可快速诊断。然而,异种移植物模型也有其不足之处,尤其在新药研发方面有致命的弱点,临床前研究与临床用药结果有差异[22]。细胞系异种移植物模型的局限性表现在以下几个方面:①免疫缺陷动物肿瘤的发生导致来自免疫系统对癌症发生、发展及治疗反应的主要作用被忽视;②人的肿瘤与动物基质之间联系中断;③部分移植物存在免疫排斥反应,裸鼠存活率低;④高度的同质性,在临床乳腺肿瘤中很难反应瘤内的异质性。
4 乳腺癌远处转移实验动物模型
乳腺癌转移实验动物模型有多种形式,主要包括肺转移、脑转移、肝转移等动物模型,但其中以骨转移实验动物模型研究最为广泛。
4.1 乳腺癌肺转移实验动物模型
乳腺癌肺转移实验动物模型可通过皮下、乳垫原位及尾静脉接种乳腺癌细胞而建立[23]。曹让娟等[24]利用慢病毒载体获得了能够稳定表达GFP的乳腺癌细胞系,将此细胞以皮下注射方式接种于BALB/c裸鼠皮下,从而建立自发性乳腺癌肺转移模型,8周后在原位形成直径约15 mm的肿瘤块,病理剖检肺部肉眼未见转移灶,但在激发光(448 nm)下可见转移灶呈绿色点状分布。杜鹃等[25]GFP-MDA-MB-231-HM(对照组)和FOXC1-MD A-MB-231-HM(实验组)单细胞悬液(每毫升2×107)接种于裸鼠左侧第二乳头的脂肪垫,并观察肿瘤细胞的成瘤性,对照组肺部有明显的转移灶形成,而实验组基本无转移灶,说明FOXC1能够明显抑制乳腺癌的肺转移。龚宏霞等[26]将第3代处于对数生长期的4T1-luc细胞用PBS稀释至每毫升1×106细胞,0.1 mL细胞悬液通过尾静脉接种于BALB/c小鼠(相当于每只BALB/c小鼠接种1×105个4T1-luc细胞),制作小鼠乳腺癌实验性肺转移模型,接种21 d后小鼠乳腺癌肺转移率高达100%,组织病理学观察可见肺内有肿瘤细胞转移灶,与正常肺组织相比,转移瘤细胞排列紧密、核大深染、核膜清晰、核仁明显,分裂相多见,病理组织学诊断为浸润性癌巢。这三种方法建立的乳腺癌实验性肺转移模型,为进一步研究乳腺癌的发病机理及治疗提供了良好的动物模型。
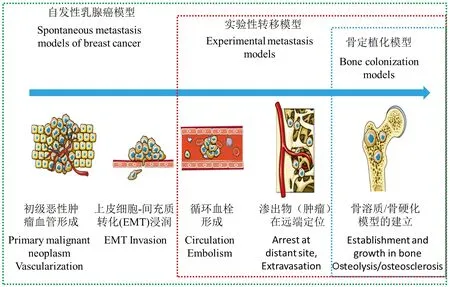
图1 乳腺癌骨转移模式图Fig.1 A model sketch of breast cancer-induced bone metastasis
4.2 乳腺癌肝转移实验动物模型
乳腺癌肝转移实验动物模型可通过门静脉接种及瘤组织肝脏内接种而建立[27]。Goddard等[28]为了提高乳腺癌肝转移模型的建模效率及可实用性,采用小鼠门静脉注射的方法使肿瘤细胞直接富集在肝脏部位。具体做法是将三种同源性乳腺肿瘤细胞系 (D2A1, D2.OR和4T1) 经门静脉接种于免疫良好的BALB/c小鼠,制作乳腺癌肝转移模型,病理组织学观察表明3种细胞不同程度发生了较高的乳腺癌肝转移,门静脉接种是乳腺癌肝转移模型的重要建模手段,可能也适用于其它癌症肝转移模型的建立。胡孝渠等[29]利用Her2阳性细胞系SKBr-3成功建立自发性乳腺癌肝转移模型,方法是采用瘤组织裸鼠体内反复传代的方法(第一代原位乳腺癌模型
4.3 乳腺癌骨转移实验动物模型
乳腺癌骨转移模型在女性中的发病率高达80%,但目前乳腺癌骨转移的预防和治疗还受到一定的限制。针对乳腺癌骨转移模型机制的研究是目前国内外学者研究的热点。如图1是乳腺癌骨转移模型机制的模式图[30]。
乳腺癌骨转移模型的建模方法有多种形式,主要包括,末梢器官骨定殖模型:骨内注射法、自发性骨转移模型:原位注射法、试验性骨转移模型:系统(全身)注射法,全身注射又分为尾静脉注射和动脉或左心室注射。Sloan等[31]通过对高表达αvβ3蛋白的雌性Balb/c小鼠胫骨上端注射乳腺上皮细胞系66cl4,结果显示表达αvβ3整合素对破骨细胞招募及骨吸收有促进作用。Zibly等[32]通过皮下将同品系鼠乳腺癌细胞系13762经Fisher 344鼠右后肢注射其体内获得肿瘤,将肿瘤(实体瘤)切割后经骨内注射移植入同品系鼠的胸腰椎骨。结果显示,移植入椎骨中的肿瘤生长与脊髓压迫综合症自然发病过程的复制是相一致的。Ghajar等[33]为了研究存在在骨中隐匿散布的肿瘤细胞,他们将能够表达绿色荧光蛋白(GFP)的MDA-MB-231细胞原位注射至非肥胖性糖尿病联合免疫缺陷(NOD/SCID)的小鼠乳腺中。结果发现,GFP阳性和Ki67阴性细胞群聚集在股骨和胫骨骨髓的微血管内皮上。一些研究者将新鲜的来源于病人的肿瘤细胞和组织进行原位移植,但是自发性骨转移模型复制成功的却很少。DeRose等[34]从来自49例不同乳腺癌病人的原发性或转移性肿瘤样品中,分离得到一系列的细胞系,然后将其移植到雌性NOD/SCID小鼠中,但仅仅只有一个原始细胞系(HCI-007)在2只小鼠中有自发性骨转移。在制作骨转移模型的过程中,有时会发生肺转移,但一些研究表明乳腺癌更容易向骨转移。Garcia等[35]通过荧光成像证明了通过给动物侧部尾静脉注射B02细胞后,在注射后第一个3 h内发现肺部有荧光,但向骨转移更为明显。乳腺癌骨转移模型使用最广泛且可信的方法是心脏注射。一些乳腺癌细胞系经心脏注射可在骨骼上成功复制出溶骨病变模型,并且已经用于乳腺癌介导的骨转移的预临床研究[36]。乳腺癌骨转移模型在动物模型中不是很常见,但目前是人们研究的热点问题。乳腺癌骨转移模型对鉴别和检查人乳腺癌骨转移发生发展有一定的作用,但这种模型的复制较为困难,容易发生他处转移,所以理想的骨转移模型还需人们进一步研究和探索。
5 乳腺癌转基因实验动物模型
转基因动物模型是指将一个外源基因插入动物的DNA中,使得含有该基因的编码蛋白质高表达或低表达,从而来研究其在致癌过程中的作用[7]。这种模型选择的动物大都为小鼠,且研究的多数蛋白质受鼠乳腺肿瘤病毒(mouse mammary tumor virus, MMTV)启动子的控制[37],MMTV控制的致癌基因可导致各种乳腺癌的发生。脂连接蛋白(adiponectin, APN)在健康人血液中高表达,而在乳腺癌病人中表达较低。Denzel等[38]将鼠乳腺肿瘤病毒(MMTV)调控元件PyV-mT致癌基因插入APN裸鼠体内,从而建立了裸鼠乳腺癌模型,然后检测肿瘤发生、动力学及动物存活数。结果显示,在APN裸鼠中,MMTV-PyV-mT诱导肿瘤发生延迟,同时肿瘤的生长率也降低了。MMTV-Wnt-1转基因小鼠是研究乳腺癌发病机理,Wnt信号通路与乳腺癌关系及抗乳腺癌药物研究与筛选的良好动物模型[39]。转基因动物模型的蛋白修饰可以使乳腺癌的发病率提高,这可能会导致其他肿瘤也同时发生。乳腺癌转基因实验动物模型的优点是复制肿瘤的成功率高,结果可靠,但其价格昂贵,技术要求较高,复制容易发生转移,肿瘤的发生位点有不可预知性[7]。
6 结语
以上综述了5种乳腺癌实验动物模型,其各有优缺点。研究者应根据实验研究的需要,而选择不同的动物模型制作方法。一个理想的动物模型应尽可能与人类疾病相一致,这样所研究出来的成果才能应用到人类疾病的诊断和治疗上。随着生物技术与实验动物学的不断发展,乳腺癌的研究也越来越深入,研究方法也在不断的完善,对实验动物模型选择应更为严格。因此,研究工作者要在动物模型制作上进行创新或在原有基础上进行改造,制作出与人类疾病尽可能相同的动物模型,这对人类疾病诊断和治疗具有重要意义。
[1] Ferlay J, Soerjomataram I, Dikshit R, et al. Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012 [J]. Int J Cancer, 2015, 136(5): E359-E386.
[2] American Cancer Society. Cancer Facts & Figures 2015 [M]. Atlanta, GA: American Cancer Society, 2015.
[3] Sun B, Zhang S, Zhang D, et al. Identification of metastasis-related proteins and their clinical relevance to triple-negative human breast cancer [J]. Clin Cancer Res, 2008, 14(21): 7050-7059.
[4] Fabris VT. From chromosomal abnormalities to the identification of target genes in mouse models of breast cancer [J]. Cancer Genet, 2014, 207(6): 233-246.
[5] Simian M, Manzur T, Rodriguez V, et al. A spontaneous estrogen dependent, tamoxifen sensitive mouse mammary tumor: a new model system to study hormone-responsiveness in immune competent mice [J]. Breast Cancer Res Treat. 2009, 113(1): 1-8.
[6] 邹移海. 实验动物学 [M]. 北京,科学出版社, 2012.
[7] Mollard S, Mousseau Y, Baaj Y, et al. How can grafted breast cancer models be optimized? [J]. Cancer Biol Ther, 2011, 12(10): 855-864.
[8] Currier N, Solomon SE, Demicco EG, et al. Oncogenic signaling pathways activated in DMBA-induced mouse mammary tumors [J]. Toxicol Pathol, 2005, 33: 726-737.
[9] Lanari C, Molinolo AA, Pasqualini CD. Induction of mammary adenocarcinomas by medroxyprogesterone acetate in BALB/c female mice [J]. Cancer Lett, 1986, 33(2): 215-223.
[10] 盛佳钰, 陈红风. 顺铂诱导三阴性乳腺癌4T1耐药小鼠模型的建立 [J]. 中国实验动物学报, 2015, 23(5): 466-473.
[11] Krishnan AV, Swami S, Feldman D. Equivalent anticancer activities of dietary vitamin D and calcitriol in an animal model of breast cancer: Importance of mammary CYP27B1 for treatment and prevention [J]. J Steroid Biochem Mol Biol, 2013, 136: 289-295.
[12] Lacroix M, Leclercq G. Relevance of breast cancer cell lines as models for breast tumours: an update [J]. Breast Cancer Res Treat, 2004, 83(4): 249-289.
[13] Pearson HB, Pouliot N. Modeling metastasis in vivo - Madame Curie Bioscience Database-NCBI Bookshelf [M]. Landes Bioscience, 2000.
[14] Rashid OM, Takabe K. Animal models for exploring the pharmacokinetics of breast cancer therapies [J]. Expert Opin Drug Metab Toxicol, 2015, 11(2): 221-230.
[15] Ottewell PD, Coleman RE, Holen I. From genetic abnormality to metastases: murine models of breast cancer and their use in the development of anticancer therapies [J]. Breast Cancer Res Treat, 2006, 96(2): 101-113.
[16] Rosland GV, Svendsen A, Torsvik A, et al. Long-term cultures of bone marrow-derived human mesenchymal stem cells frequently undergo spontaneous malignant transformation [J]. Cancer Res, 2009, 69(13): 5331-5339.
[17] Clarke R. The role of preclinical animal models in breast cancer drug development [J]. Breast Cancer Res, 2009, 11(Suppl 3): S22.
[18] Ji XW, Ji SM, Li RT, et al. Pharmacokinetic-pharmacodynamic modeling of the antitumor effect of TM208 and EGFR-TKI resistance in human breast cancer xenograft mice [J]. Acta Pharmacol Sin, 2016, 37(6): 825-833.
[19] Yen TH, Lee GD, Chai JW, et al. Characterization of a murine xenograft model for contrast agent development in breast lesion malignancy assessment [J]. J Biomed Sci, 2016, 23(1): 46.
[20] Xin Z, Wang Q, Yang S, et al. Quercetin inhibits angiogenesis by targeting calcineurin in the xenograft model of human breast cancer [J]. Eur J Pharmacol, 2016, 781: 60-68.
[21] Frese KK, Tuveson DA. Maximizing mouse cancer models [J]. Nat Rev Cancer, 2007, 7(9): 645-658.
[22] Sharpless NE, Depinho RA. The mighty mouse: genetically engineered mouse models in cancer drug development [J]. Nat Rev Drug Discov, 2006, 5(9): 741-54.
[23] Vargo-Gogola T, Rosen JM. Modelling breast cancer: one size does not fit all [J]. Nat Rev Cancer, 2007, 7(9): 659-672.
[24] 曹让娟, 翟艳华, 卿旭, 等. 乳腺癌细胞 MDA-MB-231 肺转移模型的建立及其评价[J]. 吉林大学学报: 医学版, 2011, 37(3): 403-406.
[25] 杜娟. FOXC1抑制乳腺癌体内肺转移及CARM1通过位点特异性甲基化HP1γ抑制肿瘤细胞的衰老和SAHF [D]. 东北师范大学, 2012.
[26] 龚宏霞, 林洪生, 张英, 等.小鼠乳腺癌4T1-luc细胞实验性肺转移模型的建立及其评价 [J]. 现代肿瘤医学, 2015, 23(6): 735-737.
[27] Price JE. Metastasis from human breast cancer cell lines [J]. Breast Cancer Res Treat, 1996, 39(1): 93-102.
[28] Goddard ET, Fischer J, Schedin P. A portal vein injection model to study liver metastasis of breast cancer [J]. J Vis Exp, 2016, (118): 54903..
[29] 胡孝渠, 宋尔卫,陈积圣,等.原位小鼠乳腺癌肝转移模型[J].广东医学, 2006, 27(4): 454-455.
[30] Thibaudeau L, Quent VM, Holzapfel BM, et al. Mimicking breast cancer-induced bone metastasis in vivo: current transplantation models and advanced humanized strategies [J]. Cancer Metastasis Rev, 2014, 33(2-3): 721-735.
[31] Sloan EK, Pouliot N, Stanley KL, et al. Tumor-specific expression of αvβ3 integrin promotes spontaneous metastasis of breast cancer to bone [J]. Breast Cancer Res, 2006, 8(2): R20.
[32] Zibly Z, Schlaff CD, Gordon I, et al. A novel rodent model of spinal metastasis and spinal cord compression [J]. BMC Neurosci, 2012, 13: 137.
[33] Ghajar CM, Peinado H, Mori H, et al. The perivascular niche regulates breast tumour dormancy [J]. Natcell Biol, 2013, 15(7): 807-817.
[34] DeRose YS, Wang G, Lin YC, et al. Tumor grafts derived from women with breast cancer authentically reflect tumor pathology, growth, metastasis and disease outcomes [J]. Nat Med, 2011, 17(11): 1514-1520.
[35] Garcia T, Jackson A, Bachelier R, et al. A convenient clinically relevant model of human breast cancer bone metastasis [J]. Clin Exp Metast, 2008, 25(1): 33-42.
[36] Ono K, Akatsu T, Murakami T, et al. Involvement of cyclo-oxygenase-2 in osteoclast formation and bone destruction in bone metastasis of mammary carcinoma cell lines[J]. J Bone Miner Res, 2002, 17(5): 774-781.
[37] Kim IS, Baek SH. Mouse models for breast cancer metastasis [J]. Biochem Biophys Res Commun, 2010, 394(3): 443-447.
[38] Denzel MS, Hebbard LW, Shostak G, et al. Adiponectin deficiency limits tumor vascularization in the MMTV-PyV-mT mouse model of mammary cancer [J]. Clin Cancer Res, 2009, 15(10): 3256-3264.
[39] 孙强, 王晓辉, 闫志峰, 等. MMTV-Wnt-1转基因小鼠作为高发乳腺癌动物模型的观察 [J]. 中国实验动物学报, 2002, 10(3): 151-154.
