自体骨膜促进兔肩袖腱骨愈合的疗效
2018-03-05戴海峰刘莎莎王智慧
赵 杨,戴海峰,刘莎莎,王智慧,李 嘉
(承德医学院附属医院,河北 承德 067000)
手术治疗已经成为肩袖撕裂的首选治疗方式,然而,无论选择何种手术方案其术后肩袖再撕裂率在38%~90%之间[1]。如何提高肩袖修复术后的腱-骨界面的愈合能力是目前运动医学研究焦点,随着现代组织工程学和生物技术的发展,新的修复技术和材料为解决这一问题提供了思路和方法[2-3],间充质干细胞(mesenchymal stem cells, MSCs),小肠黏膜下层(small intestinal submucosa, SIS),富血小板血浆(platelet-rich plasma, PRP)等得以开发应用以促进腱-骨愈合,但对其效果优劣尚无统一定论。骨膜具有很强的成骨潜能,最新研究表明[4],骨膜移植物可以提供未分化细胞填充腱骨界面间隙,促进腱骨愈合。因此,本研究使用自体骨膜补片加强修复兔急性肩袖撕裂,通过组织学观察和生物力测试证实自体骨膜补片可以有效地促进肩袖腱骨愈合,提高其生物学特性。报道如下:
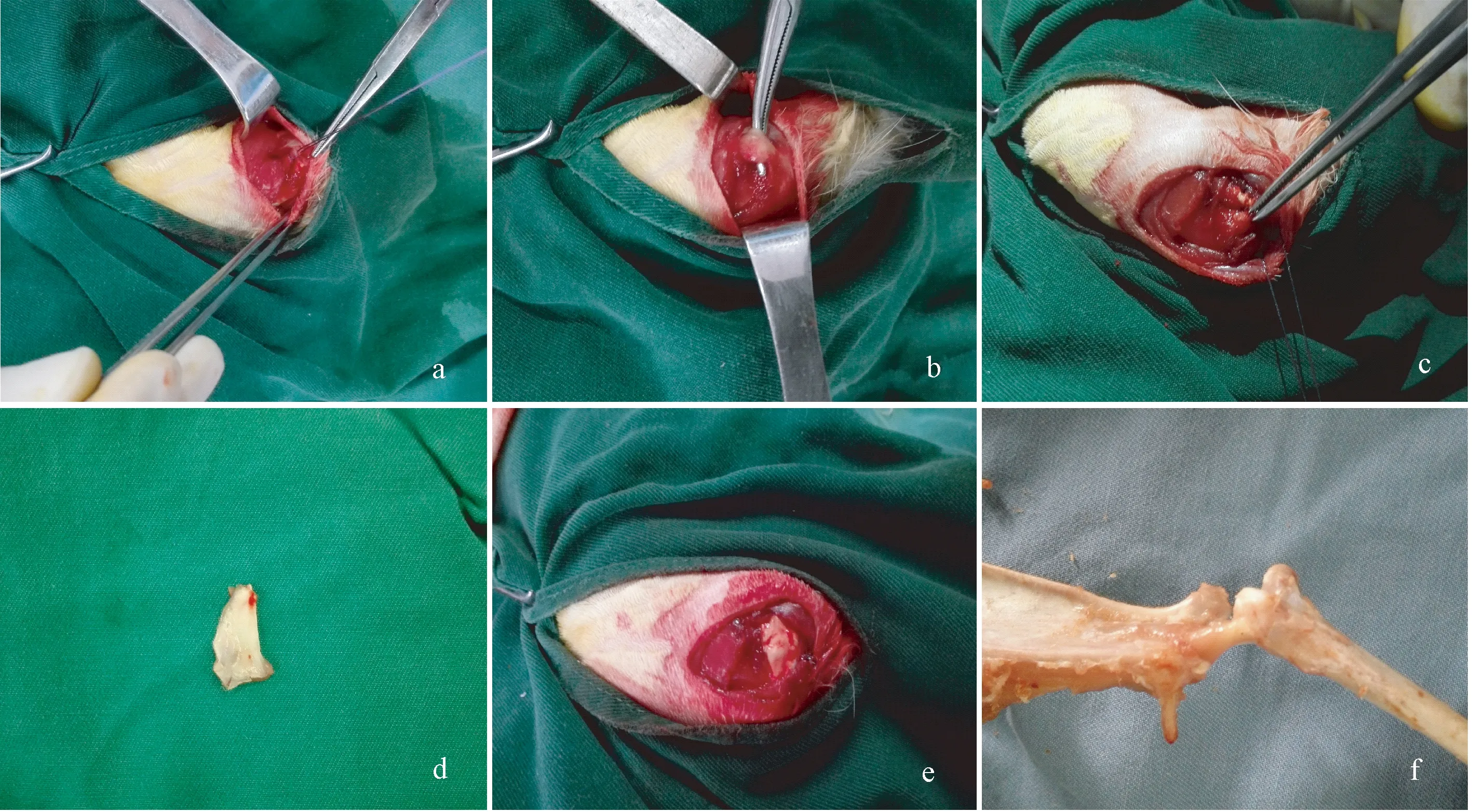
注:a:兔冈上肌肌腱;b:急性冈上肌撕裂模型;c:单纯缝合修复冈上肌;d:自体骨膜补片;e:骨膜加强修复冈上肌;f:正常兔骨肌腱连接结构模型。图1 兔骨肌腱连接结构的制备Note.a: Rabbit supraspinatus tendon. b: Acute rotator cuff tear model. c: Simple suture fixation. d: Autologous periosteum patch. e: Enhanced repair of supraspinatus muscle with the periosteal patch. f: Bone-tendon junction model.Fig.1 Preparation of the rabbit bone-tendon junction
1 材料和方法
1.1 实验动物
普通级新西兰兔60只,4~5个月龄,体重2.5~3.0 kg,雌雄各半,由承德医学院附属医院实验动物中心提供[SCXK(冀)2015-0100],在承德医学院动物实验中心分笼饲养[SYXK(冀)20014-0012],常规饮食饮水。并按实验动物使用的3R原则给予人道的关怀。
1.2 主要试剂和仪器
苏木精(珠海贝索生物技术有限公司,生产批号717111);伊红(珠海贝索生物技术有限公司,生产批号717093);Masson三色染色液(珠海贝索生物技术有限公司,生产批号616121);光学显微镜(日本Olympus显微镜公司);万能材料试验机(美国Instron公司);2-0可吸收缝线(美国Depuy公司)等。
1.3 实验方法
1.3.1 动物分组
新西兰兔60只建立急性肩袖撕裂模型。每只新西兰兔随机选取一侧肩关节为实验组,使用自体骨膜补片加强修复肩袖撕裂,另一侧肩关节作为对照组,单纯行肩袖缝合术治疗,实验中对动物的处置符合医学伦理学标准。
1.3.2 手术方法
使用30 g/L的巴比妥钠按1 mL/kg体重经兔耳缘静脉麻醉,常规脱毛、备皮、消毒铺单后,对照组在肩关节做长约2 cm的皮肤纵行切口,钝性分离三角肌,显露冈上肌腱性部分,于冈上肌止点处锐性切断冈上肌肌腱,造成急性肩袖撕裂模型。用直径1 mm克氏针在大结节上打2平行骨隧道备用,冈上肌止点去皮质新鲜化处理,用2-0可吸收缝线将肩袖残端原位缝合,尾线穿过骨道固定,缝合后逐层关闭切口;实验组用相同方法造模后,纵行切开胫骨近端皮肤1 cm,尽量锐性剥去骨膜表面的纤维组织,切取10 mm×5 mm大小的骨膜组织,置于生理盐水中备用,切取时尽量减少对骨膜生发层的损害,于腱骨止点处骨膜生发层朝向关节侧完全覆盖肩袖断端,用2-0可吸收缝线将骨膜补片加强修补。见图1。术后即允许兔自由行走,术后3 d内予肌注庆大霉素(4000 U/d)抗感染,密切观察新西兰兔术后活动、进食和伤口愈合情况。

注:a:术后4周实验组间充质细胞增生明显,少量软骨细胞;b:术后4周对照组腱骨间隙明显,成纤维细胞增生;c:术后8周实验组大量未成熟软骨细胞,排列略规整;d:术后8周对照组胶原纤维连接,少量软骨细胞;e:术后12周实验组类似正常腱骨界面;f:术后12周对照组腱骨连接不紧密,软骨细胞排列紊乱。T:肌腱;B:骨;IF:腱骨界面。图2 兔BTJ组织HE染色(×40)Note.a: At 4 weeks, mesenchymal cells proliferate obviously in the experimental group. b: At 4 weeks, the tendon-bone gap exists and the fibroblast proliferation in the control group. c: At 8 weeks, a large number of immature chondrocytes are arranged in a regular way in the experimental group. d: At 8 weeks, collagen fiber connections are observed in the control group. e: The tendon-bone interface structure is similar to normal in the experimental group at 12 weeks after repair. f: At 12 weeks, disordered arrangement of chondrocytes in the control group. T: tendon. B: bone. IF: tendon-bone interface.Fig.2 Histological changes of the healing process of rabbit bone-tendon tear. HE staining
1.3.3 标本获取
分别于术后4、8、12周戊巴比妥钠麻醉后处死新西兰兔20只,每组10个标本以冈上肌肌腱止点为中心,取肱骨近端包括腱-骨交界面的大结节组织,大小约10 mm×5 mm×5 mm,进行组织学观察,10个标本保留肱骨和完整的冈上肌组织作为完整的骨-肌腱结合部(bone-tendon junction, BTJ),进行生物力学实验。
1.3.4 大体观察
观察实验动物的大体情况。
1.3.5 病理学观察
选取标本以4%甲醛溶液固定3 d,再以100 g/L乙二胺四乙酸(EDTA)脱钙液充分脱钙4周,标本再依次脱水、透明、石蜡包埋,制成5 μm层厚的连续切片,分别进行HE染色、Masson染色后光镜下观察冈上肌止点腱-骨界面结构的形态学变化。
1.3.6 生物力学测试
选取后的BTJ样本,用2号Ethibond缝线编织肌腱,用义齿基托包埋肱骨远端,标本固定后应用万能材试验机进行生物力学拉伸试验,2.5 N为初始负荷,以牵拉速度5 mm/min行拉断实验,记录腱-骨界面承受的最大抗拉力值。
1.4 统计学方法
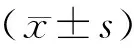

注:a:术后4周对照组可见疏松结缔组织;b:术后4周实验组可见大量胶原纤维排列;c:术后8周对照组胶原纤维连接,瘢痕愈合倾向;d:术后8周实验组胶原纤维层和软骨层交错排列;e:术后12周对照组腱骨界面结构紊乱;f:术后12周实验组腱骨界面愈合良好;T:肌腱;B:骨;IF:腱骨界面。图3 兔BTJ组织Masson染色(×200)Note.a: At 4 weeks, loose connective tissue is found in the control group. b:At 4 weeks, a large amount of collagen fibers is observed in the experimental group. c: At 8 weeks, scar healing tendency is observed in the control group. d: At 8 weeks, the collagen fiber layer and cartilage layer are arranged alternately in the experimental group. e: At 8 weeks, a disordered tendon-bone interface in the control group. f: At 8 weeks, the tendon-bone interface healed well in the experimental group. T: Tendon. B: Bone. IFI: Tendon-bone Interface.Fig.3 Histological changes of the healing process of rabbit bone-tendon tear. Masson staining
2 结果
2.1 大体观察
实验动物于相同清洁环境中饲养,手术后所有新西兰兔饮食等健康状况良好,术前、术后均可自由活动,观察期间无发热、切口红肿等情况发生,术后3 d后新西兰兔上肢活动情况恢复术前状况,未发现肢体活动量减少,僵硬等现象。
2.2 组织学观察
HE染色可以大体观察到BTJ的组织结构,初步评价愈合效果,Masson染色可以观察组织的胶原纤维分布,有助于评估肩袖的腱-骨愈合效果。(见图2,3)
实验组:术后4周:腱骨间隙不明显,间充质细胞增生明显,骨膜内可见少量新生软骨细胞和基质;术后8周:肌腱胶原纤维束状排列,腱骨界面可见成骨反应,大量未成熟软骨细胞,排列略规整,部分向肌腱内长入。术后12周:肌腱与骨结合紧密,肌腱胶原纤维粗大规则,软骨细胞成熟排列规整,类似正常的腱骨界面结构。
对照组:术后4周:肌腱与骨的间隙较明显,可见坏死组织,大量炎性细胞浸润,其内有新生肉芽组织,成纤维细胞增生;术后8周:腱骨间隙由纤维肉芽组织填充,通过大量成纤维细胞和胶原纤维相连,少量软骨细胞形成,提示瘢痕愈合倾向;术后12周:腱骨间隙模糊,胶原纤维连接,软骨细胞排列紊乱
2.3 生物力学测试
在生物力学拉伸实验过程中,所有标本最大负荷时均在冈上肌止点缝合处断裂;其最大负荷随术后时间延长而增大,差异有显著性(P< 0.05);各时间段实验组最大负荷强度明显高于对照组,差异有显著性(P< 0.05)。(见表1)
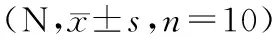
表1 实验组、对照组不同时间段最大失效负荷对比Tab.1 Comparison of the maximum failure load in the experimental group and control group at different time points
注:与同时间段对照组相比,*P< 0.05;组内与前一时间段相比,#P< 0.05。
Note.Compared with the control group at the same time,*P< 0.05. Compared with the previous period in the same group,#P< 0.05.
3 讨论
肩袖损伤修复术后最主要的难题是肩袖止点组织结构无法恢复到正常形态,其病理学研究表明肩袖损伤后的腱骨界面内纤维软骨层无法再生,仅由瘢痕组织替代,导致形成的间接止点机械性能远低于正常的直接止点,容易发生再撕裂。随着人们对肩袖损伤修复过程及腱骨愈合机制的认识不断加深,不同的治疗策略得以开发、应用以促进肩袖损伤后修复效果[5]。最新的研究热点是如何在肩袖损伤修复基础上联合生物增强技术或现代组织工程技术有效的促进肩袖损伤后腱骨愈合[6]。
目前应用较多的促进腱-骨愈合生物工程学方法包括骨形态发生蛋白(bone morphogenetic protein, BMP)、小肠黏膜下层组织(small intestinal submucosa, SIS)、富血小板血浆(platelet-rich plasma, PRP)等。然而,这些治疗措施在加速腱骨愈合和降低腱骨界面纤维疤痕组织是有效的,但促进纤维软骨的形成效果欠佳[7-8]。纤维软骨区是腱骨连接部位特征性结构,它能够缓冲应力,减少再撕裂发生,止点处软骨再生对改善肩袖腱骨愈合质量起重要作用。本研究选用自体骨膜作为补片来源,主要由于骨膜内侧含有大量未分化的间充质干细胞(MSCs),MSCs能够在体内、体外快速增殖,同时具有多向分化能力,可以分化成为成骨细胞和软骨细胞[9-11]。Lim等[12]在腘肌腱上移植MSCs,发现2周后腱骨界面有大片软骨细胞形成,8周后有软骨成熟区形成。在肩袖腱骨愈合过程中,骨膜补片还可产生提高细胞的生长和分化的生物活性因子[13-16],其主要包括转化生长因子(TGF),BMP-2等,这些生长因子有助于骨膜向软骨生长和转化。Chen等[17]在肩袖损伤模型中使用骨形态发生蛋白-骨膜前体细胞水凝胶加强修复腱骨愈合,结果观察到腱-骨界面组织愈合改善,生物力测试最大载荷明显提高。此外,使用自体骨膜补片作为修复肩袖撕裂的组织工程支架,具有良好的生物学潜能。张琪等[18]通过对不同方案制备兔胫骨骨膜生物支架研究表明,处理后骨膜支架有良好的生物相容性,满足生物工程支架要求。
既往动物学研究发现,兔的冈上肌形态和功能与人类相似,兔在笼养时比其他实验动物上肢单独活动机会多,本研究采用李奉龙等[19]的兔急性肩袖损伤的造模方法对肩袖的腱骨愈合进行研究。李卫国等[20]和陈百成等[21]研究证明骨膜成软骨能力随年龄增加而降低,但成年兔骨膜受刺激后再生软骨能力可恢复,此外,胫骨近端的骨膜切取具有取材方便、并发症少、对实验肢体活动无影响等优点。多篇研究[22-24]通过动物模型研究证实肩袖修复术后需要8~12周的愈合时间,而肩袖补片需要8~10周的时间吸收降解,因此,本研究采用4、8和12周三个观察时间点能更充分的说明自体骨膜补片对肩袖腱-骨愈合的影响。结果表明使用自体骨膜补片加强修复肩袖,在组织学方面,腱骨愈合早于对照组,并且肌腱与骨结合紧密,软骨细胞排列规整,类似正常的腱骨界面结构,其腱骨连接紧密程度及止点软骨细胞排列明显优于单纯修复组;在力学方面,实验组修补术后各时间阶段冈上肌腱抗牵拉强度也明显高于对照组,利于术后早期康复锻炼。此外,笔者认为在临床实践中,使用骨膜补片加强修复肩袖适用于肩袖撕裂直径>5 cm的巨大型撕裂,尤其对于术前病程长,MRI显示肩袖回缩严重,质地差,脂肪浸润超过50%的老年患者,手术自体骨膜切取应避免副损伤发生。
综上所述,使用自体骨膜作为补片来源能有效提高肩袖腱骨愈合强度,缩短腱骨愈合时间,有良好的生物学特性,为临床上提高肩袖损伤修复手术成功率提供了一定的实验基础,但本研究还需进一步的临床试验证实。
[1] Abtahi AM, Granger EK, Tashjian RZ. Factors affecting healing after arthroscopic rotator cuff repair[J]. World J Orthop, 2015, 6(2): 211-220.
[2] Degen RM, Carbone A, Carballo C, et al. The effect of purified human bone marrow-derived mesenchymal stem cells on rotator cuff tendon healing in an athymic rat[J]. Arthroscopy, 2016, 32(12): 2435-2443.
[3] Tahririan MA, Moezi M, Motififard M, et al. Ultrasound guided platelet-rich plasma injection for the treatment of rotator cuff tendinopathy[J]. Adv Biomed Res, 2016, 5: 200.
[4] 张俊玮, 陆海涛, 杨宇明, 等. 低温培养对骨膜细胞成软骨分化的影响[J]. 中华实验外科杂志, 2016, 33(5): 1281-1283.
[5] Dewan AK, Petre BM, Wilckens JH, et al. Factors affecting perceptions of open, mini-open, and arthroscopic rotator cuff repair techniques among medical professionals[J]. Am J Orthop (Belle Mead NJ), 2015, 44(9): E317-325.
[6] Thangarajah T, Pendegrass CJ, Shahbazi S, et al. Augmentation of rotator cuff repair with soft tissue scaffolds[J]. Orthop J Sports Med, 2015, 3(6): 2325967115587495.
[7] Lannotti JP, Codsi MJ, Kwon YW, et al. Porcine small intestine submucosa augmentation of surgical repair of chronic two-tendon rotator cuff tears. A randomized, controlled trial[J]. J Bone Joint Surg Am, 2006, 88(6):1238-1244.
[8] 张颉鸿, 吴海山. 肩袖修复后促进腱骨界面软骨再生的研究进展[J]. 中国矫形外科杂志,2016,24(14): 1299-1303.
[9] Hernigou P, Flouzat Lachaniette CH, Delambre J, et al. Biologic augmentation of rotator cuff repair with mesenchymal stem cells during arthroscopy improves healing and prevents further tears: a case-controlled study[J]. Int Orthop, 2014, 38(9): 1811-1818.
[10] 康少平, 刘淑艳, 李永升, 等. 低氧增强骨髓间充质干细胞增殖维持分化潜能[J]. 中国比较医学杂志, 2017, 27(7): 70-74.
[11] 刘薇, 史俊文, 岳敏,等. 西藏小型猪肋软骨细胞的分离培养及鉴定[J]. 中国比较医学杂志, 2013, 23(3): 1-3, 86, 80.
[12] Lim JK, Hui J, Li L, et al. Enhancement of tendon graft osteointegration using mesenchymal stem cells in a rabbit model of anterior cruciate ligament reconstruction[J]. Arthroscopy, 2004, 20(9): 899-910.
[13] Mara CS, Sartori AR, Duarte AS, et al. Periosteum as a source of mesenchymal stem cells: The effects of TG-3 on chondrogenesis[J]. Clinics (Sao Paulo), 2011, 66(3): 487-492.
[14] 张冲, 李莉. TGF-β1对大鼠肩袖损伤修复术后腱-骨愈合的影响[J]. 医用生物力学, 2016, 31(2): 167-170.
[15] Klatte-Schulz F, Pauly S, Scheibel M, et al. Characteristics and stimulation potential with BMP-2 and BMP-7 of tenocyte-like cells isolated from the rotator cuff of female donors[J]. PloS One, 2013, 8(6): e67209.
[16] Pauly S, Klatte F, Strobel C, et al. BMP-2 and BMP-7 affect human rotator cuff tendon cells in vitro[J]. J Shoulder Elbow Surg, 2012, 21(4): 464-473.
[17] Chen CH, Chang CH, Wang KC, et al. Enhancement of rotator cuff tendon-bone healing with injectable periosteum progenitor cells BMP-2 hydrogel in vivo[J]. Knee Surg Spotrs Traumatol Arthrosc, 2011, 19(9): 1597-1607.
[18] 张琪, 倪金虎, 林贤丰,等. 兔胫骨骨膜去细胞生物支架制备方案的优化[J]. 中华骨科杂志, 2016, 36(12):785-794.
[19] 李奉龙, 姜春岩, 鲁谊,等. 兔肩袖损伤模型的建立及初步组织学研究[J]. 中国组织工程研究, 2012, 16(20): 3685-3689.
[20] 李卫国, 黄向红, 唐景清,等. 自体骨膜游离移植的实验研究-不同龄动物大块关节软骨缺损修复的比较[J]. 中华创伤骨科杂志, 2005, 7(9): 852-855.
[21] 陈百成, 栾广, 张展翅, 等. 自体骨膜包裹肌腱对腱骨愈合的影响[J]. 中华骨科杂志, 2006, 26(2): 118-122.
[22] Hirose K, Kondo S, Choi HR, et al. Spontaneous healing process of a supraspinatus tendon tear in rabbits[J]. Arch Orthop Trauma Surg,2004,124(6):374-377.
[23] 张冲,刘玉杰.补片技术修复肩袖损伤的应用研究[J]. 中国微创外科杂志, 2017, 17(2): 179-183.
[24] 任士友, 江长青, 张文涛. 不同肩袖补片特点:应用强度、降解速率及酸性降解物的调控[J]. 中国组织工程研究, 2015, 19(30): 4876-4881.
