大鼠Pig-a基因突变试验中N-乙基-N-亚硝基脲和环磷酰胺量-效关系的优化
2018-03-05刘香梅李培宁刘冬虹黄宇锋庞增雄陈梓灵徐颖愉丘智峰
刘香梅,李培宁,刘冬虹,黄宇锋,庞增雄,陈梓灵,徐颖愉,丘智峰
(广州质量监督检测研究院,广州 511447)
Pig-a基因位于X染色体上,作为管家基因,其同源基因编码区的结构和功能在人、大鼠、小鼠都有高度的保守性,该基因位点的突变可间接导致细胞表面锚蛋白(GPI-AP)的缺失,如CD59、CD55等,提示我们Pig-a基因突变试验可用于检测体内基因突变终点遗传毒性试验。
目前,常用的遗传毒性试验阳性物,如乙基亚硝基脲(ethylnitrosourea,ENU)、4-硝基喹啉-N-氧化物(4NQO),环磷酰胺(cyclophosphamide, CP),苯并芘等也可作为Pig-a基因突变试验阳性物开展试验[1-3],但是致突变的效果不同。研究发现,多能干细胞及成熟的血细胞均可发生Pig-a基因突变而导致的GPI-AP缺失,因此外周血是最早用于研究Pig-a基因突变,而外周血中不同细胞的受累程度不同,红细胞较少发生GPI-AP的自发缺失,因此可以将外周血红细胞表面CD59缺失率作为Pig-a基因体内突变试验检测终点[4]。传统遗传毒性试验具有周期长、成本较高、且大多不能有效反映基因突变终点,从而造成其体外和体内试验结果的一致性也欠佳等缺陷,而利用Pig-a基因突变试验原理建立的致突变检测方法则可以解决这些问题。
本试验研究不同剂量的ENU和CP对SD大鼠外周血红细胞表面锚蛋白CD59缺失的影响,从而筛选适合于遗传毒性试验的优选阳性物及剂量,确定实验周期,以优化Pig-a基因突变试验检测方法,用于化妆品致突变性安全评价。
1 材料和方法
1.1 实验动物
SPF级SD大鼠,雄性24只,180~200 g,40~50日龄,购自南方医科大学实验动物中心[SCXK(粤)2016-0041],伦理审查编号:2017-01-07。大鼠饲养于本单位屏障实验室[SYXK(粤)2014-0137],自由进食进水,实验室温度20℃~26℃,湿度40%~70 %。
1.2 主要试剂及仪器
ENU,CAS:759-73-9,LOT# MKBX 4322 V,Sigma;CP,批号:SJ0121RA14,上海源叶生物科技有限公司;DPBS,LOT:1546333,2017-02,Gibco;胎牛血清(FBS),批号:141012,杭州四季青生物工程材料有限公司。FITC Mouse Anti-Rat CD59,货号:550976,批号:4233743;PE Mouse Anti-Rat CD45抗体,货号:554878,批号:7054649,BD公司;
BD FACSCanto II 流式细胞仪;KDC 1044低速离心机。
1.3 实验方法
动物经检疫合格后,将SD大鼠按体重和外周血RBCCD59-随机分为4组,即溶媒对照组,ENU 10 mg/kg给药组,ENU 40 mg/kg给药组和CP 40 mg/kg给药组,每组6只。采用腹腔注射染毒,各组染毒1次,溶媒对照组注射PBS溶液。在染毒前和染毒后7、14、28、42、56 d进行眼眶静脉丛采血,采用乙醚麻醉,称重并采抗凝血,置于冰上保存备用。
吸取1.5 μL抗凝血,加入200 μL含1%胎牛血清的PBS溶液的流式管中,轻微震荡数秒。加入2.5 μL anti-CD45和1 μL anti-CD59,轻轻转动,使抗体混合均匀,室温暗处避光孵化约30 min。离心弃上清液,加入约0.5 mL含1%胎牛血清的PBS溶液,轻轻转动,上流式细胞仪检测,每个样本检测100万个红细胞[5-7],分析大鼠外周血RBCCD59-发生率。
1.4 统计学方法

2 结果
2.1 ENU和CP对大鼠体重的影响
与溶媒对照组比较,ENU 10 mg/kg给药组和ENU 40 mg/kg给药组各时间点体重及体重增量均无明显影响(P> 0.05),CP 40 mg/kg给药组给药后时间点体重及体重增量均下降(P< 0.05)。说明ENU 10 mg/kg和40 mg/kg剂量对大鼠体重没有影响,而40 mg/kg剂量的CP可降低大鼠体重。结果见表1、图1。
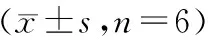
表1 ENU和CP对各时间点大鼠体重的影响结果
注:与溶媒对照组比较,*P< 0.05,**P< 0.01。
Note.Compared with the control group,*P< 0.05,**P< 0.01.

图1 ENU和CP对各时间点大鼠体重的影响结果Fig.1 Effect of ENU and CP on the body weight of rats at different time points
2.2 ENU和CP对大鼠外周血RBCCD59-发生率的影响
与溶媒对照组比较,CP 40 mg/kg给药组给药后第28、42和56天,ENU 10 mg/kg给药组给药后第42、56天,ENU 40 mg/kg给药组给药后第7、14、21、28、42和56天外周血RBCCD59-发生率均升高(P< 0.05)。与ENU 10 mg/kg给药组比较,ENU 40 mg/kg给药组给药后第7、21、28、42和56天外周血RBCCD59-发生率均升高(P< 0.05)。结果见表2、图2。
3 讨论
随着科学研究的发展,如何最大限度减少实验动物的使用数量,快速又准确的得出遗传基因的改变是现阶段研究的重点。在Pig-a基因突变检测方法建立的过程中,国内外研究发现,Pig-a基因突变造成外周血红细胞表面CD59的缺失是一个逐渐累积的过程,这对检测有微弱遗传毒性的物质是一种很有意义的方法。目前的研究主要集中在阳性诱变剂ENU、4NOQ、EMS等的筛选、检测指标的种类及相关性等方面。而CP作为传统遗传毒性试验检测方法中最常见的阳性致突变剂,在Pig-a基因突变试验中研究却甚少。本试验主要研究CP传统遗传毒性试验常用剂量 40 mg/kg和同剂量下的ENU,以ENU 10 mg/kg剂量,于给药后第7~56天对外周血RBCCD59-发生率的影响。

表2 ENU和CP对各时间点大鼠外周血RBCCD59-发生率的影响结果
注:与溶媒对照组比较,*P< 0.05,**P< 0.01;与ENU10 mg/kg给药组比较,#P< 0.05,##P< 0.01。
Note.Compared with the control group,*P< 0.05,**P< 0.01. Compared with the ENU 10 mg/kg group,#P< 0.05,##P< 0.01.
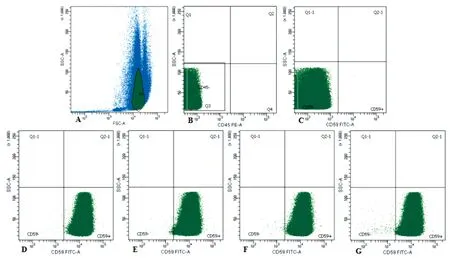
注:A:空白对照FSC-A/SSC-A图;B:空白对照PE-A/SSC-A图;C:空白对照FITC-A/SSC-A图;D:溶媒对照组;E:CP 40 mg/kg给药组;F:ENU 10 mg/kg给药组;G:ENU 40 mg/kg给药组。图2 ENU和CP对大鼠外周血RBCCD59-发生率的影响结果Note.A: FSC-A/SSC-A chart of the blank group. B: PE-A/SSC-A chart of the blank group. C:FITC-A/SSC-A chart of the blank group. D: Control group. E: CP 40 mg/kg group. F: ENU 10 mg/kg group. G: ENU 40 mg/kg group.Fig.2 Effect of ENU and CP on the loss rate of RBCCD59- at different time points
试验结果显示,CP 40 mg/kg给药组给药后第28天出现阳性结果,至给药后第56天仍有显著性差异,检出阳性结果的时间较ENU时间延后,且引起大鼠体重的下降较为明显,不推荐作为该实验的阳性致突变物。ENU 40 mg/kg给药组和10 mg/kg给药组分别于给药后第7、42天出现稳定的阳性结果,且ENU40 mg/kg剂量较10 mg/kg剂量引起外周血RBCCD59-发生率高,但对大鼠体重没有影响。可以得出,相同剂量下,ENU引起大鼠外周血RBCCD59-发生率升高效果优于CP,且40 mg/kg剂量优于10 mg/kg剂量,检验周期以28 d为宜。
ENU和CP作为常用烷化剂类致突变诱变剂,可直接与DNA发生交叉联结,干扰DNA和RNA功能,进而导致基因突变。ENU引起外周血红细胞表面蛋白CD59缺失率高于CP,猜想可能是ENU和CP对造血干细胞和有限自我更新能力的定向细胞的影响程度不同[9]。ENU是常用的有效的致突变剂,大量的文献报道其可引起Pig-a基因突变发生率的增加[2,7,9-10],我们的试验结果也验证了这一结果。CP作为常用的遗传毒性试验阳性物,Kimoto等[8]研究发现,连续10 d给予大鼠5 mg/kg剂量的CP,外周血RBCCD59-未见统计学差异,而Walker等[11]研究发现给予大鼠20 mg/kg的CP 8周后,外周血RBCCD59-是对照组的2~3倍,和我们的试验结果保持一致。但总的来说,CP引起外周血RBCCD59-效果并不明显,至少不会引起X染色体上Pig-a或者Hprt基因的明显突变。
但本试验不足之处在于,未能从多方面全面评价阳性致突变物引起的大鼠外周血Pig-a基因突变,后期试验可以增加对网织红细胞表面CD59缺失率,网织红细胞微核率等相关指标的研究[12],采用多指标联合评价该方法灵敏度。
在本试验条件下,综合大鼠体重和外周血RBCCD59-发生率两个指标,我们得出ENU 40 mg/kg剂量引起大鼠外周血Pig-a基因突变的效果更优,采用流式细胞术方法,能够利用小样本量相对迅速地得到较为精确的结果,具有连续、动态监测等优点,该方法可以考虑应用到常规毒性研究中,用于化学物、化妆品等的急性、慢性暴露引起的遗传毒性筛查。
[1] Bhalli JA, Shaddock JG, Pearce MG, et al. Sensitivity of the Pig-a assay for detecting gene mutation in rats exposed acutely to strong clastogens [J]. Mutagenesis, 2013, 28(4): 447-455.
[2] Dobo KL, Fiedler RD, Gunther WC, et al. Defining EMS and ENU dose-response relationships using the Pig-a mutation assay in rats [J]. Mutat Res, 2011, 725(1-2): 13-21.
[3] Kenyon MO, Coffing SL, Ackerman JI, et al. Compensatory erythropoiesis has no impact on the outcome of the in vivo Pig-a mutation assay in rats following treatment with the haemolytic agent 2-butoxyethanol [J]. Mutagenesis, 2015, 30(3): 325-334.
[4] 邓媛媛, 郭隽, 王雪, 等.Pig-a基因突变检测方法在药物遗传毒性评价中的应用及研究进展 [J]. 中国新药杂志, 2012, 21(24): 2895-2898.
[5] 邓媛元. 体内Pig-a基因突变检测方法研究 [D]. 中国食品药品检定研究院, 2012.
[6] Dertinger SD, Phonethepswath S, Avlasevich SL, et al. Efficient monitoring of in vivo Pig-a gene mutation and chromosomal damage: summary of 7 published studies and results from 11 new reference compounds [J]. Toxicol Sci, 2012, 130(2): 328-348.
[7] Dertinger SD, Phonethepswath S, Franklin D, et al. Integration of mutation and chromosomal damage endpoints into 28-day repeat dose toxicology studies [J]. Toxicol Sci, 2010, 115(2): 401-411.
[8] Kimoto T, Chikura S, Suzuki-Okada K, et al. Effective use of the Pig-a gene mutation assay for mutagenicity screening: measuring CD59-deficient red blood cells in rats treated with genotoxic chemicals [J]. J Toxicol Sci, 2012, 37(5): 943-955.
[9] Phonethepswath S, Franklin D, Torous DK, et al. Pig-a mutation: kinetics in rat erythrocytes following exposure to five prototypical mutagens [J]. Toxicol Sci, 2010, 114(1): 59-70.
[10] Cammerer Z, Bhalli JA, Cao X, et al. Report on stage Ⅲ Pig-a mutation assays using N-ethyl-N-nitrosourea-comparison with other in vivo gentoxicity endpoint [J]. Environ Mol Mutagen, 2011, 52 (9): 721-730.
[11] Walker DM, Seilkop SK, Scott BR, et al. Hprt mutant frequencies in splenic T-cells of male F344 rats exposed by inhalation to propylene [J]. Environ Mol Mutagen, 2004, 43 (4): 265-272.
[12] Stankowski LF Jr, Roberts DJ, Chen H, et al. Integration of Pig-a, micronucleus, chromosome aberration, and comet assay endpoints in a 28-day rodent toxicity study with 4-nitroquinoline-1-oxide [J]. Environ Mol Mutagen, 2011, 52(9): 738-747.
