TRPV4受体对血管紧张素II诱导的小鼠肾损害的影响
2018-03-05闫凤娜刘素晓谢世阳朱明军王幼平
闫凤娜,刘素晓,崔 琳,谢世阳,沈 思,朱明军,王幼平*
(1.河南中医药大学第一附属医院,中心实验室,郑州 450000; 2.河南中医药大学中西医结合临床学科,郑州 450008)
除糖尿病外,高血压是导致肾损害的另一个最重要的危险因素[1]。笔者以往通过相关研究已经证实以单核/巨噬细胞浸润为主要特征的炎症反应在高血压所诱导的肾损害过程中发挥着重要作用[2]。瞬时受体电位香草酸亚型4(transient receptor potential vanilloid type 4,TRPV4)受体主要表达在心脏、血管内皮以及肾等组织,它可以被多种物理因素(如:高温和机械刺激)及化学因素(如:内源性大麻素和花生四烯酸)等激活[3]。已有大量报道指出,TRPV4受体的活化可以增强多种炎症反应[4-5]。因此,本研究拟在血管紧张素II(angiotensin II,Ang II)所诱导的高血压小鼠模型上,通过利用TRPV4基因敲除(TRPV4-/-)小鼠探讨TRPV4受体对该过程所诱导的肾损害的影响。
1 材料和方法
1.1 实验动物
清洁级雄性C57BL/6野生型小鼠32只,体重20~24 g,8~9周龄,购自北京维通利华动物有限公司[SCXK(京)2015-0011]。TRPV4-/-小鼠由美国密执根州立大学提供,且其与C57BL/6小鼠回交6代以后所产生的雄性TRPV4-/-小鼠34只,体重20~24 g,8~9周龄。实验在河南中医药大学第一附属医院中心实验室进行[SYXK-00015172],并且所有研究均遵循该医院实验动物伦理审查委员会相关规定(伦理审查编号:YFYDW2015012)。
1.2 主要试剂
Ang II(美国Sigma公司);改良Jaffe肌酐测定试剂盒(美国BioAssay System 公司);ELISA尿蛋白测定试剂盒(美国Exocell公司);尿8-异构前列腺素试剂盒(美国Cayman Chemical公司);羟脯胺酸检测试剂盒(美国Sigma公司)。
1.3 实验方法
1.3.1 分组及造模
本实验小鼠分为假手术组(野生型假手术组和TRPV4-/-型假手术组)和Ang II处理组(野生型Ang II处理组和TRPV4-/-型Ang II处理组)。根据以往研究报道的方法[6],建立Ang II诱导的高血压小鼠模型。具体操作如下:经过1周的适应性饲养以后,经皮下注射甲苯噻嗪(4 mg/kg)和氯胺酮(80 mg/kg)混合麻醉剂麻醉小鼠,且于颈背部皮下包埋miniosmotic pump(Alzet model 1004, Durect Corp, Cupertino, CA, 美国)后,分别连续灌注生理盐水或Ang II(1 μg/kg·min),共持续4周。假手术组小鼠灌注生理盐水,Ang II处理组小鼠灌注Ang II。手术后,对所有小鼠连续3 d注射青霉素钠盐。本实验共观察4周。
1.3.2 动脉收缩压的检测
本研究利用Tail-cuff体积描记法测定手术前以及手术后各周各组小鼠的尾动脉收缩压,具体操作方法如前所述[7]:上午10:00~12:00,取各组小鼠,待其安静后,置于28℃~32℃温箱内加热10 min,然后,采用固定器对其固定,利用BP-2000型血压测定仪(购自美国Visitech System公司)连续测定小鼠尾动脉收缩压5次,最后取5次测定的平均值作为动脉收缩压值。
1.3.3 尿液及血液的分析
实验处理开始后第26天,分别取各组实验小鼠,置于代谢笼内,收集其24 h 尿液,并称体重。然后,对小鼠行皮下注射氯胺酮(80 mg/kg)和甲苯噻嗪(4 mg/kg)混合麻醉剂麻醉小鼠,经腹主动脉采集血液,静放后,于4℃、10 000 r/min条件下离心10 min,收集血清后放置于-80℃冰箱中保存。分别采用特异性试剂盒测定尿液中8-异构前列腺素的含量,ELISA试剂盒测定尿液白蛋白的含量,以及改良的Jaffe肌酐检测试剂盒检测血清中的肌酐浓度。
1.3.4 肾组织病理学分析
取各组小鼠右肾后,称重,以4%的多聚甲醛对其进行固定,石蜡包埋,并且制备为4 μm厚的组织切片。然后,分别采用过碘酸-雪夫反应(PAS)与Masson三色法对组织切片进行染色。为了保证实验的客观性,由一位不了解实验设计的病理学人员,根据我们已报道的方法[8],分别进行肾小球硬化指数和肾小管间质损伤分数的半定量分析,从而评估肾小球硬化和肾小管间质损伤程度,具体方法如下:针对肾小球硬化指数,通过PAS染色,在×400倍条件下,每只小鼠随机选取50个肾小球,根据肾小球硬化范围进行评分。0分:肾小球无硬化;1分:肾小球硬化范围≤25%;2分:肾小球硬化范围≤25%~50%;3分:肾小球硬化范围≤50%~75%;4分:>75%。最后,肾小球硬化指数为肾小球分数乘以该分数所累积的肾小球百分率之和。针对肾小管间质损伤分数,通过Masson染色,在×200倍条件下,每只小鼠随即选取20个视野,根据损伤范围进行评分。0分:无损害;0.5分:损害非常局限;1分:损害范围<10%;2分:损害范围为10%~25%;3分:损害范围为25%~75%;4分:损害范围>75%。最后,取平均值为肾小管间质损伤分数。
1.3.5 肾胶原含量分析
本研究采用羟脯胺酸测定试剂盒确定肾组织胶原水平的含量。肾样本的处理如前所述[9]。采用比色法测定羟脯胺酸的含量,且制作羟脯胺酸的标准曲线,依据标准曲线计算羟脯胺酸含量。本实验假设羟脯胺酸占胶原蛋白平均含量的13.5%。最终实验数据以每毫克干重中胶原的微克数表示。
1.4 统计学方法
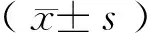
2 结果
2.1 各组小鼠血压的变化
如图1所示,实验处理前各组小鼠之间基础血压并没有明显差异(WT sham group: 103±6 mmHg;TRPV4-/-sham group:107±7 mmHg;Ang II-treated WT group:107±6 mmHg; Ang II-treated TRPV4-/-group:101±6 mmHg;P> 0.05)。实验处理后,野生型以及TRPV4-/-型假手术组小鼠的血压平稳,没有发生明显的改变。但是,经过Ang II处理后的两组小鼠从处理后第一周开始血压便出现明显升高(Ang II-treated WT group:153±5 mmHg;Ang II-treated TRPV4-/-group:147±5 mmHg),与相应的假手术组小鼠组比较(WT sham group:106±5 mmHg;TRPV4-/-sham group:103±5 mmHg),其差异有显著性(P< 0.05),并且其于术后3、4周时达到峰值,然而,经Ang II处理的野生型小鼠和TRPV4-/-小鼠血压之间的差异无显著性(3周:Ang II-treated WT group:164±6 mmHg vs. Ang II-treated TRPV4-/-group:170±6 mmHg;4周:Ang II-treated WT group:174±8 mmHg vs. Ang II-treated TRPV4-/-group:168±8 mmHg;P> 0.05)。
注:与野生型假手术组比较,*P< 0.05;与TRPV4-/-型假手术组比较,#P< 0.05。图1 各组小鼠收缩压的改变Note.*P< 0.05, compared with the WT sham group; #P< 0.05, compared with the TRPV4-/- sham group.Fig.1 Changes of systolic blood pressure in the groups
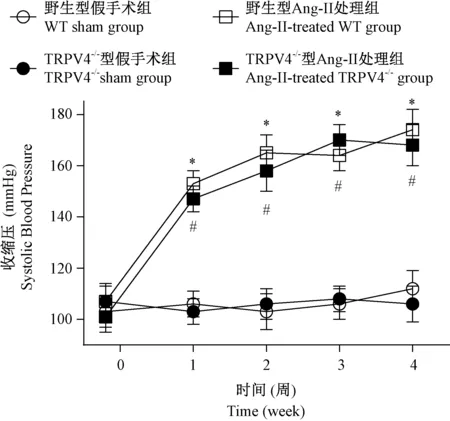
2.2 各组小鼠尿白蛋白、8-异构前列腺素排泄量及血清肌酐的变化
如图2所示,与相应的假手术组比较(尿白蛋白:WT sham group:4.1±0.8 μg/24 h; TRPV4-/-sham group:4.8±1.1 μg/24 h;尿8-异构前列腺素:WT sham group:0.35±0.25 ng/24 h;TRPV4-/-sham group:0.31±0.24 ng/24 h;血清肌酐:WT sham group:0.41±0.06 mg/dL;TRPV4-/-sham group:0.49±0.08 mg/dL),经Ang II处理的野生型和TRPV4-/-小鼠24 h尿白蛋白排泄量(Ang II-treated WT group:54.6±8.4 μg/24 h;Ang II-treated TRPV4-/-group:25.2±9.4 μg/24 h)以及尿8-异构前列腺素的排泄量(Ang II-treated WT group:2.59±0.31 ng/24 h; Ang II-treated TRPV4-/-group:1.04±0.33 ng/24 h)均出现明显增加(P< 0.05),同时伴有血清肌酐明显增加(Ang II-treated WT group:1.24±0.15 mg/dL;Ang II-treated TRPV4-/-group:0.88±0.14 mg/dL;P< 0.05)。然而,TRPV4基因敲除后,由 Ang II所诱发的上述改变受到明显的抑制,其差异有显著性(P< 0.05)。
注:与野生型假手术组比较,*P< 0.05;与TRPV4-/-型假手术组比较,#P< 0.05;与野生型Ang II处理组比较,†P< 0.05。图2 各组小鼠尿白蛋白(A)、尿8-异构前列腺素(B)以及血清肌酐(C)的变化Note.*P< 0.05, compared with the WT sham group.#P< 0.05, compared with the TRPV4-/- sham group.†P< 0.05, compared with the Ang II-treated WT group.Fig.2 Changes of urinary albumin (A), urinary 8-isoprostane (B) and serum creatinine (C) in the groups
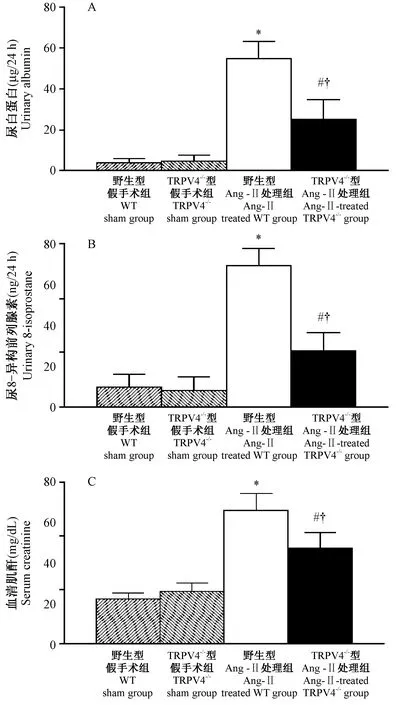
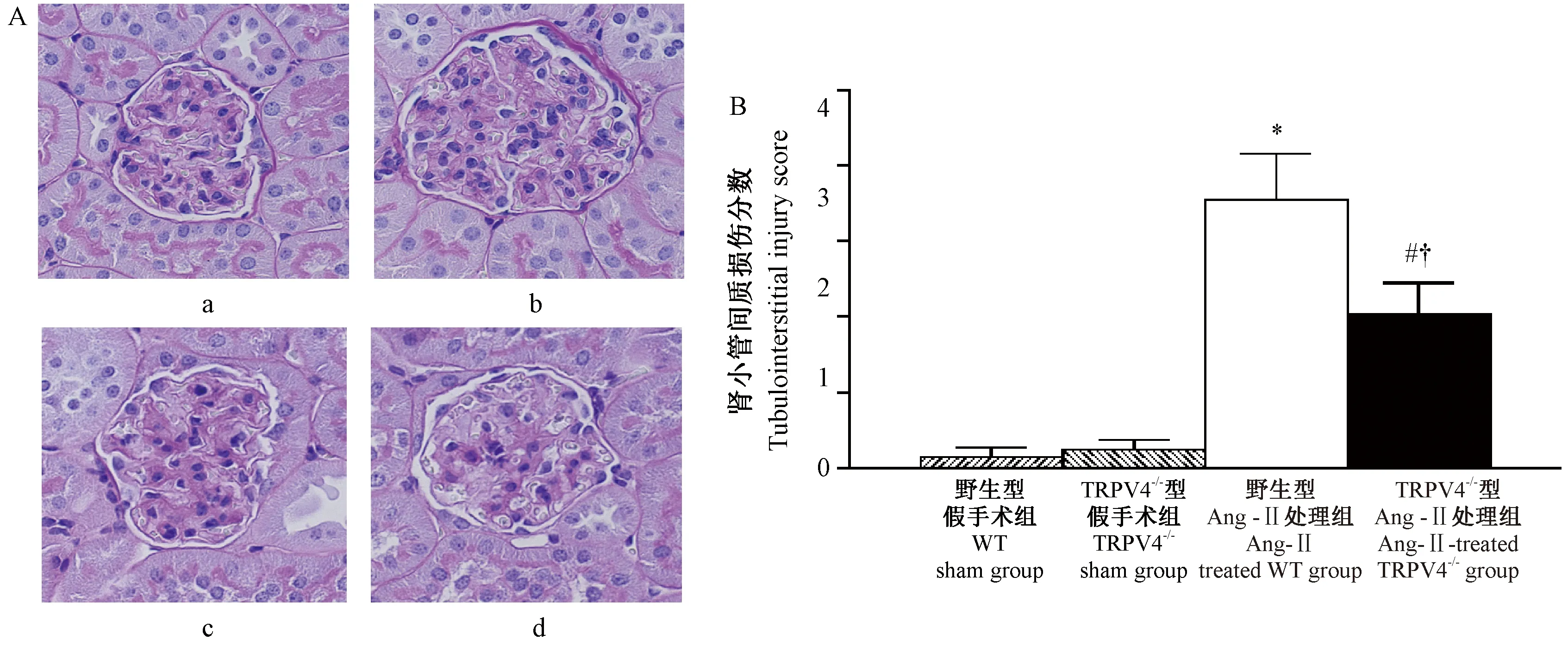
2.3 各组小鼠肾脏组织病理学的变化
如图3所示,与相应的假手术组比较(WT sham group:0.08±0.05;TRPV4-/-sham group:0.12±0.07),经Ang II处理的野生型和TRPV4-/-小鼠肾小球均出现明显的局灶性硬化,其硬化程度呈现显著增高的现象(Ang II-treated WT group:1.78±0.29;Ang II-treated TRPV4-/-group:1.01±0.22;P< 0.05),而TRPV4基因敲除能够明显抑制由Ang II所诱导的肾小球硬化现象(P< 0.05)。另外,如图4所示,与相应的假手术组比较(WT sham group:0.18±0.05;TRPV4-/-sham group:0.14±0.05),经Ang II处理的野生型和TRPV4-/-小鼠中肾小管出现明显的肥厚、扩张,以及间质纤维化现象,其损伤程度明显增加(Ang II-treated WT group:3.20±0.37;Ang II-treated TRPV4-/-group:1.96±0.32;P< 0.05)。但是,TRPV4基因敲除能够明显抑制由Ang II所诱导的上述肾小管间质损伤现象(P< 0.05)。
2.4 各组小鼠肾胶原蛋白含量的变化
如图5所示,与相应的假手术组比较(WT sham group:6.37±1.32 μg/mg干组织;TRPV4-/-sham group:7.16±1.29 μg/mg干组织),经Ang II处理的野生型小鼠和TRPV4-/-小鼠肾胶原蛋白含量均有明显的升高(Ang II-treated WT group:21.83±2.41 μg/mg干组织;Ang II-treated TRPV4-/-group:13.80±2.29 μg/mg干组织;P< 0.05),而TRPV4基因敲除能够显著抑制上述由Ang II所引起的肾胶原蛋白水平的升高,其差异有显著性(P< 0.05)。
3 讨论
本实验结果显示,皮下注射Ang II所诱导的高血压能够造成小鼠肾功能及肾病理学损害,上述损害主要表现为24 h 尿白蛋白与8-异构前列腺素排泄量增加、血清肌酐升高,以及肾小球纤维样硬化与肾小管间质损伤程度加重、肾胶原蛋白沉积等多个方面。但是,TRPV4基因敲除能够明显抑制上述由Ang II所诱发的肾损伤。因此,上述研究结果提示激活TRPV4受体能够促进Ang II所诱导的肾损害。
注:A:各组小鼠肾PAS染色(×400);a:野生型假手术组;b:TRPV4-/-型假手术组;c:野生型Ang II处理组;d:TRPV4-/-型Ang II处理组。B:各组小鼠肾小球硬化指数变化;与野生型假手术组比较,*P< 0.05;与TRPV4-/-型假手术组比较,#P< 0.05;与野生型Ang II处理组比较,†P< 0.05。图3 各组小鼠肾脏中肾小球硬化程度的变化Note.A: Representative PAS-stained kidney sections in the all groups (×400). a: WT sham group. b: TRPV4-/- sham group. c: Ang II-treated WT grou. d: Ang II-treated TRPV4-/- group. B: Changes in glomerulosclerosis index in all groups. *P< 0.05, compared with the WT sham group.#P< 0.05, compared with the TRPV4-/- Sham group.†P< 0.05, compared with the Ang II-treated WT group.Fig.3 Glomerulosclerotic changes in the groups

注:A:各组小鼠肾Masson染色(×200);a:野生型假手术组;b:TRPV4-/-型假手术组;c:野生型Ang II处理组;d:TRPV4-/-型Ang II处理组;B:各组小鼠肾小管间质损伤分数变化;与野生型假手术组比较,*P< 0.05;与TRPV4-/-型假手术组比较,#P< 0.05;与野生型Ang II处理组比较,†P< 0.05。图4 各组小鼠肾中肾小管间质损伤程度的变化Note.A: Representative Masson trichrome-stained kidney sections in the groups (×200). a: WT sham group. b: TRPV4-/- sham group. c: Ang II-treated WT group. d: Ang II-treated TRPV4-/- group. B: Changes of tubulointerstitial injury scores in the groups. *P< 0.05, compared with the WT sham group. #P< 0.05, compared with the TRPV4-/- sham group. †P< 0.05, compared with the Ang II-treated WT group.Fig.4 Changes of tubulointerstitial injury in the groups

注:与野生型假手术组比较,*P< 0.05;与TRPV4-/-型假手术组比较,#P< 0.05;与野生型Ang II处理组比较,†P< 0.05。图5 各组小鼠肾脏胶原蛋白含量的变化Note.*P< 0.05, compared with WT sham group. #P< 0.05, compared with the TRPV4-/- sham group. †P< 0.05, compared with the Ang II-treated WT group.Fig.5 Changes of collagen levels in kidneys in the groups
我们知道,血压升高是造成肾损害的主要机制之一[10]。通过对小鼠尾动脉收缩压的检测及分析,我们发现皮下注射Ang II能够在小鼠诱发高血压,而TRPV4基因敲除可以减轻和缓解由高血压所诱导的肾损害。但是,TRPV4基因的敲除并不影响Ang II所诱发的高血压。因此,我们推测,在Ang II所诱发的肾损害过程中,TRPV4基因敲除所表现出的肾保护作用并不是通过降低血压来实现的,即TRPV4受体促进Ang II所诱导的肾损害的机制是独立于血压因素的。
众所周知,尿白蛋白是反映肾疾病严重程度的重要指标之一。本研究发现皮下注射Ang II能够在小鼠中造成明显的白蛋白尿。然而,我们通过光学显微镜证实肾小球的损害程度并非与尿白蛋白相一致,这与以往的报道相一致[11],即尿白蛋白的增加先于光学显微镜下肾损害的发生,这是由于导致白蛋白尿的肾超微结构的改变先于光学显微镜下肾组织形态学的改变[12]。TRPV4基因敲除对于由Ang II引起的尿白蛋白有显著的抑制作用,然而,TRPV4受体对Ang II所诱发的肾超微结构损伤的影响还有待于进一步研究阐明。
目前,尽管高血压造成肾损害的具体机制尚不清楚,但是,大量研究已证实氧化应激反应在此过程中发挥着重要作用[13,14]。在高血压的发生和发展过程中,活性氧(reactive oxygen stress, ROS)的增加可导致肾发生炎症反应和相关损害。在病理状态下,ROS可以氧化多种细胞成分,其中包括细胞膜和DNA等,从而给机体组织带来损伤。8-异构前列腺素作为氧化应激反应的产物,其水平通常用来反映氧化应激反应的程度。本研究结果显示,在Ang II造成肾损害的过程中,尿中8-异构前列腺素的排泄量显著增加,从而反映出肾氧自由基水平的增高。另外,TRPV4基因敲除后,上述反应显著减弱,该研究结果提示TRPV4受体通过促进氧化应激反应加剧Ang II所诱导的肾损害。
TRPV4受体主要表达于血管内皮细胞,它的活化可以增强以单核/巨噬细胞浸润为主的炎症反应[3]。肾损害的发展过程可以表现在多个方面,其中包括肾小管间质中炎性细胞的浸润和胶原蛋白的沉积等[15],该病理过程引起肾纤维化,最终导致肾衰竭。为了探讨TRPV4受体在肾损害中的作用,我们检测了肾胶原蛋白的含量,结果发现,在TRPV4基因敲除小鼠,由皮下灌注Ang II所导致的肾胶原沉积水平的增高程度较野生型小鼠明显下降,该结果表明TRPV4受体可以明显促进肾纤维化,而该病理变化最终可引起肾的严重损伤。
本实验研究结果显示,通过皮下注射Ang II可以诱发明显的肾损伤,而在此过程中,TRPV4受体发挥着重要作用。在Ang II所诱导的高血压过程中,TRPV4受体通过增加氧自由基的产生促进肾损害的发生和发展。因此,针对高血压所诱导的肾损害,我们的研究结果提示TRPV4受体可能成为防治该损害的重要分子生物学靶点。
[1] Jamerson KA, Townsend RR. The attributable burden of hypertension: focus on CKD [J]. Adv Chronic Kidney Dis, 2011, 18(1): 6-10.
[2] Wang Y, Wang DH. Aggravated renal inflammatory responses in TRPV1 gene knockout mice subjected to DOCA-salt hypertension [J]. Am J Physiol Renal Physiol, 2009, 297: F1550-F1559.
[3] Ye L, Kleiner S, Wu J, et al. TRPV4 is a regulator of adipose oxidative metabolism, inflammation, and energy homeostasis [J]. Cell, 2012, 151(1): 96-110.
[4] Vergnolle N, Cenac N, Altier C, et al. A role for transient receptor potential vanilloid 4 in tonicity-induced neurogenic inflammation [J]. Br J Pharmacol, 2010, 159(5): 1161-1173.
[5] Okada Y, Shirai K, Miyajima M, et al. Loss of TRPV4 function suppresses inflammatory fibrosis induced by alkali-burning mouse corneas [J]. PloS One, 2016, 11(12): e0167200.
[6] 冯苗苗, 刘素晓, 王小晓,等. 线粒体介导产生的活性氧在血管紧张素II诱导的肾脏损害中的作用 [J]. 中国现代医学杂志, 2017, 27(2): 13-18.
[7] Feng M, Whitesall S, Zhang Y, et al. Validation of volume-pressure recording tail-cuff blood pressure measurements [J]. Am J Hypertens, 2008, 21(12): 1288-1291.
[8] Wang Y, Zhu M, Xu H, et al. Role of the monocyte chemoattractant protein-1/C-C chemokine receptor 2 signaling pathway in transient receptor potential vanilloid type 1 ablation-induced renal injury in salt-sensitive hypertension [J]. Exp Biol Med, 2015, 240(9): 1223-1234.
[9] Wang Y, Babánková D, Huang J, et al. Deletion of transient receptor potential vanilloid type 1 receptors exaggerates renal damage in deoxycorticosterone acetate-salt hypertension [J]. Hypertension, 2008, 52(2): 264-270.
[10] Polichnowski AJ, Lu L, Cowley AW Jr. Renal injury in angiotensin II + L-NAME-induced hypertensive rats is independent of elevated blood pressure [J]. Am J Physiol Renal Physiol, 2011, 300(4): F1008-F1016.
[11] Springate JE, Feld LG, Ganten D. Renal function in hypertensive rats transgenic for mouse renin gene [J]. Am J Physiol, 1994, 266(5 Pt 2): F731-F737.
[12] Nagase M, Shibata S, Yoshida S, et al. Podocyte injury underlies the glomerulopathy of Dahl salt-hypertensive rats and is reversed by aldosterone blocker [J]. Hypertension, 2006, 47(6): 1084-1093.
[13] Jennings BL, Anderson LJ, Estes AM, et al. Involvement of cytochrome P- 450 1B1 in renal dysfunction, injury, and inflammation associated with angiotensin II-induced hypertension in rats [J]. Am J Physiol Renal Physiol, 2012, 302(4): F408-F420.
[14] Mattace Raso G, Simeoli R, Russo R, et al. N-Palmitoylethanolamide protects the kidney from hypertensive injury in spontaneously hypertensive rats via inhibition of oxidative stress [J]. Pharmacol Res, 2013, 76: 67-76.
[15] Eddy AA. Molecular basis of renal fibrosis [J]. Pediatr Nephrol, 2000, 15(3-4): 290-301.
