喹赛多及其两种代谢产物在鸡体内消除规律研究
2018-03-05斯琴朝克图章爱群毛清黎杨新河袁宗辉
斯琴朝克图,章爱群,毛清黎,杨新河,袁宗辉
(1.湖北工程学院生命科学技术学院,湖北省植物功能成分利用工程技术研究中心,湖北孝感 432000;2.国家兽药残留基准实验室(HZAU)/农业部食品安全评价重点开放实验室,国家兽药安全评价实验室,华中农业大学动物医学院,武汉 430070 )
喹赛多(Cyadox, CYX),化学名为2-喹噁啉亚甲肼基氰基乙酸-1,4-二氧化物,卡巴氧、喹乙醇等同属于喹噁啉-N-1,4-二氧化物的衍生物[1],是一种新型的抗菌促生长类饲料添加剂,是喹乙醇的换代产品,用于猪、牛、禽类养殖生产[2]。卡巴氧和喹乙醇等同类药物已经有文献报道证明有较强的毒副作用,已被不同国家和地区限制和禁止使用[3]。喹赛多是喹噁啉类药物的新品种,大量研究证明,喹赛多可以促进畜禽的生长[4-6],且与同类药物相比毒性小,安全性好[7-9],是一种比较理想的抗菌药物促生长剂。CYX的上述研究表明其对家禽具有促生长作用,提示CYX存在应用于家禽生产的潜能。CYX作为食品生产动物用药,食品安全性是其开发应用前景重要指标。兽药残留是影响食品安全性的主要因素之一,药物代谢与残留消除规律研究则是避免残留的科技基础。CYX在其重要靶动物之一的鸡体内分布、消除、代谢和排泄研究报道较少,研究内容不成系统,残留消除规律和代谢过程不明确。为了丰富和完善CYX在鸡体内药理学和毒理学研究数据,用于食品安全风险评估,本文以肉用鸡作为研究载体,针对CYX、BDCYX和QCA建立并优化了高效液相色谱定量分析方法,并采用推荐剂量连续混饲给药7 d和一次性灌胃给药的方法,研究CYX及其代谢产物在鸡血浆、胆汁、可食性组织和排泄物中的消除规律,探讨了三种化合物在鸡体内动态变化规律。
1 材料与方法
1.1 仪器与设备 Waters高效液相色谱系统:由Waters 600 controller, 717plus Autosampler 和2996 Photodiod Array detector组成(购自美国Waters公司);高速冷冻离心机,HITACHI CR21G型(购自日本日立公司);Agilent 20管固相萃取装置(购自美国安捷伦公司);JHD-002全自动氮吹仪(上海极恒实业有限公司)等。
1.2 药物与试剂 CYX(纯度99.8%;批号20110315),由华中农业大学兽药研究所合成;BDCYX(纯度99.8%;批号20110108),由华中农业大学兽药研究所合成;QCA(纯度97%;批号2010CJ)购自美国SIGMA-ALDRICH公司。偏磷酸甲醇溶液:称取偏磷酸100 g,加入水,加热沸腾至溶解,冷却后加入甲醇200 mL,然后再加水定容至1000 mL,混匀,配置成5%偏磷酸10%甲醇水溶液。磷酸缓冲液(0.01 mol/L):称取磷酸氢二钾(K2HPO4·3H2O)2.28 g,置于1000 mL容量瓶中,加入900 mL水溶解,浓磷酸调pH值至7.0,加水定容至1000 mL。
1.3 试验动物 AA肉鸡30羽(购自武汉正大有限公司,中国武汉,1日龄),公母各半。给药时体重为1.62±0.10 kg。分别在不锈钢鸡笼内适应饲养一周,环境温度控制在20~26 ℃,相对湿度40%~70%,维持12 h光照,非给药期间饲喂不含药物的全价日粮,自由采食和饮水,观察鸡每日健康状况。
1.4 样品提取与净化
1.4.1 血浆中CYX和BDCYX的提取与净化 血样4000 r/min离心10 min,取上层血浆0.3 mL,加入甲醇0.3 mL,旋涡混合3 min,10000 r/min,4 ℃离心10 min,取上清液20 μL供HPLC检测。
1.4.2 组织样品和排泄物中CYX和BDCYX的提取与净化 精密称取匀浆后的组织样品和粪便2 g(精确到0.01 g)、尿液2 mL,加蒸馏水1 mL后混匀。另加入乙酸乙酯4 mL,旋涡混合3 min,超声约1 min,静置10 min,10000 r/min离心10 min,取上清液。残渣用上述提取步骤重复两次,合并三次抽提液,在50 ℃水浴中氮气吹干。加入乙腈2 mL溶解残渣,旋涡混合1~2 min,分别加正己烷3 mL,旋涡混合1~2 min,静置5 min,去脂肪层,重复去脂2~3次。乙腈层50 ℃水浴中氮气吹干,20%乙腈/水1.0 mL溶解残渣,旋涡混合1~2 min,静置。上清液供HPLC检测。
1.4.3 血浆、组织样品和排泄物中QCA的提取与净化 称取匀浆肌肉组织2 g(精确到0.01 g)置于具塞离心管中,加5%偏磷酸10%甲醇溶液8 mL,旋涡混合2~3 min,在25 ℃下6000 r/min离心15 min,取出上清液,然后再向组织样品中加5%偏磷酸10%甲醇溶液8 mL重复提取一次,合并2次上清液。上清液中加乙酸乙酯8 mL,旋涡混合1 min,8000 r/min离心10 min,取有机相层,再加乙酸乙酯8 mL重复提取,合并2次有机相。有机相中加磷酸盐缓冲液6 mL,旋涡混和2~3 min,放置10 min,使下层清晰,收集水相。另用磷酸盐缓冲液6 mL提取乙酸乙酯相一次。使水相清晰,合并2次水提取液。
称取匀浆肝脏样品2 g(血浆2 mL,粪便2 g,精确到0.01 g)置于具塞离心管中,加5%偏磷酸10%甲醇溶液8 mL,旋涡混合2~3 min,在25 ℃下6000 r/min离心15 min,取出上清液,然后再向组织样品中加5%偏磷酸10%甲醇溶液8 mL重复提取一次,合并2次上清液。于上清液中加乙酸乙酯8 mL,旋涡混合2~3 min,8000 r/min离心10 min,取有机相层,再加乙酸乙酯8 mL重复提取,合并2次有机相。其余步骤同肌肉样品处理方法。
MAX柱依次用甲醇3 mL、水3 mL活化。加样品提取液至MAX柱中,控制流速小于3 mL/min,先后用0.05 mol/L NaOH 3 mL,甲醇3 mL淋洗,抽干,2%甲酸甲醇溶液3 mL洗脱,洗脱液置45~50 ℃水浴氮气吹干,加20%乙腈/水1.0 mL溶解残渣,旋涡混匀,待测。
1.5 色谱条件 色谱柱为Agilent Eclipse XDB-C18,5 μm,250 mm×4.6 mm。流动相为乙腈-水(20∶80V/V)分离CYX和BDCYX。乙腈-1%甲酸水溶液(20∶80V/V)分离QCA。波长为CYX 305 nm,BDCYX 280 nm,QCA 320 nm。流速为1.0 mL/min。进样量CYX和BDCYX为 20 μL,QCA为40 μL。柱温30 ℃。
1.6 喹赛多,脱二氧喹赛多和喹噁啉-2-羧酸的消除规律研究
1.6.1 血浆、肌肉和肝脏中消除规律研究 20羽鸡分成5组,每组4只,公母各半,按促生长作用最大推荐剂量混饲(100 mg/kg)连续给药7 d。另设空白组4羽鸡,公母各半,每羽单独放入代谢笼内,同法给空白饲料,饲养条件同上。停药后,在6 h, 1 d, 3 d, 7 d和14 d等时间点随机颈静脉放血宰杀一组,血液收集于含有1%肝素生理盐溶液0.1 mL的10 mL离心管内,称重,离心,取血浆,动物解剖后收集其肌肉和肝脏,称重后立即用HPLC检测。
1.6.2 排泄规律研究 6羽鸡,公母各半,单独置于代谢笼内,适应3 d,给药前在肛门缝合接收排泄物的软塑料瓶,每羽鸡按10 mg/kg b.w.(相当于按促生长最大推荐剂量混饲给药100 mg/kg的一日药物摄入量)分别一次性灌胃给药。给药后,分别在0~12、12~24、24~48、48~72、72~96、96~120、120~144和144~168 h时间段收集粪便,每次收集后称重,立即用上述方法制样,检测。另3羽鸡不给药,分别收集粪便作为空白样。
2 结果与分析
2.1 定量分析方法确定
2.1.1 色谱分离 经流动相的组成,比例、柱温、检测波长等进行筛选和优化(1.5项),确定了CYX、BDCYX和QCA的色谱分离条件,均以二极管阵列方法扫描,结果显示,CYX,BDCYX和QCA保留时间分别为6.8 min,22.2 min和6.6 min。其标准溶液色谱图见图1和图2。
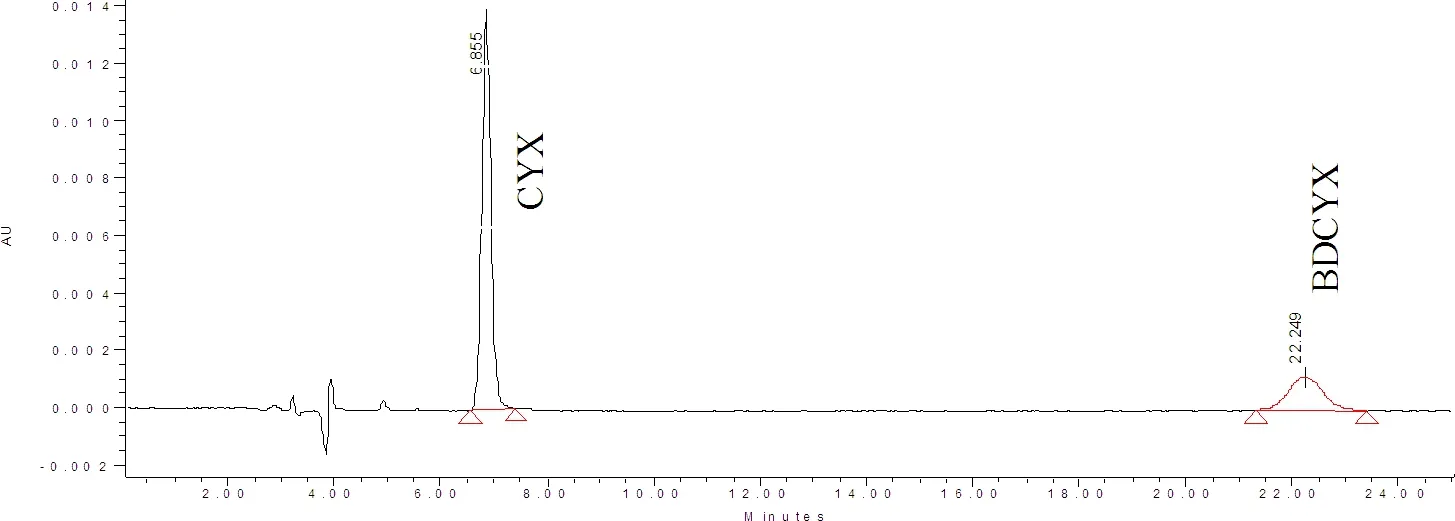
图1 CYX、BDCYX标准溶液色谱图Fig 1 Chromatograms of CYX and BDCYX in standard solutions
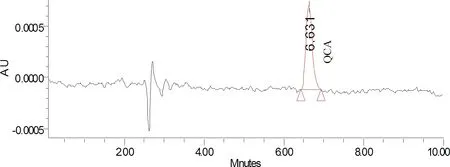
图2 QCA标准溶液色谱图Fig 2 Chromatograms of QCA in standard solutions
2.1.2 线性范围、回归方程、检测限及定量限 分别取CYX,BDCYX,QCA标准贮备液适量,用流动相稀释成浓度为0.02、0.04、0.08、0.16、0.32、0.64、1.00、2.00 μg/mL的标准工作液,进HPLC测定,每个浓度的标准工作液测定3次。不同时间内重复上述操作3次。将各浓度与对应峰面积均值作线性回归,即得线性方程。结果表明,CYX、BDCYX和QCA标准溶液线性范围为0.02~2.00 μg/mL时,其线性方程分别为y=122100x+1978.8(r=0.9996)、y=81486x+1415.2(r=0.9996)和y=82807x-1831.1(r=0.9997)。
通过测定不同浓度三种化合物的信噪比(S/N),确定其检测限(S/N=3)和定量限(S/N=10)。CYX、BDCYX和QCA在血浆、肌肉、脂肪、肝脏、肾脏、胆汁中的最低检测限均为10 μg/kg,最低
定量限分别为20、25、25 μg/kg;三种化合物在粪便样品中的最低检测限均为100 μg/kg,最低定量限分别为250、500、500 μg/kg。
2.1.3 回收率与精密度 未给药鸡相应组织和粪便作为空白样品,加入适量标准溶液,使三种化合物在血浆、肌肉、脂肪、肝脏、肾脏、胆汁中的浓度分别为20、40、80 μg/kg,粪便中的浓度分别为250、500、1000 μg/kg,按照样品制备方法处理后经HPLC检测。结果表明,当QCA的回收率在71.31%~106.55%,CYX的回收率范围在71.43%~90.41%之间,BDCYX的回收率范围在70.44%~92.39%之间,回收率和标准偏差均满足定量分析方法需要。CYX、BDCYX和QCA在鸡血浆、胆汁、组织和和粪便中的添加回收率见表1。

表1 CYX、BDCYX和QCA在鸡血浆、胆汁、组织和粪便中的添加回收率(n=5)Tab 1 Recoveries of CYX, BDCYX and QCA added to plasma, bile, tissues and feces of chickens (n=5)
2.2 连续混饲给药7 d停药后血浆、胆汁和组织中三种化合物消除规律 鸡连续混饲给药7 d,停药后CYX、BDCYX 和QCA在血浆、胆汁和组织中的浓度见表2。鸡连续混饲给药 7 d,停药后CYX原形在血浆、肝脏、肌肉、脂肪、肾脏中未检出,只有在胆汁内6 h内检测到少量CYX原形(图3)。BDCYX只在肝脏内6 h和24h时间点能够检测到少量残留(图4)。QCA在停药后6 h的血浆、肌肉和脂肪(图5)中检到微量残留,其含量在定量限以下;肝脏和肾脏中可一直检测到72 h(图6和图7);在胆汁中未检测到QCA。结果表明,CYX代谢速度快,除6 h胆汁内检测到微量原形外其余血浆和组织中未发现其残留。CYX重要代谢产物BDCYX只在肝脏内残留至24 h。另一代谢产物QCA的分布较为广泛,血浆、肝脏、肌肉、脂肪和肾脏内均有一定残留,肝脏和肾脏中残留量较大,维持时间长,直至72 h。胆汁内未发现QCA残留。
2.3 一次性灌服CYX后排泄物中三种化合物的消除规律 鸡一次性灌服CYX后CYX、BDCYX和QCA的排泄规律见表3。试验结果表明,鸡一次性最大推荐剂量灌服CYX后,在粪便中均能检测到三种化合物(图8),CYX和BDCYX能检测到24~48 h,而QCA可一直检测到48~72 h,72 h之后三种化合物均无法检出。

表2 鸡连续混饲给药7 d停药后CYX、BDCYX 和QCA在血浆、胆汁、组织中浓度(μg/kg)(n=4)Tab 2 Concentrations (μg/kg) of CYX,BDCYX and QCA in samples of chicken administered CYX at 10 mg/kg bw for 7 consecutive days (n=4)
ND-低于检测限或未检出
ND - Lower than LOD or no detectable.
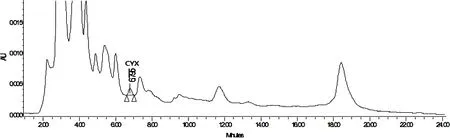
图3 停药后6 h 鸡胆汁中CYX色谱图Fig 3 Chromatograms of CYX in chicken bile of slaughtered at 6 h
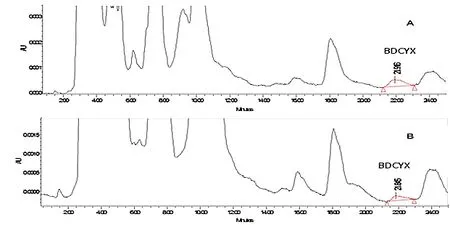
图4 停药后6 h(A)和24 h(B)鸡肝脏中BDCYX的色谱图Fig 4 Chromatograms of CYX and BDCYX in chicken liver of slaughtered at 6h

图5 停药后6 h鸡血浆(A)、肌肉(B)和脂肪(C)中提取QCA的色谱图Fig 5 Chromatograms of QCA in chicken plasma(A), muscle(B) and fat(C) of slaughtered at 6 h

图6 停药后6 h(A)、24 h (B)和72 h(C)鸡肝脏中QCA的色谱图Fig 6 Chromatograms of QCA in chicken liver of slaughtered at 6 h (A), 24 h (B) and 72 h (C)

图7 停药后6 h(A)、24 h (B)和72 h(C)鸡肾脏中QCA的色谱图Fig 7 Chromatograms of QCA in chicken kidney of slaughtered at 6 h (A), 24 h (B) and 72 h (C)

时间TimeCYX/(μg·kg-1)BDCYX/(μg·kg-1)QCA/(μg·kg-1)0~12h23486.01±7.3640822.64±9.3114417.40±8.4312~24h1373.69±6.222295.21±7.141146.81±6.3524~48h74.64±4.67124.60±8.47493.20±9.6848~72hNDND29.78±6.7972~96hNDNDND
ND-低于检测限或未检出
ND-Lower than LOD or no detectable.

图8 鸡粪便中CYX,BDCYX和QCA色谱图Fig 8 Chromatograms of CYX , BDCYX and QCA in chicken feces
3 讨论与小结
建立更简便快速的检测方法,适应基层单位和相关研究者的应用需求是本文目的之一。此前CYX及其代谢产物的检测方法较多,如黄伶俐[5]和Wu Y等[10]建立了CYX及其两种已经拥有权威对照品的两种重要代谢产物脱二氧喹赛多(BDCYX)和喹噁啉-2-羧酸(QCA)在不同动物和介质中的检测方法,并以不同研究目的进行鸡体内跟踪和定量分析研究。杨雪等[11]建立了BDCYX在大鼠体内血浆及组织中的检测方法并进一步完成了药代动力学研究。另外还有用HPLC/MS/MS、超高效液相色谱串联四级杆-飞行时间质谱等方法检测鸡体内或其他动物源性食品中CYX残留的方法报道[12-14]。尽管LC/MS联用方法有其检测限低,灵敏度高,流动相消耗少等优点,但HPLC检测方法使用简便,完全可以满足现有的食品残留检测要求,而且在基层检测单位普及率高,方法利用率高等优点。已报道的HPLC方法中检测方法、给药方式和研究重点不尽相同,缺少部分重要组织和排泄物中提取、纯化和检测方法,已有的方法步骤繁琐,但这些结果也为本研究提供了很多可以借鉴的思路和数据。
关于喹赛多在鸡体内残留消除研究报道,因为其研究目的和意义不同,其给药方式、鸡的种类、日龄、检测对象及其检测方法都有很大的不同,结果也不尽相同。如黄伶俐[5]进行的CYX在鸡体内残留消除研究中,检测方法、给药方式、研究目的和结果与本研究存在较大差别,但有一定互补性。给药时间长短、肉鸡日龄不同等是导致三种化合物残留时间和含量等消除规律不同的主要原因。邱玉敏[16]对科宝肉鸡连续饲喂CYX 150 mg/kg的加药饲料40 d,在停药后不同时间段随机宰杀一组动物,取肝脏、肾脏、肌肉和皮脂进行了检测。结果显示,肝脏和肾脏中均检测到一定量的CYX、BDCYX和QCA,但本研究所检测的时间段未能检出CYX,BDCYX和QCA在24 h后无法检出。QCA在肝脏和肾脏中均可检测到72 h,BDCYX在肾脏中未检出,肝脏中24 h后即未检出。此报道中肌肉和脂肪中在6 h时还检测到少量QCA。颜丹丹[17]采用高效液相色谱-串联质谱法建立了喹赛多及其主要代谢物在鸡肝脏、肾脏、皮脂和肌肉中的残留检测方法,研究了上述三种化合物在鸡体内的残留消除规律。科宝-500白羽鸡,按50 mg/kg b.w.剂量灌服喹赛多,一天两次,连续给药7 d。分别于停药后4、12、24、48、72、120、168 h随机宰杀一组取样、检测。结果显示,喹赛多及其2种代谢物在肌肉、肾脏和皮脂中均能检出,肝脏中除喹赛多原形外,其余均能检出。CYX、BDCYX在各组织中的残留量均显著低于QCA,而QCA在肝脏和肾脏中的残留时间较皮脂与肌肉中长。总结本文研究方法和结果表明,CYX连续混饲给药7 d(血药浓度达到稳态浓度的最低时限),在停药后6 h除了胆汁中检测到微量CYX以外,在所检测的血浆、肝脏、肾脏、肌肉、脂肪中均未检测到CYX,只在胆汁中少量检出。此前未见胆汁中CYX及其代谢产物报道;停药后6 h和24 h的肝脏样品中检测到BDCYX,而在其他组织中在任何时间段都未能检测出BDCYX。除了胆汁以外,其他上述5种组织中均检测到CYX重要代谢产物QCA。肝脏和肾脏中一直检测到72 h还有一定量的QCA残留可检出。经分析认为,连续混饲给药达到血药浓度稳态后,上述三种重要代谢产物中QCA的残留时间较长,其肝脏中回归方程为y=-0.0278x+5.245,相关系数为0.9956,其半衰期(t1/2)为24.93 h;肾脏中回归方程y=-0.0328x+6.404,相关系数为0.9454,半衰期(t1/2)为21.13 h。说明鸡体内肝脏中的QCA残留时间最长,而且其放射性示踪研究[18]表明,与两种组织中的总残留消除规律存在高度相关性。此前方桂杰相关研究[19]证明,CYX肌肉安全浓度为30 μg/g,肝脏安全浓度为90 μg/g,肾脏和脂肪安全浓度为180 μg/g。而本试验零休药期(6 h)的鸡肝脏、肌肉、肾脏和脂肪中总残留浓度分别为3.08、0.65、3.67、0.26 μg/g。表明在零休药期及之后在可食性组织中的CYX残留量均远低于安全浓度。
关于CYX及其代谢产物在粪便和胆汁等排泄相关研究比较少见。研究报道主要以放射性总残留研究为主[17-18]。本文中胆汁和粪便排泄规律研究是鸡体内物料平衡研究(氚标记CYX)的一部分[18]。本文研究结果显示,排泄物中CYX原形和BDCYX在给药后2 d即无法检出,QCA可检测到第3天,与黄伶俐[5]等研究相比给药量少,但三种化合物从粪便中消除时间均更长。
研究改进了CXA原形及其两种重要代谢产物BDCYX和QCA的提取、纯化和检测方法,为今后进行相关研究提供了直接采用的简单方法,为确证体内生成的多种代谢产物的存在形式提供了提取方法和色谱分离技术,并通过不同给药方式研究CYX及其代谢产物在鸡血浆、胆汁、可食性组织和排泄物中消除规律,为后期体内外处置和鸡可食性组织中的残留研究提供了可借鉴的参考数据。
[1] Vries H D, Bojarski J, Donker A A,etal. Photochemical reactions of quindoxin, olaquindox, carbadox and cyadox with protein, indicating photoallergic properties[J]. Toxicology, 1990, 63(1):85-95.
[2] De Graaf G J, Spierenburg T J. Liquid chromatographic determination of cyadox in medicated feeds and in the contents of the porcine gastrointestinal tract with fluorescence detection.[J]. Journal of Chromatography A, 1988, 447(1):244-248.
[3] Qian C, Tang S S, Xi J,etal. Investigation of the genotoxicity of quinocetone, carbadox and olaquindox in vitro using Vero cells.[J]. Food & Chemical Toxicology An International Journal Published for the British Industrial Biological Research Association, 2008, 47(2):328-334.
[4] Wang Y, Yuan Z, Zhu H, Ding M, Fan S. Effect of cyadox on growth and nutrient digestibility in weanling pigs.[J]. South African Journal of Animal Science, 2005,35(2):117-125.
[5] 黄玲利. 喹赛多在肉鸡的有效性与安全性研究[D]. 武汉:华中农业大学, 2005.
HUANG L L. Effectiveness and safety studies of Cyadox in broilers[D]. Wuhan:Huazhong Agricultural University, 2005.
[6] Ding M X, Yuan Z H, Wang Y L,etal. Olaquindox and cyadox stimulate growth and decrease intestinal mucosal immunity of piglets orally inoculated with Escherichia coli.[J]. Journal of Animal Physiology and Animal Nutrition, 2006, 90(5-6):238-243.
[7] He Q, Fang G, Wang Y,etal. Experimental evaluation of cyadox phototoxicity to Balb/c mouse skin.[J]. Photodermatology Photoimmunology & Photomedicine, 2006, 22(2):100-4.
[8] Wang X, He Q H, Wang Y L,etal. A chronic toxicity study of cyadox in Wistar rats.[J]. Regulatory Toxicology & Pharmacology, 2010, 59(2):324-33.
[9] Fang G, He Q, Zhou S,etal. Subchronic oral toxicity study with cyadox in Wistar rats.[J].Food & Chemical Toxicology An International Journal Published for the British Industrial Biological Research Association, 2006, 44(1):36-41.
[10]Wu Y, Huan Yu, Wang Y,etal. Development of a high-performance liquid chromatography method for the simultaneous quantification of quinoxaline-2-carboxylic acid and methyl-3-quinoxaline-2-carboxylic acid in animal tissues.[J]. Journal of Chromatography A, 2007, 1146:1-7.
[11]杨雪, 赵东豪, 于洋,等. 脱二氧喹赛多在大鼠血浆及组织的药代动力学研究[J]. 中国兽医杂志, 2015, 51(6):97-99.
YANG X, ZHAO D H, YU Y,etal. Plasma and Tissue Pharmacokinetics of 1,4-bisdesoxycyadox in Rats[J]. Chinese Journalof Veterinary Medicine,2015, 51(6):97-99.
[12]杨方, 刘正才, 叶松生,等. HPLC-MS/MS法测定动物源性食品中喹赛多的残留量[J]. 药物分析杂志, 2008,(4):630-633.
YANG F, LIU Z C, YE S S,etal. HPLC一MS/MS Determination of Cyadox Residues in Animal Origin of Foodstuffs[J]. Chinese Journal of Pharmaceutical Analysis, 2008,(4):630-633.
[13]杨术鹏, 王莹, 李彦伸,等. 超高效液相色谱串联四级杆/飞行时间质谱仪鉴定喹赛多在鸡体内代谢研究[J]. 中国畜牧兽医, 2013, 40(3):11-19.
YANG S P, WANG Y, LI Y S,etal. Identification of Metabolites Cyadox in vivo Produced by Chicken Using Ultra Performance Liquid Chromatography/Quadruple Time of Flight Tandem Mass Spectrometry[J]. China Animal Husbandry & Veterinary Medicine, 2013, 40(3):11-19.
[14]叶松生, 吴德峰, 刘正才,等. 高效液相串联质谱法测定动物源食品中喹赛多、卡巴氧残留[J]. 福建农林大学学报(自然版), 2008, 37(3):307-311.
YE S S, WU D F, LIU Z C,etal. Determination of Cyadox, Carbadox in Animal Origin Foodstuffs by Liquid Chromatography-electrospray Tandem Mass Spectrometry[J]. Journal of Fujian Agriculture and Forestry University (Natural Science Edition), 2008, 37(3):307-311.
[15]斯琴朝克图, 黄玲利, 袁宗辉. 喹赛多及其两种代谢产物在大鼠体内消除规律研究[J]. 中国兽药杂志,2017,51(4):42-49.
HARNUD S, HUANG L L, YUAN Z H. The use of radiolabeled drugs in drug metabolism and disposition studies[J]. Chinese Journal of New Drugs, 2017,51(4):42-49.
[16]邱玉敏. 喹赛多在猪、鸡和鱼体内的残留消除研究[D]. 武汉:华中农业大学, 2012.
QIU Y M. The Residue Depletion Studies of Cyadox in Swine, Chicken and Fish[D]. Wuhan:Huazhong Agricultural University, 2012.
[17]颜丹丹. 喹赛多及其主要代谢物在鸡组织中的残留检测方法及消除规律研究[D]. 广州:华南农业大学, 2012.
YAN D D. Determination Method and Residue Depletion of Cyadox and its Main Metabolites in Chicken Tissues[D].Guangzhou:South China Agricultural University, 2012.
[18]斯琴朝克图. 氚标记喹赛多的制备及其在大鼠和鸡体内处置研究[D]. 武汉:华中农业大学, 2011.
HARNUD S. The Synthesis of Tritium Labeled Cyadox and its Disposition in Rats and Chicken[D]. Wuhan:Huazhong Agricultural University, 2011.
[19]方桂杰. 喹赛多临床前毒理学安全性评价[D]. 武汉:华中农业大学, 2006.
FANG G J. Safety Evaluation of Preclinical Toxicology of the Patients With Multiple Clinical Trials[D]. Wuhan:Huazhong Agricultural University, 2011.
