人巨细胞病毒UL133基因型在婴幼儿肝功能损伤中的分子机制
2018-03-05温正旺陈敏陈洁石海矾蔡晓红陈益平
温正旺 陈敏 陈洁 石海矾 蔡晓红 陈益平
人巨细胞病毒(human cytomegalovirus,HCMV)是一种引起婴幼儿肝炎最常见的病原体[1]。HCMV肝炎占婴幼儿肝炎综合征的30%~40%或更高,临床表现多样(无症状的感染、胆汁淤积型肝炎甚至胆道闭锁),尤其是亚临床型肝炎最为常见,严重危害婴幼儿的生命与健康。人群普遍感染HCMV,其特异性IgG抗体阳性率可高达90%[2]。国内流行病学调查发现,婴幼儿HCMVIgG抗体阳性率为70%~90%[3]。为何有些婴幼儿HCMV感染会导致HCMV肝炎呢?既往研究提示HCMV中含有数百个基因型,其中UL133基因型与婴幼儿HCMV肝炎密切相关,但其具体的病理、生理机制尚不明确。本课题通过筛查HCMV肝炎患儿中病毒是否含有UL133基因型,并检测血液中肝细胞损伤相关蛋白的表达,来探索HCMV UL133基因型对婴幼儿肝功能损伤的分子机制。现将结果报道如下。
1 对象和方法
1.1 对象 选择2016年1至12月本院收治的68例HCMV肝炎患儿和66例同期门诊体检肝功能正常且确诊HCMV感染(尿液中可检出HCMV包涵体)的患儿为研究对象。肝炎患儿中男38例,女30例;年龄(8.35±3.6)个月。体检患儿中男34例,女32例;年龄(8.36±2.7)个月。肝炎患儿与体检患儿性别、年龄比较差异均无统计学意义(均P>0.05)。本研究通过医院伦理委员会审批,且患儿家属知情同意。
1.2 尿液HCMV DNA的检测 留取患儿尿液10ml,利用PCR扩增结合测序以及原位杂交技术,明确患儿尿液HCMV是否存在UL133基因型。RT-PCR引物购自上海基康生物工程有限公司。
1.3 血液 Caspase-3、Caspase-6蛋白表达的检测Caspase-3和Caspase-6ELISA试剂盒购自美国Pepro-Tech公司;Caspase-3抗体、Caspase-6抗体购自英国Abcom公司。抽取患儿血液3ml,采用ELISA法检测。向预先包被了Caspase-3、Caspase-6单克隆抗体的酶标孔中加入Caspase-3、Caspase-6,温育;加入生物素标记的Caspase-3抗体、Caspase-6抗体,与链霉亲和素-HRP结合形成免疫复合物,温育,洗涤;去除未结合的酶,加入底物A、B,产生蓝色;在酸的作用下转化成最终的黄色。颜色深浅与Caspase-3、Caspase-6蛋白浓度有关,根据标准品的浓度及对应的OD值计算出标准曲线的直线回归方程,再根据样品的OD值在回归方程上计算出对应的样品浓度。
1.4 观察指标 观察并比较患儿尿液中HCMV UL133基因型,血液中Caspase-3、Caspase-6蛋白表达水平及肝功能指标。
1.5 统计学处理 应用SPSS19.0统计软件。计量资料用表示,组间比较采用两独立样本t检验;计数资料用率表示,组间比较用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 UL133基因型筛查结果 肝炎患儿尿液中UL133基因型筛查阳性率达94.1%,明显高于体检患儿的3.0%,差异有统计学意义(P<0.05),见表1。其中UL133基因型筛查阳性的64例肝炎患儿为UL133阳性组,UL133基因型筛查阴性的64例体检患儿为UL133阴性组。

表1 UL133基因型筛查结果
2.2 两组患儿血液中Caspase-3、Caspase-6蛋白表达水平比较 UL133阳性组患儿血液中Caspase-3、Caspase-6蛋白表达水平均明显高于UL133阴性组,差异均有统计学意义(P<0.05),见表2。
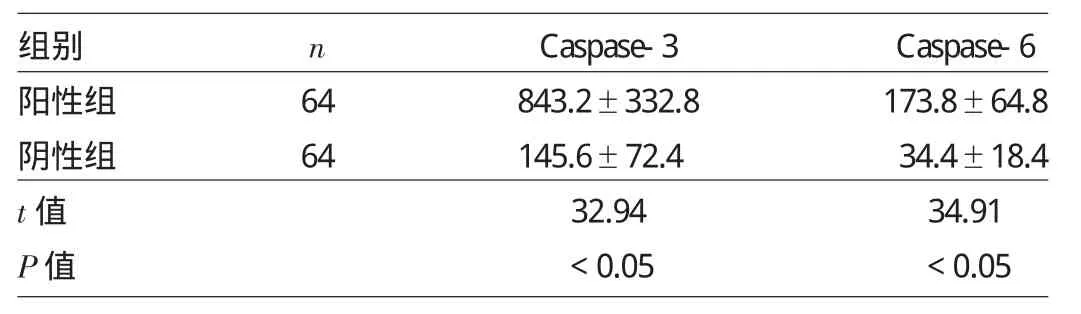
表2 两组患儿血液中Caspase-3、Caspase-6蛋白表达水平比较
2.3 两组患儿肝功能指标比较 两组患儿血AST、TBiL、DBiL、谷氨酰转移酶(GGT)比较,差异均无统计学意义(均P>0.05);UL133阳性组患儿血ALT明显高于UL133阴性组,差异有统计学意义(P<0.05),见表3。

表3 两组患儿肝功能指标比较
3 讨论
HCMV属于疱疹病毒β亚科,是一种广泛分布的机会致病性病毒,具有潜伏活动的生物学特点。HCMV的自身DNA系列中含有免疫逃避基因,其基因组中含有人细胞因子及细胞因子受体的类似基因,可表达人细胞因子及细胞因子受体的类似物,从而干扰宿主自身的细胞因子系统;也能影响免疫系统,特别是抗原呈递细胞的抗原呈递功能,即通过下调人类白细抗原I的表达致使T细胞对抗原肽分子的识别受到抑制,同时CD4分子的共受体也相应受损,第一信号传导障碍,抑制T细胞激活,从而逃避机体免疫系统的攻击。HCMV感染可引起机体宿主细胞发生凋亡,而HCMV具有许多抗凋亡的机制和细胞毒性T细胞杀伤机制,使感染细胞长期存活;以上方式相互作用,使病毒感染后处于静息平衡状态;当机体免疫功能低下时,潜伏在体内的HCMV可激活,病毒大量复制,发生显性感染。在临床上,当HCMV感染肝细胞时,一部分患儿出现肝功能受损,表现为亚临床型肝炎、黄疸型肝炎、无黄疸型肝炎、胆汁淤积型肝炎、胆汁淤积症等,大部分患儿仅提示存在HCMV感染;同样一种病毒感染,肝炎患儿并未表现出具有明显差异的免疫功能损伤及低下,但临床症状却差异很大。HCMV感染可导致全身各系统组织器官发生损伤,但关于HCMV感染导致婴幼儿长期黄疸的研究中,通过组织活检以及免疫染色法,发现HCMV只存在于肝脏中,其他组织免疫染色都呈阴性[4];且同一器官中,HCMV的靶细胞也存在特异性,即在HCMV肝炎中,HCMV主要感染肝细胞、血管内皮细胞及胆管上皮细胞,其他细胞中则检测不出HCMV包涵体。因此,笔者提出一种假设,即HCMV基因系列中存在一些病毒亲嗜性基因,以促进HCMV入侵肝细胞,从而导致HCMV肝炎的发生。因此,HCMV基因多态性的研究将有效揭示HCMV肝炎的肝损伤机制。
在人HCMV老鼠实验模型中,对人HCMV UL/b′区基因片段功能进行分析,发现部分该区基因片段的丢失可导致病毒毒力的改变[5];此外,HDAXX蛋白可以抑制HCMV即早基因的表达和病毒复制,但当HCMV UL82毒株感染机体后,分泌PP71蛋白,会减轻HDAXX的抑制作用[5]。研究发现UL83基因型对脑组织血管平滑肌AT受体的表达水平影响很大,它可以促进AT1受体的表达,同时抑制AT2受体[6]。某肝癌研究发现,HCMV感染后可以激活IL-6R-JAK-STAT3信号通路,同时促进肝癌细胞的增殖,提示HCMV感染参与了肝癌细胞内的基因表达[7]。Guo等[8]研究证实HCMV β区UL144、UL146基因型与新生儿肝功能损伤密切相关,揭示β区基因型在HCMV肝损害中起重要作用。Petrucelli等[9]研究提示HCMV β区UL133基因型与HCMV的侵袭能力有关,可能与HCMV肝炎的发生、发展密切相关,但具体分子机制尚未完全阐明。因此,本课题研究重点仍是HCMV β区UL133基因型,拟通过检测血清中Caspase-3、Caspase-6蛋白表达水平,进一步探索UL133基因型与肝功能损伤的潜在分子机制,为HCMV肝炎的诊断与治疗提供一个新的靶点。
对HCMV肝炎患儿尿液进行筛查发现,所感染的HCMV普遍携带UL133基因型;进一步检测血清Caspase-3、Caspase-6蛋白表达,发现UL133阳性组与阴性组患儿的蛋白表达水平均明显上调。然而,在体检发现HCMV感染的患儿中,只有2例含有UL133基因型。此外,UL133阳性组患儿血液Caspase-3、Caspase-6蛋白表达水平均明显高于UL133阴性组组。既往研究表明肝炎患者Caspase-3、Caspase-6蛋白表达水平上调可直接诱导细胞凋亡,从而导致肝功能损伤[10-11]。值得注意的是,UL133阳性组与阴性组除血ALT外,AST、TBiL、DBiL、GGT 比较差异均无统计学意义;但是个别肝炎患儿血TBiL是存在升高的,部分患儿存在肉眼黄疸;以上结果提示在HCMV感染导致肝功能损伤的病理、生理过程中,可能存在基因的协同与抑制作用。
综上所述,携带有UL133基因型的HCMV感染婴幼儿后,可直接诱导Caspase-3、Caspase-6蛋白表达上调,从而导致肝功能损伤;未携带有UL133基因型的HCMV感染婴幼儿后,易处于潜伏感染状态。本课题主要从内部揭示HCMV UL133基因型诱导肝功能损伤的病理、生理机制,为HCMV基因型与机体肝功能损伤的内在相关性提供分子理论依据;关于HCMV基因多态性中的基因协同与抑制作用,将在后续课题中进一步研究。
[1]Mania A,Kemnitz P,Mazur-Melewska K,et al.Human cytomegalovirus infection and clinical status of infants born to human immunodeficiency virus type 1infected mothers[J].J Matern Fetal NeonatalMed,2012,25(2):180-186.
[2]Al-Alousy BM,Abdul-Razak SH,Al-Ajeeli KS,et al.Anti-HCMV IgG positivity rate among renal transplant recipients in Baghdad[J].SaudiJ Kidney DisTranspl,2011,22(6):1269-1274.
[3]Zhang Q,Gao Y,Peng Y,et al.Epidemiological survey of human cytomegalovirus antibody levels in children from Southeastern China[J].VirolJ,2014,11(1):123.
[4]Goedhals D,Kriel J,Hertzog ML,et al.Human cytomegalovirus infection in infants with prolonged neonatal jaundice[J].J Clin Virol,2008,43(2):216-218.
[5]Dulal K,Cheng T,Yang L,et al.Functional analysis of human cytomegalovirus UL/b'region using SCID-hu mouse model[J].J Med Virol,2016,88(8):1417-1426.
[6]Cantrell SR,Bresnahan WA.Human cytomegalovirus(HCMV)UL82 gene product(pp71)relieves hDaxx-mediated repression of HCMVreplication[J].J Virol,2006,80(12):6188-6191.
[7]Lepiller Q,Abbas W,Kumar A,et al.HCMV activates the IL-6-JAK-STAT3 axis in HepG2 cells and primary human hepatocytes[J].PLoS One,2013,8(3):e59591.
[8]Guo G,Zhang L,Lye S,et al.Polymorphisms and features of cytomegalovirus UL144 and UL146 in congenitally infected neonates with hepatic involvement[J].PLoS One,2017,2(12):e0171959.
[9]PetrucelliA,Umashankar M,Zagallo P,et al.Interactions between proteins encoded within the human cytomegalovirusUL133-UL138 locus[J].Journalof virology,2012,16(86):8653-8662.
[10]Wang Q,Chen J,Wang Y,et al.Hepatitis C virus induced a novel apoptosis-like death of pancreatic beta cells through a caspase 3-dependentpathway[J].PLoS One,2012,7(6):e38522.
[11]Wang Q,Na B,Ou JH,et al.Hepatitis B virus alters the antioxidant system in transgenic mice and sensitizes hepatocytes to Fas signaling[J].PLoS One,2012,7(5):e36818.
