重症社区获得性肺炎患者外周血单核细胞Toll样受体4的表达及临床意义
2018-03-05李俏俏李隆祥罗建华王晨潘君素
李俏俏 李隆祥 罗建华 王晨 潘君素
重症社区获得性肺炎(SCAP)病死率高,医疗费用高,是临床医生经常需要面对的棘手问题.对于SCAP在重视抗菌药物合理治疗的同时更应强调全身综合治疗,包括免疫调节治疗。Toll样受体(TLR)家族作为人体固有免疫系统中的细胞跨膜受体及模式识别受体之一,可以识别多种病原相关分子模式,继发产生大量炎症因子,从而在宿主防御中发挥重要作用。TLR家族具有多个成员,至今已发现15种TLRs,研究表明TLR4、TLR5、TLR9在革兰阴性菌引起的炎症反应中起重要作用,其中研究最为深入的是TLR4,主要表达于单核细胞、中性粒细胞、树突状细胞等多种免疫细胞上,是脂多糖(LPS)的天然受体[1]。在动物实验中,研究的较清楚的是TLR4与LPS介导的信号转导途径,其在内毒素耐受产生中亦起关键作用[2]。而SCAP患者外周血单核细胞TLR4的表达和炎性因子释放及体外LPS刺激后TLR4和炎性因子的表达情况及可能的临床意义,目前报道较少。本研究旨在探讨SCAP患者外周血单核细胞TLR4的表达情况及临床意义,现报道如下。
1 对象和方法
1.1 对象 选择2014年1月至2015年1月入住本院呼吸科(15例)及 ICU(35例)的 SCAP患者共 50例(SCAP组),其中男34例,女16例,年龄38~75岁(65±7)岁;根据肺炎严重程度评分系统[3]将SCAP组患者按照总分≤50分、51~70分、71~90分、91~130分和>130分,分为Ⅰ级(1例)、Ⅱ级(4例)、Ⅲ级(23例)、Ⅳ级(17例)和Ⅴ级(5例),并按Ⅰ~Ⅲ级、Ⅳ级、Ⅴ级分别划为低、中、高危者。入选标准:均为社区获得性肺炎患者,未到其他医院治疗;符合美国感染性疾病学会/美国胸科学会2007年颁布的成人社区获得性肺炎管理指南中危重症的分型标准。排除标准:院内获得性重症肺炎患者,有明确肿瘤病史;长期服用激素、免疫制剂史及免疫缺陷史。选取同期本院健康体检者50例作为对照组,其中男 32 例,女 18 例,年龄 35~71(62±9)岁。两组性别、年龄差异均无统计学意义(均P>0.05)。本研究经医院伦理委员会批准,所有受试者均签署知情同意书。
1.2 方法
1.2.1 病原菌分析 入院48h内32例SCAP患者获取合格痰标本,另18例获取经气管插管防污染毛刷标本,对这些标本进行病原菌分析。
1.2.2 外周血单核细胞的分离和鉴定 抽取两组受试者入院第1天空腹外周静脉血20ml,肝素抗凝并分离血清后,采用密度梯度离心法分离外周血单个核细胞,将细胞悬液置于细胞培养皿内,放置于37℃、5%CO2、饱和湿度的培养箱孵育2h后,获得贴壁单核细胞,加入1640完全培养液(武汉普诺赛生命科技有限公司,PM150110,500ml),培养12d后备用。在倒置相差显微镜(日本奥林巴斯,BX53)下观察细胞形态,采用流式细胞术对CD14阳性单核细胞进行鉴定。
1.2.3 cDNA模板的合成 本实验所用的试剂盒、生物酶、基因及引物均由上海生工生物工程技术有限公司提供。采用组织和细胞总RNA提取法(TRIzol法)提取单核细胞总RNA,逆转录合成cDNA模板,反应体系包括:1μg样本 RNA,水 10μl,RT 缓冲液 5μl,10mM 脱氧核糖核苷三磷酸(dNTP)1.25μl,40U/L RNA 酶抑制剂0.5μl,经 42℃ 15min,72℃ 5min,4℃ 5min 进行反转录,合成的cDNA模板-20℃保存备用。
1.2.4 TLR4 mRNA表达量及炎症因子水平的测定 采用实时定量PCR法测定TLR4 mRNA的表达量,反应体系包括:cDNA 模板 2μl,水 1μl,1μM 的正向引物1.5μl,1μM 的反向引物 1.5μl,DNA 酶 0.5μl,PCR 反应混合液(PCR Master Mix)5μl,经预变性:95℃,30s;变性:95℃,5s;退火:60℃,30s;延伸:72℃,30s;再延伸:72℃,1min;最后延伸:55℃,30s,循环 40 次,获得 PCR产物TLR4 mRNA,以内参GAPDH基因为内标,以2-△△Ct法计算TLR4 mRNA的相对表达量。TLR4及内参引物见表1。取分离出的血清,采用ELISA法测定 TNF-α、IL-6、IL-8、C 反应蛋白(CRP)、降钙素原(PCT)水平,具体操作步骤按试剂盒(上海恒远生物科技有限公司提供)说明书进行。在1640完全培养液中,进行重悬单核细胞,加入LPS 40g/ml,培养皿放置于 37℃、5%CO2饱和湿度的培养箱中孵育24h,然后收集单核细胞继续培养24h后离心,分离血清,实时定量PCR法检测TLR4 mRNA的表达量,ELISA法检测上清液中TNF-α、IL-6、IL-8、CRP、PCT 水平。

表1 T L R 4及内参引物
1.3 统计学处理 采用SPSS17.0统计软件,计量资料以表示,两组比较采用t检验,相关性分析采用Pearson相关。P<0.05为差异有统计学意义。
2 结果
2.1 SCAP组标本分离出的病原体 见表2。
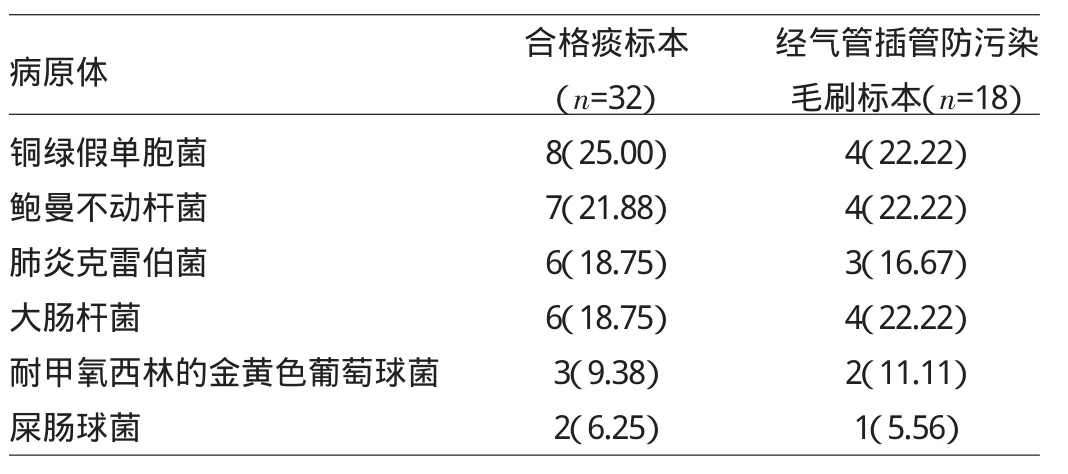
表2 S CA P组标本分离出的病原体[例(%)]
由表2可见,SCAP组病原体主要为革兰阴性菌,占84.00%,分别是铜绿假单胞菌12例(24.00%)、鲍曼不动杆菌11例(22.00%)、肺炎克雷伯菌9例(18.00%)、大肠杆菌10例(20.00%)。
2.2 两组在LPS刺激前、后外周血单核细胞TLR4 mRNA表达量及血清炎症因子水平比较 见表3。

表3 两组在L P S刺激前、后外周血单核细胞T L R 4m R N A表达量及血清炎症因子水平比较
由表3可见,LPS刺激前SCAP组外周血单核细胞TLR4 mRNA表达量显著高于对照组,血清TNF-α、IL-6、IL-8、CRP、PCT水平亦高于对照组,差异均有统计学意义(均P<0.05)。LPS刺激后,两组TLR4 mRNA表达量和血清 TNF-α、IL-6、IL-8、CRP 水平均较刺激前升高,差异均有统计学意义(均P<0.05),但PCT的表达水平差异无统计学意义(均P>0.05)。
2.3 SCAP组PSI评分与外周血单核细胞TLR4 mRNA表达量的相关性分析 SCAP组低危28例,TLR4 mRNA表达量8.03±3.17;中危17例,TLR4 mRNA表达量10.49±4.35;高危 5例,TLR4 mRNA 表达量 12.98±2.96。由此可见SCAP组PSI评分越高,TLR4 mRNA表达量也越高,两者呈正相关性(r=0.641,P<0.05)。详见图1。

图1 S CA P组外周血单核细胞T L R 4m R N A表达量与P S I评分的相关性散点图
3 讨论
本研究中SCAP组痰标本中分离出的病原菌主要是革兰阴性菌,占84.00%,分别是铜绿假单胞菌(24.00%)、鲍曼不动杆菌(22.00%)、肺炎克雷伯菌(18.00%)、大肠杆菌(20.00%)。LPS是革兰阴性菌细胞壁上主要的致病成分,LPS进入人体后能与单核细胞TLR4相结合,诱导宿主促炎和抗炎因子失衡性表达,进而发生多脏器功能衰竭,这也是重症肺炎死亡的原因之一[4]。TLR4作为LPS的模式识别受体,起着启动炎性反应的作用,因此TLR4过量表达与革兰阴性菌感染所致的SCAP密切相关[5]。
正常情况下,TLR4主要表达于单核细胞、中性粒细胞、树突状细胞等多种免疫细胞上,以内毒素结合蛋白-CD14-TLR4三聚体的形式识别LPS,并直接启动炎症反应的相关信号通路。TLR4的信号转导通路有髓样细胞分化因子88(MyD88)依赖和MyD88非依赖两条途径。MyD88依赖性信号通路[6],主要介导核因子-κB(NF-κB)的活化,激活的NF-κB转入细胞核内,最后导致 TNF-α、IL-1、IL-6、IL-8等炎症因子和调节因子的表达与生成,引发炎症级联反应。TLR4亦可激活MyD88非依赖性信号通路[7],即含TIR结构域诱导干扰素B-接头蛋白(IFNB-TRIF)依赖性信号通路。TLR4与TRIF相关接头分子(TRAM)连接,随即从细胞膜进入胞质与TRIF相互作用,TRIF进而与TRAF3和TRAF6联合,激活TANK结合激酶1(TBK1)与IKKe,活化干扰素调节因子3(IRF3),诱导干扰素B的转录。此外,TRAF6亦可通过受体相互作用蛋白1(RIP1)激活NF-κB和MAPK,诱导促炎性细胞因子合成和释放。但是过度的炎症反应可损伤机体正常组织细胞,引起多脏器功能不全。因此,测定TLR4 mRNA的表达量及下游炎症因子的水平,对SCAP病理机制的研究有着重要的意义。
本研究结果显示,SCAP组TLR4 mRNA的表达量及血清炎症因子水平均显著高于对照组,说明SCAP组患者体内TLR4 mRNA表达量升高,并与病情的严重程度呈正相关,这与Zhang等[8]的研究结果一致。高翔等[9]的研究表明,PCT是影响老年重症肺炎患者预后的重要指标,但在本实验中,SCAP组加入LPS刺激前后PCT的水平变化差异无统计学意义,可能提示PCT并非是TRL4介导的下游炎症因子。Dou等[6]认为,NF-κB信号转导通路是LPS所介导的信号转导通路中最重要的下游通路。TLR4主要通过活化核因子NF-κB,从而激活呼吸道上皮细胞,增加黏附分子表达,促进上皮细胞中炎性细胞浸润及产生氧自由基,导致呼吸道的慢性炎症及组织器官损害,这说明TLR4/NF-κB通路可能是触发炎症反应和器官损伤的关键靶点。本研究因条件限制,未能对NF-κB表达量进行检测分析,有待进一步探讨。
本研究表明,在LPS刺激后SCAP组和对照组TLR4 mRNA的表达量及血清炎症因子水平均增高,但SCAP组增幅仅为对照组的2%~18%,提示SCAP患者外周血单核细胞对LPS的反应受损,气道定植菌长期刺激外周血单核细胞TLR4及NF-κB信号通路处于活化状态,导致TLR4下调,降低了患者单核细胞对LPS的反应性,最终形成内毒素耐受,这与Mendes等[10]的研究结果一致。内毒素耐受是革兰阴性菌感染时机体重要的保护机制,能够明显减轻“二次打击”带来的损伤,对于提高重症肺炎患者生存率和改善预后具有积极意义。TLR4作为介导LPS信号转导的主要受体,其表达量和功能下调及TLR4信号通路中各个环节的功能缺陷,都将导致内毒素耐受产生。陈华文等[11]通过动物实验发现,LPS预处理确实具有诱导“内毒素耐受”的能力,能够减轻内毒素血症导致的肺损伤,其机制可能与抑制了炎症反应和氧自由基生成有关。另有研究表明,TLR4拮抗剂可通过降低LPS对TLR4的刺激,其机制是抑制NF-κB活化,下调促炎细胞因子的释放,从而减少肺组织损伤[12]。TANG等[13]研究发现,通过分析TLR4的表达量与老年重症肺炎患者的病死率相关。
综上所述,TLR4位于炎症信号转导的最上游环节,当革兰阴性菌感染引起SCAP时,TLR4 mRNA表达量显著增高,在启动抗感染的固有免疫中起关键作用。对TLR4的信号转导机制的进一步研究,将有助于我们更加明确疾病机制,从而为临床预防和治疗细菌感染提供新的思路和方法,TLR4拮抗剂有望成为SCAP诊治中新的分子治疗靶点。
[1]Wu Y,Liu Y,Huang H,etal.Dexmedetomidine inhibits inflammatory reaction in lung tissues of septic rats by suppressing TLR4/NFKB pathway[J].Mediators Inflamm,2013,5(6):21-29.
[2]胡佩佩,黄复深,牛俊超,等.猪胸膜肺炎放线杆菌感染小鼠所致炎症中TLR-4信号通路涉及细胞焦亡[J].微生物学报,2015,55(5):650-656.
[3]Fine MJ,Auble TE,Yealy DM,et al.Aprediction rule to identify lowrisk patients with community-acquired pneumonia[J].N Engl Med,1997,336(4):243-250.
[4]唐朝霞,曾勉,卢桂芳.重症肺炎患者血浆可溶性髓系细胞触发受体1、肿瘤坏死因子α和白细胞介素10水平变化的研究[J].中国呼吸与危重监护杂志,2011,10(5):424-428.
[5]黄继义,刘才文,林建东,等.内毒素急性肺损伤TLR4-LPS信号传导对NF-KB活性的影响[J].临床肺科杂志,2014,19(2):223-226.
[6]Dou W,Zhang J,Sun A,et al.Protective efect of naringenin against experimental colitis via suppression of Toll-like receptor 4/NF-KB signalling[J].Br J Nutr,2013,110(4):599-608.
[7]Vicky S,Cordula S.Lung cell-specific modulation ofLPS-induced TLR4 receptor and adaptor localization[J].Communicative and Integrative Biology,2014,7(1):531-539.
[8]Zhang L,Chen Y,Wang L,et al.Chloroquine relieves acute lung injury in rats with acute hemorrhagic necrotizing pancreatitis[J].Huazhong Univ SciTechnolog Med Sci,2013,33(3):357-360.
[9]高翔,严静,蔡国,等.老年重症肺炎机械通气患者预后影响因素分析[J].浙江医学,2015,37(17):1446-1448.
[10]Mendes ME,Baggio-Zappia GL,Brunialti MK,et al.Differential expression of toll-like receptor sigaling cascades in LPS-tolerant human peripheralblood mononuclear cells[J].Immunobiology,2011,216(3):285-295.
[11]陈华文,祝伟,冯俊,等.内毒素预处理对内毒素血症大鼠肺损伤的影响[J].中国呼吸与危重监护杂志,2012,11(4):395-398.
[12]Seki H,Tasaka S,Fukunaga K,et al.Effect of Toll-like receptor 4inhibitor on LPS-induced lung injury[J].Inflamm Res,2010,59(10):837-845.
[13]Lunxian Tang,Qinchuan Li,Jianwen Bai,et al.Severe Pneumonia Mortality in Elderly Patients Is Associated With Downregulation of Toll-like Receptors 2and 4on Monocytes[J].Am J Med Sci,2014,347(1):34-41.
