马耳他布鲁氏菌OmpR基因缺失株的构建及其对布鲁氏菌生长与复制的影响
2018-03-04宋甲宝姜利英宗树成李兆利刘文兴李干武步志高
宋甲宝,许 达,姜利英,宗树成,李兆利,刘文兴,李干武,步志高,胡 森
(中国农科院哈尔滨兽医研究所兽医生物技术国家重点实验室,黑龙江哈尔滨150069)
布鲁氏菌病是由布鲁氏菌引起的重要人兽共患传染病。布鲁氏菌为革兰氏阴性菌,无鞭毛,不形成芽孢,导致动物及人流产和不孕[1]。布鲁氏菌病在大多数发达国家已被消灭,但在以牛羊为主要牲畜的发展中国家和地区仍广泛流行[2]。
OmpR属于EnvZ/OmpR二元调控系统,广泛存在于细菌中,在适应环境方面发挥多种功能[3-5],主要参与渗透压调节和酸胁迫应答[6-7],也参与调节糖类代谢[8-9]和毒力调控[10-11]。EnvZ/OmpR在沙门氏菌中是激活另一个二元调控系统—SsrA/B的重要组分,其可以通过调节毒力因子表达,使沙门氏菌在巨噬细胞吞噬囊泡酸性环境中得以复制和生存[10-11]。Chakraborty等发现鼠伤寒沙门氏菌在巨噬细胞吞噬囊泡中的酸化调节过程,依赖于EnvZ/OmpR信号转导系统[12]。
布鲁氏菌OmpR的功能尚不清楚,为探究其功能与作用机制,本实验以M28为亲本株,构建OmpR基因缺失株与回补株,通过TSB平板培养基菌落生长观察、巨噬细胞感染试验、生长曲线、小鼠体内复制水平测定等试验对布鲁氏菌OmpR基因功能进行初步研究,为其在布鲁氏菌中的作用机制研究奠定了基础。
1 材料与方法
1.1 菌株、细胞系、质粒及实验动物 马耳他布鲁氏 菌M28、巨噬细胞Raw264.7、pSP72和pBBR1MCS-4、卡那霉素表达质粒pIRES2-EGFP为本实验室保存;6周龄~8周龄雌性SPF级BALB/c小鼠购自北京维通利华实验动物技术有限公司。
1.2 主要试剂PhantaTMSuper-Fidelity DNA Polymerase、ClonExpressTMMultiS重组克隆试剂盒和DH5α感受态细胞均购自南京诺唯赞生物科技有限公司;基因组提取试剂盒购自天根生化科技(北京)有限公司;PstⅠ和BglⅡ酶购自NEB公司;胰蛋白大豆液体培养基购自美国BD公司。
1.3 自杀质粒pSP-OmpR-K的构建与鉴定 利用CE Design V1软件设计OmpR基因(CDD∶223816)左右同源臂和卡那霉素表达盒引物(表1)。利用基因组提取试剂盒提取M28基因组,以其为模板,分别以L-f/L-r/R-f/R-r为引物,PCR扩增OmpR左右同源臂,以实验室保存的卡那霉素表达质粒pIRES2-EGFP为模板,以K-f/K-r为引物,PCR扩增卡那霉素基因表达序列。OmpR左右同源臂片段和卡那霉素基因片段经纯化,通过同源重组试剂盒将3个片段克隆至pSP72质粒,转化至DH5α感受态细胞,挑取卡那霉素平板上的单菌落进行PCR鉴定,提取质粒测序鉴定后命名为pSP-OmpR-K。
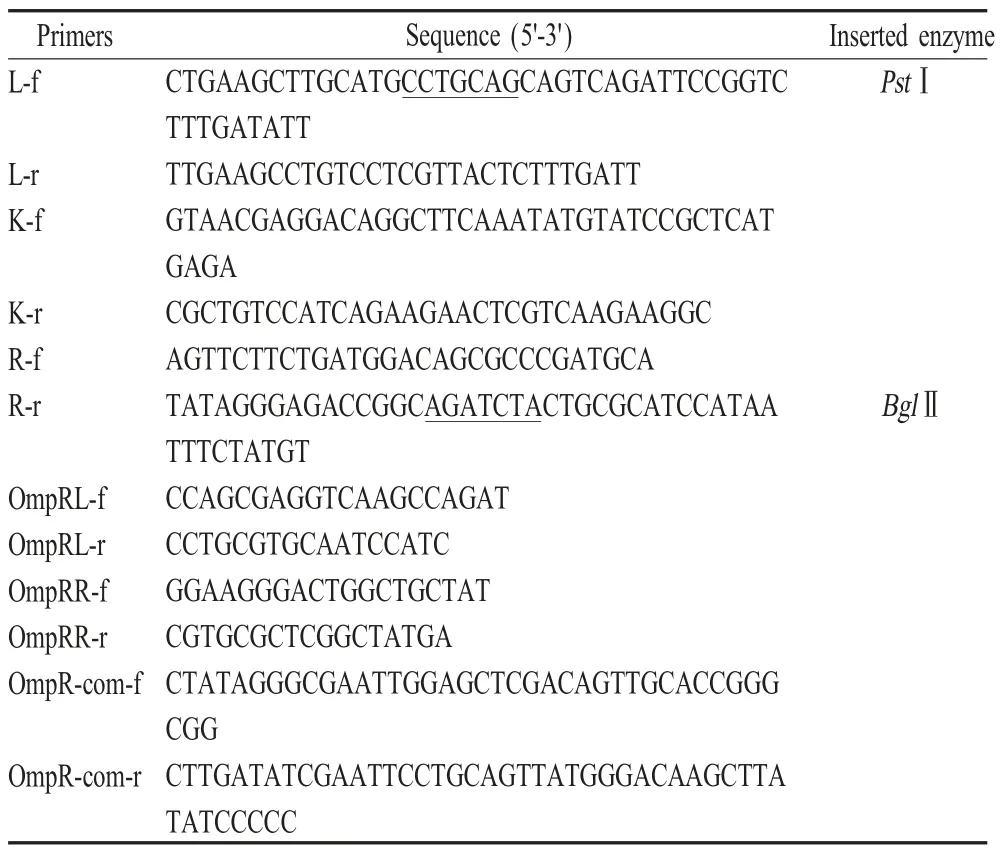
表1 本研究用到的引物Table 1 Primers used in this study
1.4 缺失株M28ΔOmpR和回补株M28ΔOmpRcom的筛选与鉴定 将自杀质粒pSP-OmpR-K电转入布鲁氏菌M28感受态细胞中,用900μL SOC培养基重悬,置37℃振荡培养12 h,将菌液涂布于卡那霉素抗性(50μg/mL)的TSB平板,置37℃,5%CO2培养,96 h后观察菌落生长情况。挑取具有卡那霉素抗性的菌落,分别划线至卡那霉素抗性和氨苄青霉素抗性的(50μg/mL)TSB平板培养基,连续纯化传代8代后,挑取仅抗卡那霉素的菌落。利用引物OmpRL-f/OmpRL-r/OmpRR-f/OmpRR-r对疑似阳性菌落进行PCR鉴定,并将PCR产物测序鉴定,将阳性菌命名为M28ΔOmpR。将扩增的OmpR基因序列(包含OmpR启动子)克隆至pBBR1MCS4原核表达载体,构建重组质粒pBBR1MCS4-OmpR。将pBBR1MCS4-OmpR电转入M28ΔOmpR菌株,构建OmpR基因回补株,经氨苄青霉素抗性筛选纯化,挑取疑似阳性菌株PCR鉴定,并将鉴定为阳性的菌株命名为M28ΔOmpR-com。
1.5 重组菌菌落生长差异比较 将M28、M28ΔOmpR及M28ΔOmpR-com用PBS稀释至每100μL含菌数100个~200个后涂布于TSB平板培养基。分别在72 h、96 h和120 h后,刻度尺测量菌落直径并测定单菌落含菌数,比较M28、M28ΔOmpR和M28ΔOmpR-com体外生长差异。
1.6 重组菌生长曲线测定 取M28和M28ΔOmpR各3μL接种于5 mL TSB液体培养基中,培养至对数生长期,将菌液稀释到OD600nm=0.05,37℃,200 r/min摇床培养。连续培养至64 h(平台期),每隔8 h取一次样,每个样品做3个重复,测定其OD600nm,绘制M28和M28ΔOmpR的体外生长曲线。
1.7 重组菌巨噬细胞感染试验 将巨噬细胞RAW264.7接种于24孔细胞培养板中,培养至密度约为80 %。将M28、M28ΔOmpR及M28ΔOmpRcom按MOI=100感染RAW264.7细胞,置37℃吸附感染,4 h后用不含血清的DMEM洗3次,然后用含5 % FBS和5μg/mL庆大霉素的DMEM继续培养。感染后8 h、24 h和48 h,用2 % Triton X-100于4℃裂解细胞10 min,彻底吹下细胞,稀释涂板。采用胞内菌落计数方法[13]比较M28ΔOmpR、M28及M28ΔOmpR-com在巨噬细胞中的增殖情况,判定OmpR基因缺失对布鲁氏菌在巨噬细胞胞内复制的影响。
1.8 重组菌的小鼠感染试验 将60只6周龄~8周龄雌性BALB/c小鼠,随机分成2组。分别腹腔接种M28和M28ΔOmpR,剂量为1×106cfu/只。分别在接种后第1周、2周、4周、6周和9周颈部脱臼迫杀小鼠,无菌取小鼠脾脏称重,比较脾脏重量然后加800μL PBS,置组织研磨仪研磨。将悬液适当稀释后取100μL涂布于TSB平板培养基,96 h后菌落计数,比较不同组小鼠脾脏的布鲁氏菌数。
2 结果
2.1 pSP-OmpR-K重组自杀载体构建及鉴定 以M28为模板,PCR扩增出OmpR左、右同源臂,以pIRES2-EGFP为模板,PCR扩增出卡那霉素表达盒,结果显示PCR扩增的3个基因片段大小分别约为:1 000 bp、1 000 bp和1 300 bp,均与预期一致(图1A)。且测序结果显示,3个基因片段均与各目的目的条带100 %一致,表明扩增了OmpR左、右同源臂和卡那霉素表达盒。将OmpR左、右同源臂和卡那霉素表达盒融合后克隆至pSP72载体中构建重组质粒pSP-OmpR-K。以pSP-OmpR-K为模板,利用L-f/R-r引物,PCR扩增OmpR左右同源臂和卡那霉素基因序列。结果显示扩增得到约3 300 bp的目的条带,与预期相符(图1B)。表明构建了pSP-OmpRK重组自杀载体。
2.2 缺失株M28ΔOmpR和回补株M28ΔOmpRcom的筛选鉴定 将pSP-OmpR-K自杀载体电转化至M28中,经抗性筛选得到M28ΔOmpR,通过PCR鉴定,结果显示得到两条大小分别约为1 700 bp(从左同源臂上游214 bp至卡那霉素表达盒)和1 700 bp(从卡那霉素表达盒至右同源臂下游161 bp)的目的条带(图1C),测序结果正确,表明构建了OmpR基因缺失株M28ΔOmpR。将pBBR1MCS4-OmpR电转入M28ΔOmpR,经氨苄青霉素筛选获得回补株M28ΔOmpR-com,PCR鉴定得到大小约为1 200 bp条带,与预期相符(图1D),表明构建了回补株M28ΔOmpR。
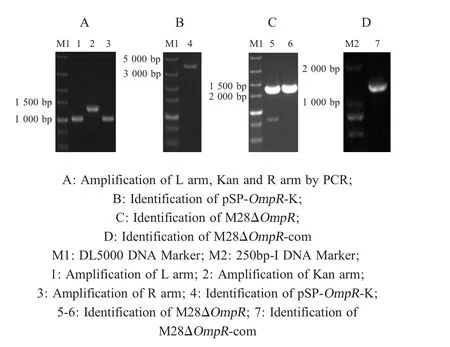
图1 pSP-OmpR-K自杀载体、缺失株M28ΔOmpR和回补株M28ΔOmpR-com鉴定Fig.1 Identification of plasmid pSP-OmpR-K,B.melitensis M28ΔOmpR and M28ΔOmpR-com
2.3 布鲁氏菌菌落生长差异比较 将M28ΔOmpR株、M28株及M28ΔOmpR-com株稀释后涂布于TSB平板培养基,于不同时间点测量菌落直径并对单菌落进行含菌数测定。72 h时,M28与M28ΔOmpR-com菌落呈针尖大小,菌落平均直径为0.89 mm和0.90 mm,M28ΔOmpR株未见菌落生长。96 h时,M28ΔOmpR株、M28株和M28ΔOmpR-com株直径分别为0.95 mm、1.62 mm和1.56 mm,M28ΔOmpR与后两者相比菌落生长速度极显著降低(p<0.001);此时M28ΔOmpR单菌落含菌数极显著低于M28和M28ΔOmpR-com(p<0.001),3者分别为7.4 Log10、8.75 Log10和8.73 Log10。120 h时,M28ΔOmpR、M28和M28ΔOmpR-com菌落直径分别为1.71 mm、2.48 mm和2.24 mm,M28ΔOmpR与后两者相比菌落生长速度极显著降低(p<0.001);此时M28ΔOmpR单菌落含菌数显著低于M28株和M28ΔOmpR-com株(p<0.001),三者分别为8.08 Log10、9.17 Log10和9.19 Log10(图2)。以上结果表明OmpR基因缺失后显著抑制M28菌落形成速度和单个菌落的含菌数,即降低了M28的菌落生长速度。

图2 OmpR基因缺失株菌落生长试验Fig.2 Colony growth of the OmpR gene deleted B.melitensis strain
2.4 细菌生长曲线测定 每隔8 h吸取1 mL各菌液测定OD600nm,将不同时间点的测定值绘制生长曲线。结果显示,M28株和M28ΔOmpR株生长曲线趋于一致,均在64 h达到平台期,在该时期M28株OD600nm值 为2.45,M28ΔOmpR株OD600nm值 为2.59,两者不同时间OD600nm值均无显著差异(p>0.05)(图3)。表明,OmpR缺失后不会影响布鲁氏菌在液体培养基中的生长。
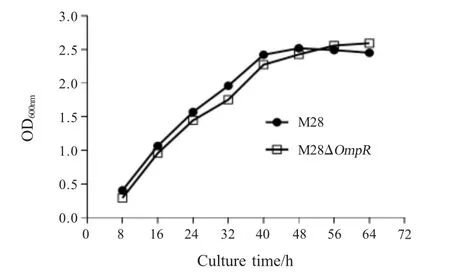
图3 M28和缺失株M28ΔOmpR的生长曲线Fig.3 The growth curve of B.melitensis M28 strain and M28ΔOmpR strain
2.5 巨噬细胞感染试验 将M28ΔOmpR株、M28株和M28ΔOmpR-com株按MOI=100感染RAW264.7巨噬细胞,于不同时间点分离胞内菌并计数。结果显示,感染8 h、24 h和48 h后M28ΔOmpR株胞内菌分离数均极显著低于M28株及M28ΔOmpR-com株(p<0.001)。感染8 h时,M28ΔOmpR株胞内菌分离数为5.07 Log10,极显著低于M28株(6.83 Log10)(p<0.001)和M28ΔOmpR-com株(6.88 Log10)的胞内菌分离数(p<0.001)。M28ΔOmpR株在胞内复制缓慢。感染24 h时,M28ΔOmpR株、M28株和M28ΔOmpR-com株胞内菌分离数分别为5.13 Log10、6.92 Log10和7.09 Log10。感染48 h时,3者分别为5.73 Log10、8.0 Log10和8.35 Log10(图4)。结果表明,OmpR基因缺失显著降低马耳他布鲁氏菌在巨噬细胞内的复制能力。

图4 M28株、缺失株M28ΔOmpR及互补株M28ΔOmpR-com在RAW264.7巨噬细胞中的复制Fig.4 Replication of B.melitensis M28,M28ΔOmpR strain and complementary strain M28ΔOmpR-com in RAW264.7
2.6 小鼠体内感染试验 将M28株和M28ΔOmpR株按1×106cfu/只剂量腹腔接种小鼠,比较不同时间点小鼠脾重及细菌分离情况,评估缺失株在体内的复制能力。结果显示,感染第1周,M28ΔOmpR组小鼠脾重(0.3 g)极显著低于M28组(0.59 g)(p<0.001)。第4周时,M28ΔOmpR组小鼠脾重(0.31 g)极显著低于M28组(0.61 g)(p<0.001)(图5A)。随后各组小鼠脾重均开始下降,差异也逐渐缩小。小鼠脾脏布鲁氏菌分离数结果显示,M28ΔOmpR和M28在感染1周后该分离数达到峰值,随后降低,感染4周时二者差异最大,M28ΔOmpR组小鼠脾脏细菌分离数为5.3 Log10,M28组为6.1 Log10(p<0.01)(图5B)。结果表明OmpR基因缺失显著降低M28株对小鼠致病性及其在体内的复制能力。
图5 M28株和缺失株M28ΔOmpR小鼠体内试验中小鼠脾脏重量(A)和脾脏荷菌量(B)差异比较Fig.5 The spleen weight profiles(A)and bacterial counts in the spleen(B)for M28 and deletion strain M28ΔOmpR infected BALB/c mice
3 讨论
OmpR调控蛋白属于EnvZ/OmpR二元调控系统,主要参与细菌渗透压调节[6]和酸性调节[5],也是OmpR经典调控方式,同时还参与调控沙门氏菌的胞内复制[12],在细菌适应环境中发挥重要作用。Suzanne等研究显示,OmpR-EnvZ和SsrA-SsrB二元调控系统共调节沙门氏菌SPI-2 type III分泌系统,参与其毒力调节。近来研究显示,OmpR还参与调控鼠疫耶氏菌对小鼠的毒力,OmpR基因突变后鼠疫耶氏菌对小鼠毒力显著降低[14]。目前关于布鲁氏菌OmpR功能机制尚不清楚,本研究针对OmpR基因在布鲁氏菌中参与的功能进行了初步探究。
基因敲除是研究基因功能的常用手段,同源重组法具有专一性强、整合位点精确,可以将外源基因导入基因组DNA的特定区域并使其稳定遗传等优点[15]。本研究将M28的OmpR基因通过同源重组法敲除,构建了OmpR缺失株,并构建了回补株,通过比较三者的生长差异,初步阐明了OmpR在布鲁氏菌生长与复制中的作用。
单菌落含菌数结果显示,M28ΔOmpR菌落生长速度低于M28,但回补株M28ΔOmpR-com菌落生长速度得到恢复。表明OmpR基因影响马耳他布鲁氏菌在TSB平板培养基上的菌落生长速度。但M28ΔOmpR株和M28株的体外生长曲线并无明显差异,这与固体培养基上的菌落生长观察结果不一致,推测可能由于生长环境不同,OmpR基因对布鲁氏菌生长影响不同,具体产生差异的机理还需进一步分析验证。
巨噬细胞感染结果表明M28ΔOmpR株、M28株及M28ΔOmpR-com株胞内菌分离数差异极显著,三组感染后48 h胞内布鲁氏菌均达到峰值,M28ΔOmpR胞内菌分离数比M28株低2 Log10以上。许多胞内病原体可以在巨噬细胞生物膜形成的酸性吞噬囊泡中存活,Chakraborty等发现,鼠伤寒沙门氏菌进入细胞后的细胞质酸化,依赖于OmpR即EnvZ/OmpR信号转导系统,使得沙门氏菌更易侵入巨噬细胞并能够在吞噬囊泡中复制[12]。同样,布鲁氏菌感染巨噬细胞后,可以与巨噬细胞膜结构形成包含布鲁氏菌的囊泡(Brucella-containing vacuole,BCV),BCV和晚期内体/溶酶体空泡作用,并控制内体/溶酶体空泡内部酸化环境,抑制巨噬细胞蛋白水解酶和组织蛋白酶D对布鲁氏菌的降解[16]。马耳他布鲁氏菌是否也依赖于EnvZ/OmpR信号转导系统参与pH调节,影响其侵入巨噬细胞并复制增殖,具体机制有待继续探究。
小鼠感染试验结果显示,缺失OmpR基因后,M28ΔOmpR株感染的小鼠脾脏重量显著低于M28株感染的小鼠脾脏重量,且该组小鼠脾脏布鲁氏菌分离数低于M28株,相差0.8 Log10。这表明在一定程度上,OmpR基因缺失对马耳他布鲁氏菌毒力影响显著。
综上所述,本研究显示OmpR基因缺失抑制了布鲁氏菌菌落生长速度,显著降低了其在巨噬细胞和小鼠体内的复制能力,表明OmpR基因在马耳他布鲁氏菌中起着至关重要作用,为探究OmpR在布鲁氏菌中的功能奠定了基础。
