酿酒酵母甘露聚糖对绵羊瘤胃上皮细胞β-防御素-1(SBD-1)表达的影响
2018-03-04王云鹤温婧怡杨银凤
金 鑫,张 曼,王云鹤,魏 方,温婧怡,杨银凤*
(1.内蒙古农业大学 兽医学院,内蒙古 呼和浩特010018;2.农业部动物疾病临床诊疗技术重点实验室,内蒙古 呼和浩特010018)
随着抗生素在人类和动物中的广泛使用,细菌耐药性已经严重危害人类身体健康和生态系统安全。因此,研制可取代抗生素且无药物残留的抗菌肽成为当今医药学界研究的一个热点。
目前,对人和动物体内研究较多的抗菌肽分子是防御素,防御素作为内源性抗菌肽家族中最大的亚家族,具有抗细菌、抗病毒、抗真菌、抗肿瘤等多种生物学活性,然而防御素在机体内表达甚微,天然获取的量非常有限,且提取工艺复杂,成本高昂,因此对内源性抗菌肽防御素的研究尚难以进入规模化生产的进程。但防御素具有可诱导表达的特点,寻求安全、有效的诱导剂,特异性诱导其在某些器官的关键部位高效表达,从而在机体局部起到杀灭病原微生物的作用,为解决上述问题提供了一个好办法。
酵母菌作为反刍动物饲用抗生素的重要替代物,其在反刍动物体内除起到促生长的作用外,还起到一定的免疫作用[1]。如今酿酒酵母菌作为重要的绿色无污染益生菌制剂已被广泛应用于畜牧业生产中,研究表明益生菌主要通过其细胞壁成份影响宿主免疫系统[2],酿酒酵母菌细胞壁主要由葡聚糖和甘露聚糖两类多糖组成。葡聚糖具有免疫调节活性,能够有效增强哺乳动物的先天性免疫反应[3-5];同时也能够上调其体内的抗菌肽β-防御素和cathelicidin的表达[6-8]。而甘露聚糖作为免疫功能最强的酵母细胞壁多糖[9],能够增加动物体液免疫和细胞免疫能力,并对改善宿主肠道内环境,调节肠道微生态平衡和诱导宿主肠道免疫反应有着十分重要的作用[10]。但关于甘露聚糖与反刍动物抗菌肽表达的关系研究尚未见相关报道,仅见白色念珠菌细胞壁提取物甘露聚糖可以促使人角质形成细胞内β-防御素-2 mRNA的转录水平增强[11]。
因此,本研究在确定酿酒酵母菌能够诱导体外培养的绵羊瘤胃上皮细胞(Ruminal Epithelial Cells,RECs)β-防御素-1(Sheep Beta-Defensin-1,SBD-1)表达量增多的基础上[12],进一步采用荧光定量PCR(qPCR)和ELISA试验研究其细胞壁成分甘露聚糖对SBD-1表达的调控规律,从益生性酿酒酵母菌的细胞壁成分甘露聚糖诱导绵羊RECs SBD表达的新角度解析甘露聚糖在体内如何发挥益生作用,为更好的开发利用甘露聚糖制剂提供实践指导。
1 材料与方法
1.1 细胞与主要试剂RECs由本实验室进行原代培养,经纯化和鉴定后冻存保留;提取自酿酒酵母菌的甘露聚糖(M7504-100MG)购自Sigma公司;总RNA提取试剂盒购自Axygen Scientific公司;反转录试剂盒(RR047A)和qPCR酶(RR820A)购自TaKaRa公司;绵羊防御素β1(DEFβ1)ELISA试剂盒(ELA06599Sh)购自武汉新启迪生物公司。
1.2 引 物 根据GenBank中的β-Actin内参基因(U39357)和SBD-1基因序列(U75250),利用DNAStar软件设计引物(β-actin F:GTCACCAACTGGGAC GACA/R:AGGCGTACAGGGACAGCA;SBD-1 F:GCTCTTCTTCGTGGTCCTGT/R:ACAGGTGCCAAT CTGTCTCA),预期扩增片段大小分别为208 bp和133 bp。引物由上海生工生物工程技术服务有限公司合成。
1.3 RECs的培养 将冻存的RECs在37℃水浴锅中迅速复苏并进行培养,然后调整细胞浓度分别传于6孔和96孔细胞培养板,待细胞长满培养孔底壁的90 %以上时,用无血清、无抗生素的基础培养基对细胞进行24 h的饥饿处理(为了使细胞在给予刺激前不进行分裂增殖,处于同一细胞周期)。饥饿处理后用无双抗的PBS洗涤3次,然后加入基础培养基用于后续的细胞刺激和活性鉴定试验。
1.4 不同浓度甘露聚糖对RECs的刺激 将各培养板的RECs分为对照组和刺激组,对照组不用甘露聚糖刺激,而刺激组为不同浓度(10μg/mL、50μg/mL、100μg/mL、200μg/mL、400μg/mL)甘露聚糖对RECs的刺激,各组细胞刺激8 h后:6孔板内的细胞采用Axygen的总RNA提取试剂盒,按其说明书进行操作得到总RNA,并用多功能酶标仪测定RNA的纯度和浓度。同时将提取的总RNA参照反转录试剂盒(RR047A)说明书进行反转录反应,以β-actin基因为内参,采用已设计引物,利用qPCR检测SBD-1的mRNA转录水平。反应体系为20μL:SYBR Premin ExTaq(2×)10μL,上游引物(10μmol/L)0.8μL,下游引物(10μmol/L)0.8μL,cDNA模板2μL,dH2O 6.4μL。反应程序为:扩增程序:95℃30 s;95℃5 s、60℃34 s,45个循环;溶解程序:95℃5 s;60℃30 s;95℃15 s,每个样品的SBD-1基因和β-actin基因分别做3个重复。反应结束后,用2-ΔΔCt法[15]计算SBD-1 mRNA的转录水平。同时将收集的细胞培养上清采用DEFβ1 ELISA试剂盒进行SBD-1蛋白检测,按其说明书操作后用多功能酶标仪测标准品和各样品OD450nm值,利用EXCEL软件分别以标准品OD450nm值和标准品浓度作为横纵坐标绘制标准曲线,并得到二次多项式方程,根据该方程和各样品的OD450nm值计算SBD-1蛋白表达量。
对96孔板内的RECs采用常规MTT法检测不同浓度甘露聚糖刺激RECs 8 h后对RECs活力的影响。
1.5 甘露聚糖对RECs不同时间的刺激 同样将各培养板的细胞分为对照组和刺激组,对照组不用甘露聚糖刺激,而刺激组为诱导SBD-1表达最高浓度的甘露聚糖(即试验1.4结果)对RECs不同时间(2 h、4 h、8 h、12 h、24 h)的刺激,按照1.4的方法分别进行qPCR和ELISA试验,以检测不同刺激时间RECs中SBD-1的mRNA转录水平和蛋白表达量;而96孔板内的细胞同样采用常规MTT法检测甘露聚糖刺激RECs不同时间后对RECs活力的影响。
1.6 统计分析 试验在同一批次细胞内重复至少3次,数据采用SPSS 20.0软件进行单因素方差分析(one-way ANOVA)和邓肯氏法(Duncan)多重比较,结果用平均值±标准差表示。p<0.01和p<0.05分别为差异极显著和差异显著,采用GraphPad Prism软件绘图。
2 结果
2.1 RECs培养结果 传代的RECs生长迅速,4 d后细胞即有90 %以上聚集生长,呈漩涡状的致密单层细胞集落,且细胞界限较为清晰,胞浆呈颗粒状,核圆而大(图略),可以进行后续试验。
2.2 ELISA标准曲线的建立 根据测出的标准品OD450nm值建立ELISA标准曲线(图1),其二次多项式拟合方程为y=ax2+bx+c(其中a=77.928,b=104.24,c=3.4885),相关系数R2=0.9974,表明样品SBD-1蛋白表达量可以利用此标准曲线计算。

图1 ELISA试验的标准曲线Fig.1 Standard curve of ELISA test
2.3 不同浓度甘露聚糖对RECs SBD-1表达的影响 利用qPCR和ELISA对不同浓度甘露聚糖刺激RECs 8 h后其SBD-1的mRNA转录水平和蛋白表达变化进行检测。qPCR结果显示:用不同浓度的甘露聚糖刺激RECs 8 h后,其均能诱导SBD-1 mRNA的转录水平增加,且与对照组相比均呈极显著性差异(p<0.01)。随着甘露聚糖浓度的增加,SBD-1 mRNA的转录水平呈现出先升高后降低的趋势,当甘露聚糖的刺激浓度为50μg/mL时SBD-1 mRNA转录水平达到最大,之后有所下降,但SBD-1 mRNA的转录水平在甘露聚糖刺激浓度为50μg/mL、100 μg/mL、200μg/mL、400μg/mL时互相呈不显著性差异(p>0.05)(图2A);ELISA结果显示:SBD-1蛋白的表达趋势与其mRNA转录水平趋势基本一致,不同浓度的甘露聚糖刺激RECs后SBD-1的蛋白表达量极显著高于对照组(p<0.01),当甘露聚糖的刺激浓度为50μg/mL时SBD-1蛋白表达量达到最大(图2B)。同时MTT结果显示:不同浓度的甘露聚糖刺激RECs 8 h后与未刺激组相比差异均不显著(p>0.05),表明刺激后的RECs均能够存活,其活力不受甘露聚糖刺激的影响(图2C)。因此,不同浓度的甘露聚糖均可以诱导SBD-1的表达,但刺激浓度为50μg/mL时SBD-1的表达量达到最大。
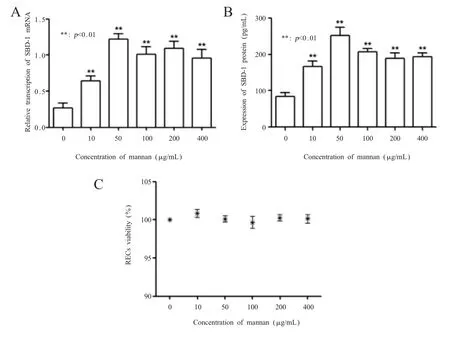
图2 不同浓度甘露聚糖对RECs SBD-1表达的影响Fig.2 Effect of different concentrations of mannan on RECs SBD-1 expression
2.4 甘露聚糖刺激RECs不同时间后对SBD-1表达的影响 选用诱导SBD-1表达最高浓度的甘露聚糖(50μg/mL)刺激RECs不同时间后,利用qPCR和ELISA对SBD-1的表达变化进行检测。qPCR结果显示:甘露聚糖对RECs不同时间的刺激均可以诱导SBD-1 mRNA转录水平的增加,且与对照组相比均呈极显著性差异(p<0.01)。随着刺激时间的延长,甘露聚糖诱导SBD-1 mRNA的转录水平呈先升高后降低趋势,刺激时间为4 h时SBD-1 mRNA转录水平达到峰值,且极显著高于对照组(p<0.01),并与其它时间刺激组(2 h、8 h、12 h、24 h)相比呈显著性 差 异(p<0.05)(图3A);ELISA结果同样显示:SBD-1的蛋白表达量与对照组相比呈极显著性差异(p<0.01),且刺激时间为4 h时SBD-1蛋白表达量达到最大(图3B)。同时MTT结果显示:50μg/mL的甘露聚糖刺激RECs不同时间后与未刺激组相比差异不显著(p>0.05),表明RECs的活力不受甘露聚糖刺激的影响(图3C)。因此,浓度为50μg/mL的甘露聚糖刺激RECs 4 h时,SBD-1的表达量达到最高。

图3 甘露聚糖刺激RECs不同时间后对SBD-1表达的影响Fig.3 Effects of mannan stimulates different times on RECs SBD-1 expression
3 讨论
防御素是机体自身内源性抗菌肽,具有重要的抗感染功能。利用抗菌肽防御素作为药物防治胃肠道疾病已成为学者们关注的一个新方向。而来源于白色念珠菌细胞壁成分的甘露聚糖已被证明可以诱导人体内防御素的表达[11],但酵母菌作为畜牧业生产中常用的饲料添加剂,有关其细胞壁成分甘露聚糖对防御素表达影响的研究较少,因此本研究构建以益生性酿酒酵母菌细胞壁成分甘露聚糖诱导绵羊RECs SBD-1表达的模型,探究酿酒酵母菌细胞壁成分甘露聚糖调节防御素表达的规律。
随着益生菌和防御素表达关系的不断深入研究,发现益生菌发挥益生作用多数是靠其具有良好免疫原性的细胞壁成分发挥重要的抗感染作用。机体通过识别病原相关分子模式(PAMPs),快速释放抗菌物质和协同刺激分子,构成抵御病原微生物入侵的第一道防线,同时启动获得性免疫反应发挥防御作用[13]。甘露聚糖作为PAMPs的重要一员,且作为益生性酿酒酵母菌细胞壁的主要成分,能够诱导绵羊RECs SBD-1的表达量增加,表明甘露聚糖在动物体内增加先天性免疫的能力可能部分是通过提高机体内防御素的表达水平而实现。生理状态下,SBD-1在绵羊的胃肠道中均有不同程度的表达,但以瘤胃组织表达水平较高[14-15]。本实验中,用甘露聚糖刺激绵羊RECs后SBD-1表达量升高,且与甘露聚糖浓度和刺激时间存在相关性,表明适当浓度的甘露聚糖和刺激时间可以特异性诱导防御素在某些器官的高效表达。
本实验从mRNA转录水平和蛋白表达水平对酿酒酵母菌细胞壁主要成分甘露聚糖诱导SBD-1表达的最佳浓度和刺激时间进行了探究。不同浓度的甘露聚糖对RECs SBD-1 mRNA转录水平和蛋白表达量影响均呈现先升高后降低的趋势。MTT的结果表明不同浓度的甘露聚糖对RECs的活性并没有影响,这些结果表明SBD-1表达量的下降并不是由于甘露聚糖浓度的增大而导致的细胞死亡引起的,而可能是由于RECs中能够识别甘露聚糖的膜受体有限,因此SBD-1的表达量并不是随着甘露聚糖的浓度增大而增多;随后选用诱导效果最好的甘露聚糖(浓度为50μg/mL)分别刺激RECs不同时间后,SBD-1 mRNA转录水平和蛋白的表达量在甘露聚糖刺激RECs 4 h时达到最大,之后呈下降趋势。而MTT细胞活性试验结果同样显示甘露聚糖刺激RECs不同时间后对细胞活性并无影响,推测甘露聚糖诱导SBD-1表达可能也是机体自身的一种调节过程:即当SBD-1的表达量被甘露聚糖诱导达到峰值时,机体也会随着刺激时间的延长逐渐将SBD-1的表达量调节到自身水平,从而维持SBD-1的动态平衡,但其具体的调节过程以及甘露聚糖能否在绵羊体内诱导SBD-1的表达有待进一步研究。
