三红蜜柚体细胞胚胎的诱导
2018-03-03林亮亮
林亮亮
(福建农业职业技术学院,福建 福清 350119)
琯溪三红蜜柚系芸香科柑橘属柚类优良品种之一,是福建省平和县地方传统名果琯溪蜜柚的芽变株中最新选育的优良品种,2012年获得福建省品种审定委员会认证推广。三红蜜柚果肉红艳,晶莹透亮,果皮海绵层呈粉色,外果皮黄里透红,深受消费者喜爱,其柚果果型倒卵圆形,汁胞红色,富含番茄红素和β-胡萝卜素,果汁丰实,甜酸适口,品质极佳,比普通品种琯溪蜜柚、红肉蜜柚早熟10~15 d,且皮薄少籽,柚果可食率高达70%,有良好的发展前景与市场竞争力[1]。目前,三红蜜柚主要采用嫁接和实生苗等繁殖方法,生产季节性强,对操作技术要求较高,限制了优良新品种的迅速推广。
近年来,关于果树体细胞胚胎再生体系的研究越来越多,并已在苹果、核桃、枇杷、葡萄、荔枝等树种上成功获得体细胞胚胎[2]。植物体细胞胚胎的发生、发育与合子胚相似,是离体培养形态发生的有效途径之一[3]。胚状体的培养材料可采用植物的各种器官、组织做为外植体进行培养,甚至在悬浮细胞培养和原生质体培养中都有可能形成体细胞胚胎,在取材方面比较方便多样;同时,胚状体的培养能将植物的无性繁殖从田间移至室内,缩短植物繁殖时间,使育苗工厂化,从而避免传统繁殖方式受生产季节及技术等瓶颈的影响。因此,运用细胞工程中的体细胞胚胎培养技术进行植物组培快繁,可在较短时间内获得基因型统一、表现型优良的一致性群体,能够周年生产不受季节与地理位置的限制,在快速繁殖苗木、制作人工种子及基因工程研究等方面具有较大应用潜力。
本研究采用三红蜜柚无菌苗中的茎段为外植体诱导胚性愈伤组织形成,进一步分化形成体细胞胚胎,探讨不同培养基与植物生长调节剂对诱导三红蜜柚胚性愈伤组织以及体细胞胚胎形成等关键环节的影响,逐步建立起三红蜜柚体细胞胚胎发生途径的组培快繁技术体系。
1 材料与方法
1.1 材料
试验材料来自福清市惠煌农业开发有限公司三红蜜柚绿色生产基地,并由福建农业职业技术学院组培中心利用三红蜜柚种胚培育出的无菌苗,经增殖形成的丛生苗中选取。
1.2 方法
1.2.1 外植体处理
试验采用株高4~5 cm,带4~6片真叶的三红蜜柚无菌苗为材料,因为材料本身无菌,无需再进行消毒处理,直接在超净工作台上将其茎段截成长0.5~1 cm的小段,每段带1~2个茎节,作为诱导体细胞胚发生的外植体。
1.2.2 培养条件
试验采用MS、B5和改良WPM为基本培养基,根据不同培养阶段添加不同浓度与配比的植物生长调节剂(2,4-D、6-BA和NAA),所有培养基添加琼脂7 g·L-1,调节pH值5.6,在121 ℃条件下灭菌20 min,冷却凝固后使用,培养温度为(25±2)℃,胚性愈伤组织诱导的光照强度为500~1 000 lx,胚状体萌发的光照强度为1 000~1 500 lx,壮苗与生根培养的光照强度为1 500~2 000 lx,光照时间12 h·d-1。
1.2.3 胚性愈伤组织的诱导
试验采用正交设计L9(34),研究基本培养基(MS、B5、改良WPM)与植物生长调节剂2,4-D(0.5、1、1.5 mg·L-1)、6-BA(0.1、0.5、1.0 mg·L-1) 对三红蜜柚胚性愈伤组织诱导率的影响。将茎段接种到不同培养基上,每处理接种30瓶,每瓶接1个茎段,重复3次。
1.2.4 胚状体的诱导
试验采用正交设计L9(34),研究基本培养基(MS、B5、改良WPM)与植物生长调节剂6-BA (0.1、0.5、1.0 mg·L-1)、NAA(0、0.1、0.5 mg·L-1)对三红蜜柚胚状体发生率的影响。从诱导培养的三红蜜柚胚性愈伤组织中选取出淡黄色、颗粒状较明显的愈伤组织块,接种到不同的体细胞胚诱导培养基上,每处理接种10瓶,每瓶接3块,重复3次。
1.2.5 芽增殖
当三红蜜柚胚状体上萌发出的小苗长度达到2~3 cm时,将其从基部切下,接种于MS+NAA 0.5 mg·L-1+6-BA 1.0 mg·L-1培养基中进行茎芽增殖,培养30 d左右,选取生长健壮的小苗进行生根培养。
1.2.6 生根及移栽
选取生长健壮的无根小苗移到1/2 MS+NAA 0.5 mg·L-1培养基上诱导生根,将生长健壮、具有7片以上真叶的生根苗逐步过渡到自然环境条件下进行栽培。
1.3 数据统计分析
胚性愈伤组织诱导率=产生愈伤组织的外植体数/外植体总数;
胚状体诱导率=产生胚状体的外植体数/外植体总数[4]。
正交试验结果采用DPS软件的正交试验方差分析,方差分析的差异显著性用最小显著差数法(LSD)进行平均数的多重比较[5]。
2 结果与分析
2.1 三红蜜柚体细胞胚胎诱导、分化与植株再生
试验从已建立的三红蜜柚组培快繁体系中获得的无菌苗茎段为外植体,竖直接种在诱导胚性愈伤组织的培养基上,30 d后茎段上端的切口处以及与培养基接触的茎段基部逐步出现淡黄色、颗粒感较强的愈伤组织团块,将其转移到体细胞胚胎诱导培养基上,25 d后这种淡黄色的愈伤组织能进一步形成胚状体并萌发产生不定芽,通过继代培养生成三红蜜柚小苗。
2.2 不同基本培养基与植物生长调节剂配比对胚性愈伤组织诱导的影响
三红蜜柚无菌苗中获得茎段作为外植体,经过胚性愈伤组织培养基的诱导,茎段细胞分裂形成胚性愈伤组织,并不断增殖,30 d后统计胚性愈伤组织诱导率。由表1可知,通过对各处理因子不同水平的SSR检验,基本培养基对三红蜜柚胚性愈伤组织诱导率的影响达到极显著水平,MS、B5、改良WPM培养基的诱导率均值分别为48.2%、19.3%、4.8%,诱导效果以MS培养基为最好;植物生长调节剂2,4-D、6-BA不同水平对胚性愈伤组织诱导的影响较大,2,4-D浓度1.0和1.5 mg·L-1的诱导率均值分别为31.9%和11.9%,期间极差达20.0百分点;6-BA浓度0.5和1.0 mg·L-1的诱导率均值分别为29.6%和15.2%,其间极差达14.4百分点,均达到极显著水平。因此,三红蜜柚茎段胚性愈伤组织诱导的最佳培养基组合为MS+2,4-D 1 mg·L-1+6-BA 0.5 mg·L-1。
2.2 不同基本培养基与植物生长调节剂配比对胚状体发生的影响
将诱导出的三红蜜柚胚性愈伤组织细胞团接种到体细胞胚胎诱导培养基上,以检测愈伤组织的体胚发生能力[6]。
不同基本培养基与植物生长调节剂(6-BA、NAA)配比对胚状体分化的影响见表2。通过对各处理因子不同水平的SSR检验,基本培养基对胚状体分化率的影响达到极显著水平,以MS为最好,分化率均值达43.3%。在胚状体分化期间,不同培养基添加不同植物生长调节剂配比表现不同,NAA不同水平对胚状体发生均表现有抑制作用,并随着NAA浓度增强,达到极显著水平;6-BA对胚状体的发生产生一定影响,6-BA为0.1,1.0 mg·L-1的发生率均值分别为37.0%和14.5%,其间极差达22.4百分点,达到极显著水平。试验结果还表明,添加0.1~0.5 mg·L-1的6-BA对胚状体发生有促进作用。因此,诱导胚状体发生的最佳培养基为MS+6-BA 0.1 mg·L-1。
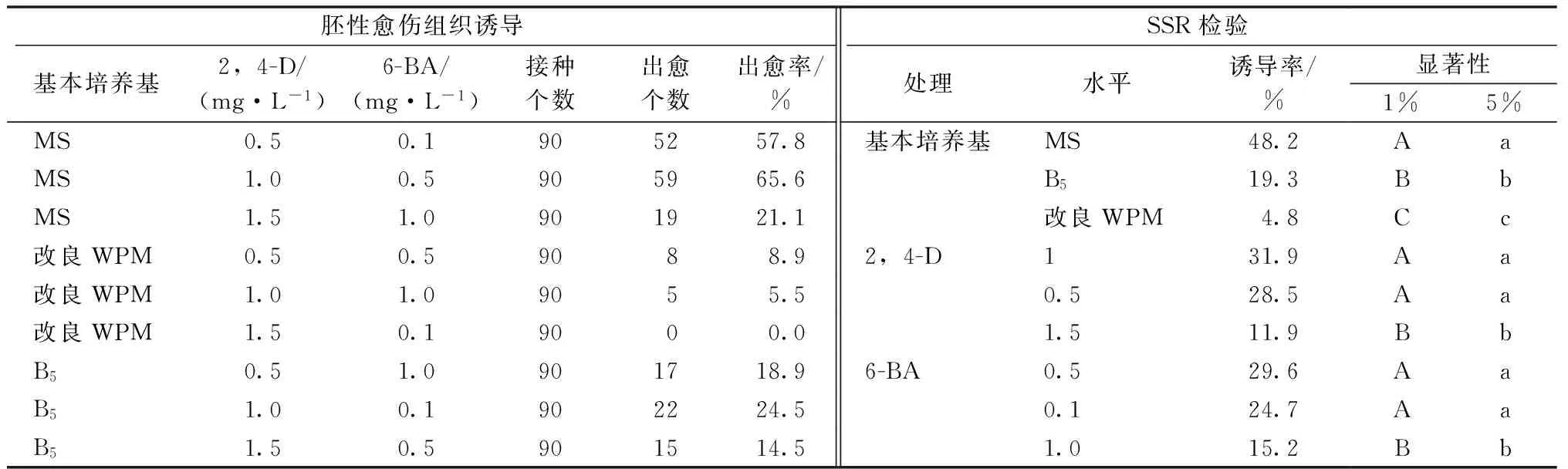
表1 不同基本培养基、不同植物生长调节剂配比对胚性愈伤组织的诱导效果
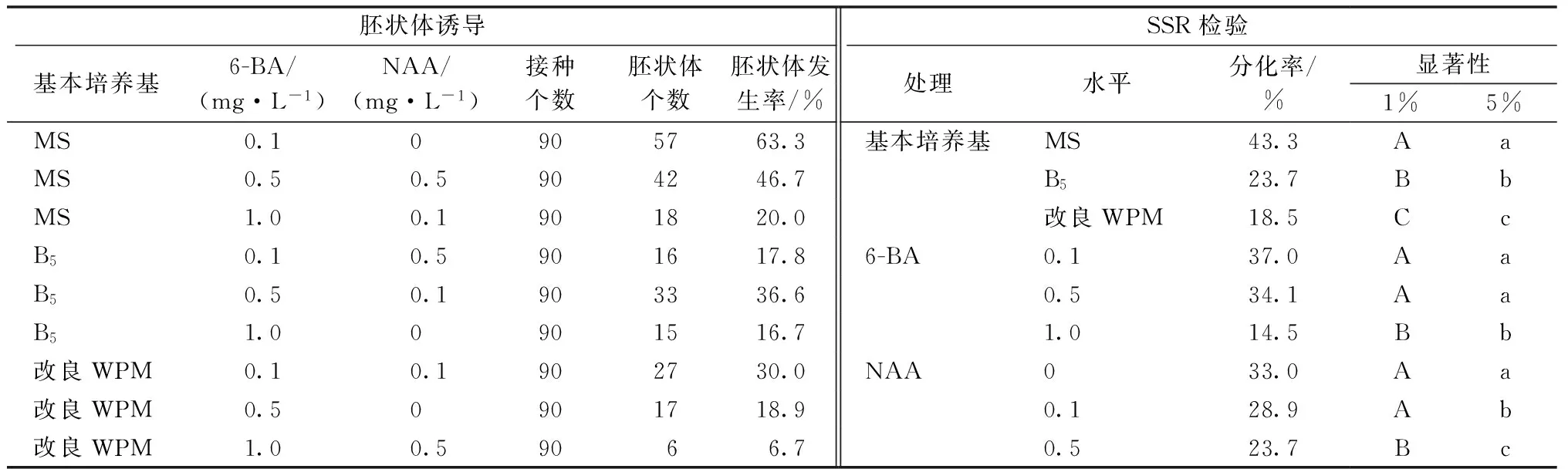
表2 不同基本培养基、不同植物生长调节剂配比对胚状体的诱导效果及SSR检验
3 小结与讨论
试验针对三红蜜柚体细胞胚胎诱导中的突出问题,以筛选适宜诱导三红蜜柚胚性愈伤组织与胚状体的培养基为目的,把优化激素种类配比和浓度做为研究重点。试验采用前期培养的三红蜜柚无菌苗茎段为外植体,运用正交试验设计的研究手段,充分发挥其筛选最佳试验处理组合的捷径功能,达到优化培养基配方的目的。
已有研究表明,不同果树种类对基本培养基的选择也有物种特异性,必须对不同培养基的诱导效果进行对比,筛选出适合诱导三红蜜柚的体细胞胚胎生长的培养基,并进一步获得最佳诱导培养基组成。选用3种具有一定代表性的MS、B5和改良WPM培养基进行诱导表明,MS的诱导效果最佳,B5次之,改良WPM最差,对这3种培养基的成分进行分析,三红蜜柚胚性愈伤组织与胚状体的诱导及生长状况与培养基中铵态氮及充足的铁离子供给有关。
甜橙驯化愈伤组织生长素对胚胎发生了重要作用[7]。Rao等[8]研究结果也表明2,4-D对体细胞胚胎的发生起促进作用。本试验结果表明,添加2,4-D 1.0 mg·L-1及6-BA 0.5 mg·L-1的MS培养基诱导胚性愈伤组织的效率最高,该类愈伤组织呈淡黄色,结构紧实颗粒感强,而2,4-D浓度过高则会起到抑制作用,且易造成培养物褐变。在三红蜜柚胚状体诱导过程中,随着NAA浓度升高胚状体的发生率逐步降低,采用不添加NAA而单独添加6-BA 0.1 mg·L-1的MS培养基诱导胚状体发生率最高。
试验运用细胞工程中体细胞胚胎培养技术进行三红蜜柚体细胞胚胎诱导,建立三红蜜柚优良单株的体细胞胚胎再生体系,为三红蜜柚优良新群体的扩繁与今后的基因工程研究奠定基础。在后续中还可进一步对体细胞胚胎发生的分子机理及生理生化机制进行研究,把促进体细胞胚胎发生的研究成果在实际生产中进行应用。
[1] 赖镇国.琯溪蜜柚生态高效栽培技术[J]. 农业与技术,2017,37(11):84-85.
[2] 任海燕,薛晓芳,王永康. 果树体细胞胚胎发生影响因子研究进展[J]. 山西果树,2016(4):19-22.
[3] 鲁旭东,萧浪涛,刘华英. 脱落酸与植物体细胞胚胎发生关系的研究进展[J].生物技术通报,2003(5):19-26.
[4] 黄靖. 金橘体细胞胚胎诱导的研究[J].福建农业学报,2014,29(5):454-460.
[5] 唐启义,冯光明. 实用统计分析及DPS数据处理系统[M]. 北京:农业出版社,2002.
[6] 元英进,葛志强. 植物细胞培养工程[M]. 北京:化学工业出版社,2004.
[7] 李浚明.植物组织培养教程[M].2版. 北京:中国农业大学出版社,2003.
[8] RAO P S,HANDRO W,HARADA HOMORNAL H. Control of differentiation of shoots,roots and embryoids in leaf and stem culture ofPetuniaifllataandPetuniahybrida[J]. Phsiol Plant,1973,28:458-463.
