基于高通量测序的壳寡糖-Zn2+配合物 对衰老模型小鼠肠道菌群结构的影响
2018-03-02史周荣徐君辉曹慧娟
汤 贺,张 宾,*,史周荣,徐君辉,曹慧娟
(1.浙江海洋大学,浙江省海产品健康危害因素关键技术研究重点实验室,浙江舟山 316022;2.舟山出入境检验检疫局,浙江舟山 316021)
高通量测序技术已成为了现代生命科学研究的常用技术,其实现了同时对几百万DNA分子的测序,达到了鉴定微生物单一基因或全基因组的目的。高通量测序主要有454焦磷酸测序平台(Roche公司)、Hiseq和Miseq测序平台(Illumina公司)以及Solid 测序平台(ABI公司)。近年来,随着现代测序技术快速发展,研究者将高通量测序技术已成功应用于多个学科领域,如土壤多样化、海洋和肠道环境、发酵食品、人类健康与疾病等方面[1]。
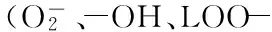
研究表明,肠道菌群作为“微生物器官”对机体的健康具有重要影响。肠道正常菌群在营养消化与吸收、抵御外来病原菌入侵和产生重要代谢产物等方面,起到不可替代的作用。肠道菌群的变化,对机体代谢产生较大影响,同时机体代谢也会引起肠道菌群的变化[6]。壳寡糖作为重要的海洋生物功能性低聚糖,其具有较好的体内外抗氧化活性,而壳寡糖对机体起到抗氧化作用的同时,对机体肠道菌群结构及功能也具有重要调节作用。此外,壳寡糖分子结构中含有大量的羟基、氨基和酰胺基,其可结合Ca2+、Mn2+、Zn2+、Fe2+等诸多金属离子,形成具有独特结构的壳寡糖金属配合物,从而表现出机体免疫调节、抗氧化及抑菌活性增强等多种功能。目前,关于壳寡糖金属配合物对生物体内肠道菌群的影响情况还尚未见报道。本实验以D-半乳糖诱导衰老模型小鼠为对象,评价制备的壳寡糖-Zn2+配合物对模型小鼠肠道菌群的影响情况,为壳寡糖及其金属修饰物的活性开发提供基础。
1 材料与方法
1.1 材料与仪器
清洁级健康昆明种小鼠 雄性,160只,体质量(25±2) g,小鼠饲养温度22~25 ℃,湿度50%~55%,每日光照12 h,实验期间自由饮水,饲喂标准饲料(由浙江海洋大学实验动物中心自制) 由广州医学院实验动物中心实验动物中心提供;壳寡糖-Zn2+配合物(壳寡糖聚合度为3~6,Zn2+含量为(26.2±0.2) mg/g配合物,纯度>95%) 浙江海洋大学水产品加工及贮藏研究室制备;D-半乳糖、戊巴比妥纳 国药集团化学试剂有限公司;TransStart FastPfu DNA Polymerase、TruSeqTMDNA Sample Prep Kit等 Illumina公司;AxyPrepDNA凝胶回收试剂盒 AXYGEN公司;丙二醛(MDA)含量试剂盒 南京建成生物工程研究所。
ABIGeneAmp®9700型PCR仪 美国ABI公司;QuantiFluorTM-ST蓝色荧光定量系统 Promega公司;MDF-U53V型超低温冰箱 日本SANYO公司。
1.2 实验方法
1.2.1 氧化衰老小鼠模型的建立 实验小鼠的管理及实验过程,依据GB14925-2010《实验动物》管理规范进行。以常规饲料(营养成分依据GB 14924.3-2010)对实验小鼠进行适应性喂养1周后,采用颈背部皮下注射法制备氧化衰老模型小鼠。D-半乳糖溶液注射量120 mg/(kg·d),每日1次,连续造模6周,定期尾静脉取血测丙二醛(MDA)含量,依据试剂盒说明书进行测定。选取氧化衰老模型小鼠,共随机分为以下7组,21只/组(7只/笼,每组3个平行笼)。
实验分组:空白对照(N)、模型对照(M)、阳性对照(Y,15 mg/(kg·d)VC)、壳寡糖灌胃组(CH,500 mg/(kg·d))、ZnSO4灌胃组(Zn,40 mg/(kg·d))、壳寡糖+ZnSO4灌胃组(CO,500 mg/(kg·d)壳寡糖+40 mg/(kg·d)ZnSO4)和壳寡糖-Zn2+配合物灌胃组(CZ,500 mg/(kg·d))。
处理过程:除去空白组外,其余各组均以每日继续给予120 mg/(kg·d)D-半乳糖颈背部皮下注射,同时进行灌胃(1 mL)。其中,空白组与模型组采用生理盐水灌胃,其余各组采用等体积的对应物质进行灌胃。持续30 d后,将实验动物禁食12 h,40 mg/kg的2%戊巴比妥纳腹腔注射麻醉后,采用颈椎脱臼法处死小鼠,解剖取盲肠部分,进行肠道菌群组成分析。
1.2.2 肠道菌群结构分析 将获取的小鼠盲肠内容物,冻藏于-80 ℃超低温冰箱中进行贮藏。样品解冻后,对肠道菌群采用DNA提取试剂盒法抽提基因组DNA,利用1%琼脂糖凝胶电泳检测抽提的基因组DNA;按指定测序区域,合成带有barcode特异引物,进行PCR扩增。针对16S rRNA基因V3/V4区合成特异引物,利用338F(5′-ACTCCTACGGGAGG CAGCA-3′)和806R(5′-GGACTACHVGGGTWT CTAAT-3′)引物进行PCR扩增。采用AxyPrepDNA凝胶回收试剂盒回收,QuantiFluorTM-ST蓝色荧光定量系统进行检测定量,而后进行Illumina Miseq 2x300 bp高通量测序及生物信息学分析。
1.3 软件数据分析
Miseq测序得到PE reads,首先根据overlap关系进行拼接,对序列质量进行质控和过滤,区分样本后进行OTU聚类和物种分类学分析。基于OTU聚类分析结果,进行多种多样性指数分析以及对测序深度进行检测;基于分类学信息,在各个分类水平上进行群落结构的统计分析(由微基生物科技(上海)有限公司协助完成)。
2 结果与分析
2.1 衰老小鼠模型的制备
颈背部皮下注射D-半乳糖造模过程中,小鼠体质量逐渐增加但增加速率较为缓慢,造模后期小鼠毛发失去光泽,并开始出现少量脱落现象。连续造模6周后,模型组小鼠血清、肾脏及肝脏中丙二醛含量增加显著(p<0.01),其含量分别达到(39.45±4.19) nmol/mg、(9.96±0.42) nmol/mg和(7.02±0.83) nmol/mg,而空白组小鼠丙二醛含量仅为(22.57±2.80) nmol/mg、(6.20±0.23) nmol/mg和(1.69±0.24) nmol/mg。由此表明,通过D-半乳糖诱导,已成功制备出衰老小鼠模型。
2.2 肠道菌群物种注释与评估
2.2.1 测序数据统计 采用Illumina高通量测序获得小鼠肠道样本原始序列数据后,采用Trimmomatic软件进行序列质控,Flash软件进行序列拼接,再经序列优化及统计后得到各实验组有效序列范围为31727~36486条,其平均长度范围为434.69~439.82 bp。进而对样品序列进行聚类分析,在97%相似水平下的OTU(operational taxonomic unit)生物信息统计发现,各处理组得到的OTU个数范围为255~376,其中空白对照组OTU数量最低为255,而壳寡糖-Zn2+配合物和壳寡糖组OTU数量较高,分别为377和376(表1)。

表1 各组样品有效序列与OTU数量统计Table 1 Observed valid sequence and OTU number in different groups
2.2.2 不同分类水平上的物种注释 为获得每个OTU对应物种分类信息,采用RDP classifier贝叶斯算法对OTU序列进行分类学分析,并分别在门(Phylum)和科(Family)水平上统计各样本群落组成(图1)。在门分类水平上,不同给药后小鼠肠道菌群主要由放线菌门、拟杆菌门、蓝藻门、脱铁杆菌、厚壁菌门、变形菌门、Saccharibacteria、软壁菌门、疣微菌门等9个门组成,其中厚壁菌门和拟杆菌门为主要优势菌门,该结果与王雪等[7]报道结果一致。对于空白对照组(N),拟杆菌门所占比例为10.46%。经D-半乳糖诱导后,各组拟杆菌门所占比例均明显升高,其中以模型组(M)中增加幅度最高达41.42%(p<0.05)。壳寡糖(CH)、ZnSO4、壳寡糖-Zn2+配合物(CZ)及阳性对照(VC)给药处理,相比于模型对照组,对拟杆菌门丰度的升高均具有明显缓解作用。对于厚壁菌门,空白对照组(N)中所占比例为79.79%,经D-半乳糖诱导后,各组样本中厚壁菌门所占比例均显著降低(p<0.05),其中模型组、ZnSO4和壳寡糖+ZnSO4处理组降低幅度较大,分别至50.32%、36.63%和43.71%。研究表明,D-半乳糖诱导可使小鼠体内类似半乳糖血症的代谢功能紊乱,致使氧化应激效应增强,造成体内线粒体及神经损伤,氧化衰老进程加速。厚壁菌门在肠道中主要功能是对碳水化合物和蛋白质进行水解,而拟杆菌门主要作用于类固醇、多糖和胆汁酸,其有助于机体对多糖的吸收以及蛋白质的合成[8-9]。Larsen等[10]发现糖尿病患者肠道内,拟杆菌门和厚壁菌门占整体菌群总含量90%以上,二者比例与血糖浓度成正比;同时,变形菌门在肠道内大量富集现象,并伴随着血糖浓度升高,其含量也显著增加(p<0.05)。本研究中,D-半乳糖诱导显著影响了正常小鼠肠道中厚壁菌门和拟杆菌门的丰度及相互间的比例关系,阳性对照、壳寡糖和壳寡糖-Zn2+配合物对这两个菌门表现出一定调节作用,而ZnSO4和壳寡糖+ZnSO4处理的调节作用相对较弱。
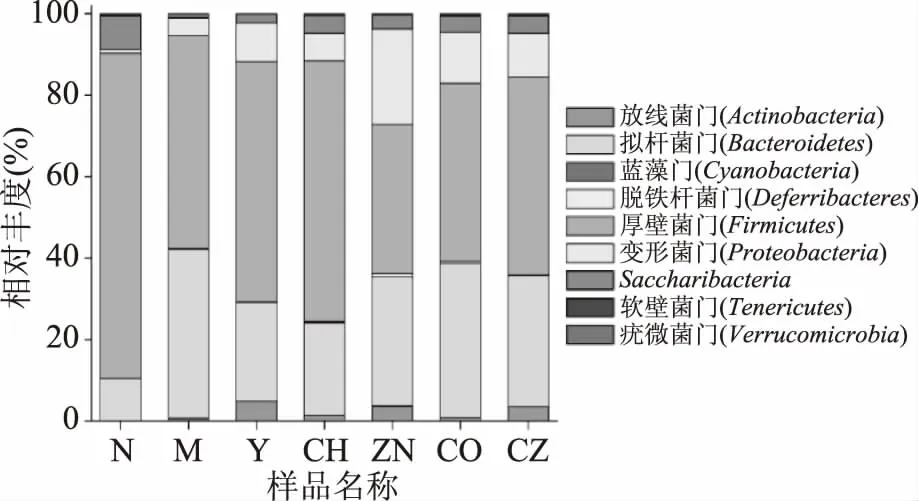
图1 不同给药后小鼠肠道菌群组成(门水平)Fig.1 Bacterial community composition at phylum level in different groups

图2 不同给药后小鼠肠道菌群组成(科水平)Fig.2 Bacterial community composition at family level in different groups
在科分类水平上(图2),空白小鼠(N)肠道中乳杆菌科(Lactobacillaceae)、瘤胃菌科(Ruminococcaceae)、毛螺菌科(Lachnospiraceae)所占比例相对较高,三者相对丰度之和达到66.87%。经D-半乳糖诱导后,小鼠肠道中BacteroidalesS24-7 group所占比例大幅增加,其中以模型组(M)丰度值最高达31.60%,壳寡糖-Zn2+配合物给药组(CZ)丰度值较低为16.69%,而其他各组均显著高于壳寡糖-Zn2+配合物组(p<0.05)。研究表明,在肠炎模型及高脂饲喂小鼠肠道菌群组成中,BacteroidalesS24-7 group丰度均显著增加,其含量变化与诸多外界环境及诱导胁迫因素有关[11-12]。本实验中,空白组小鼠肠道样本中BacteroidalesS24-7 group含量较低,壳寡糖-Zn2+配合物和VC(阳性对照)给药对BacteroidalesS24-7 group调节作用显著,且显著高于其他各组和模型组(p<0.05),表明壳寡糖-Zn2+配合物可通过调控BacteroidalesS24-7 group含量而减弱氧化胁迫对小鼠的影响作用。另一方面,乳杆菌科(Lactobacillaceae)所占比例显著降低,除壳寡糖+ZnSO4组外其它各给药组间无显著性差异(p>0.05)。VC和壳寡糖-Zn2+配合物给药对小鼠肠道内消化球菌科(Peptococcaceae)丰度有增加效果,显著高于其他各组(p<0.05)。消化球菌科细菌为动物肠道常驻细菌,相关研究表明动物体内多种内毒素含量与该科细菌呈负相关关系,即体内消化球菌科一定程度上表明该给药组体内相关内毒素含量较少[13],进一步说明VC和壳寡糖-Zn2+配合物可有效减少小鼠体内氧化炎症反应程度。此外,VC和壳寡糖-Zn2+配合物对小鼠肠道内瘤胃菌科(Ruminococcaceae)和毛螺菌科(Lachnospiraceae)含量具有一定升高作用。Suchodolski等[14]认为瘤胃菌科和毛螺菌科在机体内具有一定的肠道保护作用,其在胃肠道炎症诱导模型小鼠中含量变化显著。从科水平综合分析来看,与空白组(N)和模型组(M)相比,阳性对照(Y)、壳寡糖(CH)和壳寡糖-Zn2+配合物(CZ)对D-半乳糖诱导衰老小鼠肠道内菌群组成具有一定的恢复作用。
2.3 肠道菌群多样性指数分析
样本微生物多样性,可通过单样本多样性分析(Alpha多样性)反映微生物群落的丰度和多样性。表征样品菌群丰度(Community richness)主要有Ace和Chao指数,表征菌群多样性(Community diversity)主要有Shannon和Simpson指数[15]。此外,Coverage代表各样本文库覆盖率,其数值越高,则样本中序列被测出的概率越高,而没有被测出的概率越低,直接反映测序结果是否代表样本中微生物的真实情况。
由表2结果可知,所有样本测序覆盖率(Coverage)均在0.998以上,说明测序对样本中细菌的覆盖率很高、测序深度适合,可满足样品中细菌多样性分析的需要[16]。各组Chao和Ace指数数值近似,表明各样本中物种数均较为丰富。此外,由稀释曲线分析结果发现(图3),当样品测序数量超过20000时,稀释曲线趋向饱和,表明样品序数据量合理,更多数据量只会产生少量新OTU[17]。Shannon-Wiener曲线趋向平坦,说明测序数据量足够大,可反映样本中绝大多数的微生物信息。上述现象表明,随着测序量增加新的菌系不会被发现,微生物多样性也不会发生变化。相比于其他组,空白组小鼠肠道菌群样品Ace、Chao和Shannon指数值最低、Simpson指数最高,表明其菌群丰度及多样性较低。经D-半乳糖诱导后,各组样品Ace、Chao和Shannon指数升高、Simpson指数降低,由此可说明D-半乳糖诱导致使小鼠肠道菌群结构发生了显著变化,致使菌群多样性增加。在各给药组中,以壳寡糖、壳寡糖-Zn2+配合物对小鼠肠道菌群多样性增加幅度较大,该结果与以上的菌群组成分析结果相一致(图1和图2)。

表2 各组样品的多样性指数分析Table 2 Diversity of bacterial community in different groups

图3 稀释曲线(A)和Shannon-Wiener曲线(B)分析Fig.3 Results of the Rarefaction curves(A) and Shannon-Wiener curves(B)
2.4 肠道菌群样本组成分析
Heatmap用颜色变化来反映二维矩阵或表格中数据信息,可直观的将数据值大小以定义颜色深浅表示出来。在Heatmap图上,将高丰度和低丰度物种分块聚集,通过颜色梯度及相似程度来反映多个样本群落组成相似性和差异性[18]。从物种和样本两个层面对OTU进行聚类,绘制物种丰度热图,结果如图4所示。由样本间菌群结构相似度分析发现,空白小鼠组(N)单独聚为一类,而经D-半乳糖诱导后小鼠聚为另一大类,表明D-半乳糖诱导对小鼠肠道菌群结构产生了显著影响。在模型组及各给药组中,又可分为三个分支:模型组(M);壳寡糖组(CH)和ZnSO4组(ZN);阳性对照(Y)、壳寡糖+ZnSO4(CO)和壳寡糖-Zn2+配合物(CZ)。以上结果表明,相比于模型组,各给药处理对小鼠肠道菌群结构均产生了显著影响,尤其壳寡糖+ZnSO4(CO)和壳寡糖-Zn2+配合物(CZ)处理效果较好。
对于菌门丰度聚类分析发现(图4),对空白组样本相比,各样本中厚壁菌门丰度显著减少(颜色变浅)、拟杆菌门和变性菌门丰度显著增加(颜色加深),该结果与不同分类水平上的物种注释结果相一致。以空白、模型、阳性对照和壳寡糖-Zn2+配合物组样本的物种比例和分布分析发现(结果图略),在界、门、纲、目、科等水平上,D-半乳糖诱导后小鼠肠道样本菌群结构、丰度及相互比例,均发生了显著性变化,表明D-半乳糖在诱导小鼠体内氧化应激效应同时,对其肠道菌群也产生了较大影响,或D-半乳糖通过改变小鼠肠道菌结构而产生了较强的氧化应激效应。相比于模型对照组,壳寡糖-Zn2+配合物和VC给药处理,表现出对氧化衰老小鼠肠道菌群结构的逆向恢复作用,使其肠道菌群比例和分布更加接近于空白组样本。
2.5 肠道菌群样本PCA比较分析
PCA分析(Principal Component Analysis),即主成分分析,其通过分析不同样本OTU(97%相似性)组成,可反映样本间的差异和距离。PCA运用方差分解,将多组数据的差异反映在二维坐标图上[19]。不同样本可能表现出分散和聚集的分布情况,样本组成越相似,其反映在PCA图中的距离越近。小鼠肠道样本PCA分析结果,如图6所示。对于主成分PC1-2分析,空白组(N)与其他诱导组样本相聚较远,说明D-半乳糖诱导对小鼠肠道菌群组成及结构影响显著;阳性对照(Y)、壳寡糖-Zn2+配合物组(CZ)样本菌落组成最相近,通过PCA分析无法区分,即壳寡糖-Zn2+配合物与VC给药,对于小鼠肠道菌群的影响作用较为相近。对于主成分PC1-3分析,在PC3轴上,阳性对照(Y)、壳寡糖-Zn2+配合物(CZ)和壳寡糖+ZnSO4组(CO)本菌落组成最相近,且在PC1轴上无法区分,也说明该三组在优微生物组成中无显著性差异。对于主成分PC2-3分析,空白组(N)、阳性对照(Y)、壳寡糖-Zn2+配合物(CZ)和壳寡糖+ZnSO4组(CO)距离相对较为接近,从某种程度上,其样本菌群组成及结构具有一定相似性。

图6 小鼠肠道样本PCA分析Fig.6 PCA of intestinal microbiota for different samples注:PC1-2、PC1-3、PC2-3分别是 用前三个主要成分两两组合作图。
3 讨论

4 结论
以D-半乳糖注射法构建氧化衰老小鼠模型,以VC给药为阳性对照,探究壳寡糖、壳寡糖-Zn2+配合物对模型小鼠肠道菌群结构的影响。结果发现,相比于正常组,D-半乳糖诱导造成小鼠肠道微生物丰度增加,菌群Alpha多样性升高,表明氧化诱导造成了机体代谢紊乱、肠道菌群发生显著性变化。相比于模型组,壳寡糖、壳寡糖-Zn2+配合物给药处理,对氧化衰老小鼠肠道中部分微生物具有一定逆向恢复作用。研究表明,小鼠肠道菌群关系与机体的氧化衰老之间具有一定相关性,壳寡糖及其Zn2+配合物可作为一种体内功能型抗氧化剂,调控机体生理功能及肠道菌群结构。
[1]刘冬恋,廖梦玲,周欢. 基于高通量测序技术分析糖尿病与肠道菌群相关性的研究进展[J]. 生物技术通报,2016,32(9):59-64.
[2]von Martels JZ,Sadaghian SM,Bourgonje AR,et al. The role of gut microbiota in health and disease:Invitromodeling of host-microbe interactions at the aerobe-anaerobe interphase of the human gut[J]. Anaerobe,2017,44:3-12.
[3]Toscano M,De GR,Miniello VL,et al. Ability of Lactobacillus kefiri LKF01(DSM32079)to colonize the intestinal environment and modify the gut microbiota composition of healthy individuals[J]. Digestive and Liver Disease,2017,49(3):261-267.
[4]孙玉军,江昌俊. 秀珍菇多糖对D-半乳糖致衰老小鼠的保护作用[J]. 食品科学,2017,38(5):251-256.
[5]Zhuang Y,Ma Q,Yan G,et al. Protective effects of rambutan(Nepheliumlappaceum)peel phenolics on H2O2-induced oxidative damages in HepG2 cells and d-galactose-induced aging mice[J]. Food and Chemical Toxicology,2017. Doi:10.1016/j.fct.2017.01.022.
[6]叶雷,闫亚丽,陈庆森,等. 高通量测序技术在肠道微生物宏基因组学研究中的应用[J]. 中国食品学报,2016,16(7):216-223.
[7]王雪,赵龙玉,赵凤春,等. 应用Illumina高通量测序技术探究长根菇多糖对小鼠肠道菌群的影响[J]. 食品科学,2015,36(19):222-226.
[8]Xu J,Bjursell MK,Himrod J,et al. A genomic view of the human-Bacteroides thetaiotaomicron symbiosis[J]. Science,2003,299(5615):2074-2076.
[9]Bäckhed F,Ley RE,Sonnenburg JL,et al. Host-bacterial mutualism in the human intestine[J]. Science,2005,307(5717):1915-1920.
[10]Larsen N,Vogensen FK,Fw VDB,et al. Gut microbiota in human adults with type 2 diabetes differs from non-diabetic adults[J]. Plos One,2010,5(2):e9085.
[11]Rooks MG,Veiga P,Wardwell-Scott LH,et al. Gut microbiome composition and function in experimental colitis during active disease and treatment-induced remission[J]. Isme Journal,2014,8(7):1403-1417.
[12]Ormerod KL,Wood DLA,Lachner N,et al. Genomic characterization of the uncultured Bacteroidales,family S24-7,inhabiting the guts of homeothermic animal[J]. Microbiome,2016,4(1):36.
[13]张伟,张义,张超,等. 中药复方对育肥猪血清氧化指标及肠道菌群的影响[J]. 中国兽医学报,2015,35(12):2008-2013.
[14]Suchodolski JS,Xenoulis PG,Paddock CG,Steiner JM,Jergens AE. Molecular analysis of the bacterial microbiota in duodenal biopsies from dogs with idiopathic inflammatory bowel disease[J]. Vet Microbiol,2010,142:394-400.
[15]Preidis GA,Ajami NJ,Wong MC,et al. Composition and function of the undernourished neonatal mouse intestinal microbiome[J]. Journal of Nutritional Biochemistry,2015,26(10):1050-1057.
[16]曲巍,张智,马建章,等. 高通量测序研究益生菌对小鼠肠道菌群的影响[J]. 食品科学,2017,38(1):214-219.
[17]杨俊花,赵志辉,郭文博,等. 应用Illumina-MiSeq高通量测序技术分析脱氧雪腐镰刀菌烯醇对小鼠肠道菌群的影响[J]. 动物营养学报,2017,29(1):158-167.
[18]Li K,Zhuo C,Teng C,et al. Effects of Ganoderma lucidum polysaccharides on chronic pancreatitis and intestinal microbiota in mice[J]. International Journal of Biological Macromolecules,2016,93:904-912.
[19]Porras D,Nistal E,Martínezflórez S,et al. Protective effect of quercetin on high-fat diet-induced non-alcoholic fatty liver disease in mice is mediated by modulating intestinal microbiota imbalance and related gut-liver axis activation[J]. Free Radical Biology and Medicine,2017,102:188-202.
[20]Xia WS,Liu P,Zhang JL,et al. Biological activities of chitosan and chitooligosaccharides[J]. Food Hydrocolloids,2011,25(2):170-179.
[21]肖定福,钟佳,刘进辉,等. 壳寡糖对脂多糖诱导猪空肠上皮细胞氧化损伤的作用[J]. 动物营养学报,2016,28(7):2090-2095.
[22]Kong XF,Zhou XL,Lian GQ,et al. Dietary supplementation with chitooligosaccharides alters gut microbiota and modifies intestinal luminal metabolites in weaned Huanjiang mini-piglets[J]. Livestock Science,2014,160(1):97-101.
[23]Zhang XF,Ding CL,Liu H,et al. Protective effects of ion-imprinted chitooligosaccharides as uranium-specific chelating agents against the cytotoxicity of depleted uranium in human kidney cells[J]. Toxicology,2011,286(1):75-84.
