核桃仁皮不同极性提取物的 体外抗氧化活性分析
2018-03-02蒲成伟
蒲成伟,阚 欢,刘 云
(西南林业大学,云南昆明 650224)
核桃(JuglanssigillataL)又名胡桃、羌桃,为核桃科(Jugladaceac)核桃属(Juglans)植物。核桃不仅含有大量的油脂与优质蛋白质,还富含多种矿物质、多糖、黄酮和多酚类物质,是一种重要的营养保健佳品。核桃仁皮是核桃仁表面的一层薄膜,约占整个核桃仁质量的10%[1],鲜核桃成乳白色,干核桃为褐色。核桃仁皮中存在大量苦味物质,极易影响产品的口感[2],因此常被当做废弃物处理,不仅造成了极大的资源浪费,也给环境带来很大压力。国外许多研究已经证明,核桃仁中对人体有益的多酚类物质主要集中在种皮部分[3-6],且核桃的功效与多酚类物质有直接关系[7-9],例如抗氧化[10]、抗肿瘤[11]、抗病毒[12]、抑菌、降血糖、降血脂、保护心血管[13]、抗衰老、提高免疫力、保护大脑和神经系统等[14-17],因此对核桃仁皮中多酚的研究具有重大意义。
本文采用云南大理泡核桃仁皮为原料,以有机溶剂萃取法得到核桃仁皮不同极性提取物,分别采用清除DPPH自由基、OH自由基、ABTS自由基体系与铁离子还原能力对核桃仁皮不同极性提取物进行体外抗氧化活性分析,旨在为核桃天然抗氧化剂的开发提供参考。
1 材料与方法
1.1 材料与仪器
核桃仁皮 云南大理泡核桃;Folin-Ciocalteu试剂 上海源叶生物科技有限公司;l,l-二苯基-2-三硝基苯肼(DPPH)(纯度≥98%) Sigma公司;2,2-联氮-双-(3-乙基苯并噻唑-6-磺酸)(ABTS)(纯度≥98%)上海源叶生物科技有限公司;硫酸亚铁、磷酸二氢钾、十二水和磷酸氢二钠等 均为分析纯,广东光华化学厂有限公司;没食子酸、水杨酸、过氧化氢、过硫酸钾、铁氰化钾、氯化铁、三氯乙酸、抗坏血酸VC、无水乙醇等 均为分析纯,天津市风船化学试剂科技有限公司。
101-2AB型电热风鼓风干燥箱 天津市泰斯特仪器有限公司;YB-2型高速多功能粉碎机 永康市速峰工贸有限公司;电子天平 赛多利斯科学仪器(北京)有限公司;HH-2型恒温水浴锅 金坛市杰瑞尔电气有限公司;德国Sigma 3k15高速(冷冻)离心机 上海思高勒生物科技有限公司;UV2600紫外分光光度计 岛津仪器(苏州)有限公司;FD5-series冻干机 美国金西盟国际集团中国分公司;RE-52系列旋转蒸发器 上海亚荣生化仪器厂;SB25-12DTDS型超声波清洗机 宁波新艺超声设备有限公司。
1.2 实验方法
1.2.1 核桃仁皮粗提取的制备 核桃仁皮粗提物的提取参照文献[18-19]并略作修改。将核桃仁皮于50 ℃烘干至恒重,粉碎后过60目筛。准确称取250 g核桃仁皮粉末,在60 ℃条件下加入60%乙醇(料液的质量体积比为1∶6),于200 W下超声波辅助提取50 min,过滤,收集滤液;滤渣按上述步骤反复提取2次,合并滤液。将滤液在50 ℃条件下旋转蒸发,除去溶剂,定容至100 mL,即为核桃仁皮多酚粗提取物。
1.2.2 核桃仁皮不同极性相提取物的制备 将100 mL核桃仁皮粗提物,完全转移至分液漏斗中,按体积比(1∶1)加入石油醚,摇匀,静置至完全分层,放出下层水溶液,倒出上层石油醚层溶液,将水溶液用同样方法连续萃取2次;将三次石油醚溶液合并,在50 ℃条件下减压浓缩,得到核桃仁皮的石油醚相提取物。采取同样方法将剩余水溶液依次用氯仿、乙酸乙酯、正丁醇萃取,即可分别得到核桃仁皮氯仿、乙酸乙酯、正丁醇、水相的粗提物。将不同极性粗提物存放于4 ℃冰箱备用。
1.2.3 核桃仁皮不同极性相溶液的配制 准确称取不同极性相的粗提物样品0.1 g,溶解定容至100 mL容量瓶中,作为母液备用。乙酸乙酯、正丁醇、水相以蒸馏水为溶剂,氯仿、石油醚相以95%乙醇为溶剂,于4 ℃下避光保存。
1.2.4 多酚含量的测定
1.2.4.1 没食子酸标准曲线的绘制 没食子酸标准曲线的制作参照文献[20]并稍作修改。准确称取0.1 g没食子酸,以蒸馏水为溶剂配制浓度为1 mg/mL的母液,将母液分别稀释成浓度为10、20、30、40、50、60 μg/mL的没食子酸标准液备用。准确移取10、20、30、40、50、60 μg/mL的没食子酸标准液1 mL,Folin-Ciocalteau试剂5 mL,充分混匀,反应5~8 min后加入4 mL 7.5%碳酸钠溶液,摇匀,避光反应1 h,以蒸馏水调零,于765 nm 波长处测定标准液吸光度,重复3次。以吸光值为纵坐标,质量浓度为横坐标,得没食子酸浓度(μg/mL)与吸光度(A)的回归方程。
1.2.4.2 核桃仁皮不同极性提取物中多酚含量的测定 移取“1.2.3”方法所配制的不同极性溶剂提取物母液1 mL,用蒸馏水稀释至50 mL,其余按照“1.2.4.1”方法操作,测定体系在765 nm处吸光度,并根据没食子酸标准曲线方程式计算不同极性提取物中多酚含量。
1.2.5 核桃仁皮不同极性相提取物抗氧化实验
1.2.5.1 DPPH自由基清除能力的测定 DPPH自由基清除能力的测定参照文献[21]并稍作修改。将浓度为1 mg/mL的不同极性相母液,以95%乙醇稀释为2、4、6、8、10、20 μg/mL的样品液。移取2 mL DPPH-乙醇溶液,2 mL不同浓度样品液于试管中,混合均匀后,在37 ℃条件下避光反应30 min,在517 nm处测定吸光值AX,并以蒸馏水或95%乙醇替代样品测吸光度A0,平行3次取平均值。以VC作对照。
DPPH自由基清除率公式如下:
式中:A0-空白吸光度,AX-样品吸光度。
1.2.5.2 OH自由基清除能力的测定 OH自由基清除能力的测定参照文献[22-23]并稍作修改。将浓度为1 mg/mL的不同极性相母液,以95%乙醇稀释为200、400、600、800、1000 μg/mL的样品液,依次往试管中加入9 mmol/L乙醇-水杨酸2 mL、9 mmol/L FeSO42 mL、样品液2 mL、8.8 mmol/L H2O22 mL,每加一种溶液立即摇匀,以蒸馏水调零,测定AX,以蒸馏水代替样品测定AO,以无水乙醇代替乙醇-水杨酸测定AX0。平行3次取平均值,以VC做对照。
羟自由基清除率公式如下:
式中:A0-空白吸光度,AX-样品吸光度,AX0-无水乙醇代替乙醇-水杨酸吸光度。
1.2.5.3 铁离子还原能力的测定 铁离子还原能力的测定参照文献[24]并稍作修改。将浓度为1 mg/mL的不同极性相母液以95%乙醇稀释为20、40、60、80、100 μg/mL的样品液。先后移取pH6.6磷酸缓冲液2.5 mL、1%铁氰化钾2.5 mL、不同浓度的样品液2.5 mL于离心管中混合均匀,于50 ℃水浴20 min后,再加入10% 三氯乙酸(TCA)溶液2.5 mL,混合后于4000 r/min离心5 min,取上清液2.5 mL,加入蒸馏水2.5 mL、0.1%三氯化铁2.5 mL,静置10 min,700 nm处测定吸光值,以95%乙醇代替样品做参比溶液,平行3次取平均值,以VC作对照。
1.2.5.4 ABTS自由基清除能力的测定 ABTS自由基清除能力的测定参照文献[24]并稍作修改。ABTS自由基反应贮备液的配制:取50 mL浓度为7 mmol/L的ABTS溶液与50 mL浓度为5.0 mmol/L的过硫酸钾溶液混合,在室温下置于暗处反应12~16 h,作为反应贮备液,在波长734 nm处,用70%乙醇将ABTS自由基反应贮备液稀释至吸光值为0.70±0.02备用。将浓度为1 mg/mL的不同极性相母液用70%乙醇稀释为20、40、60、80、100 μg/mL的样品液,分别向试管中加入0.1 mL不同浓度样品溶液,3.9 mL ABTS自由基反应贮备液,室温下避光准确反应6 min,以70%乙醇调零,于波长734 nm处迅速测定吸光值As。同时以70%乙醇替代样品液作空白,于波长734 nm处测定吸光值Ab,平行3次取平均值,以VC作对照。
ABTS自由基清除率公式如下:
式中:A0-空白吸光,AX-样品吸光度。
1.3 数据统计分析
采用SPSS 22.0与Microsoft Excel 2007对实验数据进行分析处理。
2 结果与分析
2.1 核桃仁皮多酚含量的测定
2.1.1 没食子酸标准曲线 没食子酸标准曲线见图1。
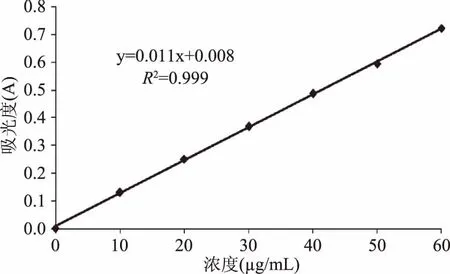
图1 没食子酸标准曲线Fig.1 Standard curve of gallic acid
2.1.2 核桃仁皮不同极性相提取物中多酚含量 由图2可知,各极性相多酚含量由高到低依次是乙酸乙酯相(805.6 mg/g)、水相(229.19 mg/g)、正丁醇相(164.66 mg/g)、氯仿相(103.12 mg/g)、石油醚相(37.75 mg/g)。在四种不同极性的溶剂中,乙酸乙酯提取相中的多酚含量分别是正丁醇提取相的4.89倍,氯仿提取相的7.81倍,石油醚提取相的23.41倍,因此核桃仁皮多酚的提取效果与溶剂极性有密切关系,且根据相似相溶原理,核桃仁皮中多酚的极性与乙酸乙酯溶剂的极性相近,与石油醚溶剂极性相差较大。

图2 不同极性溶剂提取物多酚含量Fig.2 Polyphenol content in extracts of different polar solvents
2.2 核桃仁皮不同极性相提取物抗氧化活性的分析
2.2.1 核桃仁皮不同极性提取物的DPPH自由基清除能力 DPPH自由基中由于存在多个吸电子的-NO2和苯环的大π键,所以氮自由基能稳定存在。DPPH自由基的无水乙醇溶液呈紫色,在517 nm波长处有最大吸收,吸光度与浓度呈线性关系。向反应体系中加入具有自由基清除效果的样品时,就可以结合或替代DPPH自由基,从而使DPPH自由基数量减少,吸光度变小,溶液颜色变浅,借此可评价样品清除DPPH自由基的能力。
如图3所示,核桃仁皮不同极性多酚提取物均具有清除DPPH自由基能力,且在一定浓度范围内DPPH自由基清除率随各极性提取物质量浓度上升而增加,但当各极性提取物达到一定浓度后,对DPPH自由基的清除效果趋于平缓。以IC50为衡量指标,比较几种不同极性提取物对DPPH自由基的清除率,半数清除率越低,表明该种物质对DPPH自由基的清除能力越强,反之越弱,则DPPH自由基清除能力大小分别为乙酸乙酯(IC50=5.004 μg/mL)>VC(IC50=5.99 μg/mL)>水(IC50=6.745 μg/mL)>正丁醇(IC50=9.596 μg/mL)>氯仿(IC50=23.681 μg/mL)>石油醚(IC50=48.316 μg/mL)。各极性相多酚提取物清除DPPH自由基的整体效果由强到弱分别是 乙酸乙酯相>正丁醇相>氯仿相>石油醚相。当VC浓度分别低于5.5与8.0 μg/mL时,对DPPH自由基的清除效果弱于水相与乙酸乙酯相提取物,但高于其他相提取物,当浓度超过8 μg/mL时,清除效果最好。当浓度达到20 μg/mL时,各极性相提取物以及VC的清除率分别是乙酸乙酯相72.79%、水相65.32%、正丁醇相60.75%、氯仿相43.19%、石油醚相36.47%、VC83.84%。

图3 核桃仁皮不同极性提取物对DPPH自由基清除效果Fig.3 DPPH radical-scavenging activities of different polar extracts from walnut kernel pellicle
2.2.2 核桃仁皮不同极性提取物的OH自由基清除能力 利用Fenton反应体系产生OH自由基,OH自由基极易攻击芳环化合物产生羟基化合物,当向反应体系加入水杨酸时,OH自由基与水杨酸会产生在510 nm处有特殊吸收的2,3-二羟基苯甲酸。如果向反应体系中加入具有清除OH自由基能力的样品液时,就会减少反应体系中的OH自由基,从而使有色化合物的产量减少,因此采用固定时间反应法,以反应体系在510 nm处的吸光度来反映样品液对OH自由基的清除效果。
由图4可知,核桃仁皮不同极性多酚提取物均具有清除OH自由基能力,在200~1000 μg/mL的浓度范围内,OH自由基清除率随质量浓度增加而升高。四种极性相多酚提取物清除OH自由基的整体效果顺序为正丁醇相>乙酸乙酯相>氯仿相>石油醚相。以IC50为衡量指标,各极性提取物清除OH自由基的能力分别是VC(IC50=190.02 μg/mL)>正丁醇相(IC50=393.578 μg/mL)>乙酸乙酯相(IC50=510.186 μg/mL)>水相(IC50=603.429 μg/mL)>氯仿相(IC50=627.003 μg/mL)>石油醚(IC50=840.315 μg/mL),其中氯仿相与水相的IC50相近。在200~1000 μg/mL范围内氯仿相与水相内的抗氧化物质对OH自由基的清除能力相当,同等浓度下的石油醚相提取物的抗氧化物质对OH自由基的清除效果低于其他溶剂提取物,正丁醇相提取物在浓度超过400 μg/mL时,对OH自由基的清除效果明显增加。当浓度达到1000 μg/mL时,VC、正丁醇相、乙酸乙酯相、水相、氯仿相、石油醚相提取物对OH自由基的清除率分别为99.49%、74.2%、72.31%、65.55%、56.75%、53.96%。

图4 核桃仁皮不同极性提取物对OH自由基清除效果Fig.4 OH radical-scavenging activities of different polar extracts from walnut kernel pellicle
2.2.3 核桃仁皮不同极性提取物的铁离子还原能力 样品本身是一种抗氧化剂,能使铁氰化钾的三价铁还原成二价铁(亚铁氰化钾),二价铁(亚铁氰化钾)进一步再和三氯化铁反应生成在700 nm处有最大吸光度的普鲁士蓝(Fe4[Fe(CN)6]3),因此测定700 nm处吸光度的高低可以间接反映样品还原能力的大小,吸光度越大,还原能力越强。
由图5可知,不同极性提取物均具有一定的还原铁离子的能力,且随着浓度的增加,体系吸光值越大,基本成线性关系,各极性相提取物浓度越高,铁离子还原力越强。在同等浓度下乙酸乙酯相提取物的铁离子还原能力最高,其次为正丁醇相与氯仿相提取物,石油醚相提取物最低,且在整个浓度范围VC对铁离子的还原能力与乙酸乙酯相提取物的还原能力相近,正丁醇相、水相、氯仿相对铁离子还原能力相近。当浓度达到100 μg/mL时,各抗氧化剂的吸光度分别为VC=0.913、乙酸乙酯相=0.821、正丁醇相=0.509、水相=0.443、氯仿相=0.406、石油醚相=0.142。总体铁离子还原能力的大小顺序依次为VC、乙酸乙酯相、正丁醇相、水相、氯仿相、石油醚相,这与清除DPPH自由基能力的顺序一致。

图5 核桃仁皮不同极性提取物的铁离子还原能力Fig.5 The iron ion reduction ability of different polar extracts from walnut kernel pellicle
2.2.4 核桃仁皮不同极性提取物的ABTS自由基清除能力 ABTS自由基与过硫酸钾反应生成稳定的蓝绿色阳离子自由基ABTS+·,向反应体系中加入样品液,则样品液中的抗氧化物质会与ABTS+·发生反应,而使反应体系褪色,通过测定反应体系在734 nm处吸光度来反映样品液清除ABTS自由基的能力。
由图6可知,不同极性溶剂提取物清除ABTS自由基的能力具有差异性,且随各极性提取物质量浓度升高而升高,清除力由强到弱依次是乙酸乙酯相、VC、正丁醇相、水相、氯仿相、石油醚相,这与不同极性溶剂对核桃仁皮多酚提取效果有很大关系,乙酸乙酯相提取物清除ABTS自由基的能力稍高于VC,远高于其他溶剂提取物,氯仿相与石油醚相提取物对ABTS自由基清除率相当。当对ABTS自由基清除率达到50%时,各极性提取物的IC50分别为VC=50.166 μg/mL、乙酸乙酯相=29.654 μg/mL、正丁醇相=62.719 μg/mL、水相=79.575 μg/mL、氯仿相=144.475 μg/mL、石油醚相=146.424 μg/mL。
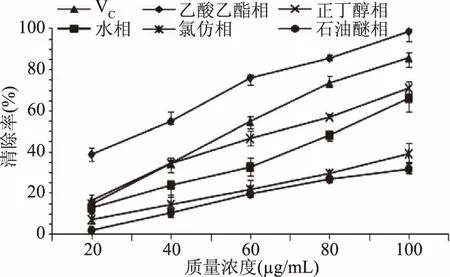
图6 核桃仁皮不同极性提取物对ABTS自由基清除效果Fig.6 ABTS radical-scavenging activities of different polar extracts from walnut kernel pellicle
3 结论
采用溶剂萃取法得到不同极性提取相中的多酚含量有较大差异,其提取多酚的能力依次为乙酸乙酯>正丁醇>氯仿>石油醚,表明核桃仁皮中强极性多酚含量高于弱极性多酚含量。
通过对不同极性提取物的体外抗氧化活性分析表明:不同极性提取物在不同反应体系中对自由基的清除能力有差别,这可能与不同极性溶剂提取物中起到抗氧化作用的物质的结构与性质有一定关系。其总体抗氧化能力乙酸乙酯提取物最强,其次为正丁醇、氯仿提取物,石油醚提取物最低。为了更加深入的研究核桃仁皮多酚的抗氧化活性,可将核桃仁皮多酚类物质的分离、纯化与结构鉴定作为当前研究的重点,以便确定抗氧化的物质基础与作用机理。
[1]万政敏,郝艳宾,杨春梅,等. 核桃仁种皮中的多酚类物质高压液相色谱分析[J]. 食品工业科技,2007,28(7):212.
[2]Cheynier V. Polyphenols in food are more complex than often though[J]. The American Journal of Clinical Nutrition,2005,81(1):223-229.
[3]SKERGET M. Phenols,proanthocyanidins,flavones and flavonols in some plant materials and their antioxidant activities[J]. Food Chem,2005,89:191-198.
[4]荣瑞芬,历重先,刘雪峥,等. 核桃内种皮营养与功能成分初步分析研究[J]. 食品科学,2008,29(11):541-543.
[5]陈虹霞,王成章,周昊,等. 核桃酚类化合物的研究进展[J]. 林产化学与工业,2013,33(1):130-134.
[6]陈永浩,李俊,郭雪霞,等. 核桃抗氧化作用研究进展[J]. 食品工业科技,2012(17):409-412.
[7]张春梅,陈朝银,林玉萍,等. 几种云南核桃内种皮黄酮及多酚含量的测定[J]. 云南中医学院学报,2013,36(2):10-13.
[8]Sina C,Ion T,Violeta N. Seasonal variation of the main individual phenolics and juglone in wallnut(Juglans regia)leave
[J]. Phamaceutical Biology,2014,52(5):575-580.
[9]Vinson J A,Cai Y. Nut,especially walnuts,have both antioxidant quantity and efficacy and exhibit significant potential health benefits[J]. Food and Function,2012(2):134-140.
[10]Li R,Liang T,Xu L,et al. Protective effect of cinnamon polyphenols against STZ-diabetic mice fed high-sugar,high-fat diet and its underlying mechanism[J]. Food Chem Toxicol,2013,51:419-425.
[11]Assadollshi V,Parivar K,Roudbari N H,et al. The effect of aqueous cinnaon extract on the apoptotie process in acute myeloid leukemia HL-60 cell[J]. Adv Biomed Res,2013(2):25-27.
[12]Su X,Howell AB,D’Souza. Antibacterial effects of plant-derived extract on methicillin-resistant Staphylocossus aureus[J].Foodborne Pathog Dis,2012,9(6):573-578.
[13]Zibema L,Kim J,Auger C,Passamonti S. Role of endnothelial cell membrane transport in red wine polyphenols-induced coronary vasorelaxationinvolvement of bilitraslocase[J]. Food Function,2013,4(10):1452.
[14]Athanasios V,Thomais V. Plant polyphenols:recent advances in epidemiological research and other studies on cancer prevention[J]. Studies in Natural Products Chemistry,2013,39:269-295.
[15]Yang J,Chen C Y,Zhao S L,et al. Effect of solvents on the antioxi dant activity of walnut(Juglans regiaL.)shell extracts[J]. Food Nutr Res,2014,2(9):621-626.
[16]Cai X X,Hong Y X,Wang S Y,et al.Purificatin and enzymatic of a novel polyphenol oxidase from lotus seed(Nelumbo nucifera Gaertn)[J]. Internation Journal of Food Science&,Technology,2015,50(4):1026-1032.
[17]Shi D D,Chen C Y,Zhao S L,et al. Walnut polyphenols inhibit pan ereatic lipase activityinvitroand have hypolipidemic effect on high-fat diet-induced obese mice[J]. Food Nutr Res,2014,2(10):757-763.
[18]周晔,王伟,陶冉,等.超声波提取核桃内种皮多酚的响应面优化及其抗氧化研究[J].林产化学与工业,2013,33(4):73-78.
[19]郜海燕,李兴飞,陈杭君,等.山核桃多酚物质提取及抗氧化研究进展[J].食品科学,2011,32(5):336-341.
[20]李启彭,寸镜楠,赵仲霞,等. Folin-Ciocalteu法测定水果中多酚含量[J]. 浙江农业科学,2016,57(12):2094-2096.
[21]木妮热·依布拉音,尤奴斯江·吐拉洪,杨艳梅,等. 芸香草不同极性提取物的体外抗氧化活性研究[J]. 安徽农业科学,2014,42(33):7738-7740.
[22]陈安均,葛焱,郭双霜,等. 18种常见水果对自由基消除作用的研究[J]. 食品研究与开发,2015(9):92-94.
[23]张贺,王倩雯,曹龙奎. 玉米多糖的提取及抗氧化性研究[J]. 粮食与油脂,2015,28(6):47-49.
[24]李笑笑,张文斌,杨瑞金. 超声处理核桃仁及其提取物的抗氧化性分析[J]. 安徽农业科学,2016,44(19):90-93.
