甜柿果实多酚类物质提取工艺的 优化及其抗肺癌细胞生长的活性研究
2018-03-02杨谷良李士明潘敏雄
杨谷良,李士明,邓 昆,潘敏雄,*
(1.经济林木种质改良与资源综合利用湖北省重点实验室,湖北黄冈 438000;2.黄冈师范学院生命科学学院,湖北黄冈 438000)
甜柿(DiospyruskakiThunb.)原产地在我国长江流域及其以南地区,是一种柿属柿科的落叶果树[1],在我国从南到北都有分布。由于柿果含有丰富的糖分、维生素、类胡萝卜素、总膳食纤维和微量元素,果实风味独特,深受人们的喜爱[2]。在我国,罗田甜柿主要起源于大别山区,因为最先在黄冈市罗田县被发现,而被命名为罗田甜柿(DiospyroskakiThunb.‘Luotian-tianshi’)[3-4]。柿果实中的多酚类物质具有抗肿瘤、抗衰老、降血压、降血脂、降胆固醇、抗氧化、清除自由基等生物活性[5-7]。
植物多酚是植物体内合成的一类复杂的次生代谢物,在植物受到损伤或感染时,可以增强植物的自身防御能力。植物中多酚类物质的提取方法主要有有机溶剂萃取法[8]、超声波法[9]、微波法[10]、酶解法[11]等。其中,有机溶剂萃取法需要对有机溶剂的极性、萃取时间和温度等进行优化;超声波法和微波法都是在溶剂萃取法的基础上,利用超声波或微波等的作用,破碎细胞,通过溶剂的极性来选择提取目的产物;酶法提取效率高,但是后续分离纯化过程中,要增加去除酶的实验步骤[12]。目前,已经从植物中分离鉴定了几百种多酚类物质。本研究利用乙醇溶液提取罗田甜柿果实中的多酚类化合物,对提取过程中的浸提时间、浸提温度和乙醇体积分数等因素进行优化,确定罗田甜柿果实多酚类化合物提取的最佳条件,并研究了所提取多酚类物质抑制肿瘤细胞生长的活性。
1 材料与方法
1.1 材料与仪器
BPN-150RHP型CO2细胞培养箱 上海一恒科学仪器有限公司;KHB-ST-360全自动酶标仪 上海华科生物工程股份有限公司;PB2002-10电子天平 瑞士Mettler-Toledo公司;GZX-9240MBE电热恒温鼓风干燥箱 上海博迅实业有限公司;722S可见分光光度计 上海棱光技术有限公司;RE-5220旋转蒸发器 上海亚荣生化仪器厂;HH-8电子恒温水浴锅 深圳国华仪器厂。
1.2 实验方法
1.2.1 柿果多酚的提取工艺 将甜柿果实清洗干净后,去除果核后切片,65 ℃烘干至恒重[13],粉碎机粉碎,过60目筛,乙醇溶液浸泡提取柿果多酚,过滤,经减压蒸馏后得柿果多酚提取物,每个处理重复3次。
1.2.2 多酚提取率的测定 以没食子酸为标准品,参照文献[11,14]的方法绘制没食子酸标准曲线,每个样品平行测定三次。
准确称取5.000 g的甜柿果实粉碎物若干份,按实验设计提取得到多酚提取液,减压蒸馏直至形成膏状提取物,刮取膏状提取物并称重(w)。用体积分数为50%的乙醇将上述膏状提取物溶解后,继续加入50%的乙醇,至总体积为100 mL。移取5 mL用乙醇稀释的溶液,用体积分数为50%的乙醇稀释至50 mL。在25 mL棕色容量瓶中分别加入0.5 mL上述乙醇稀释液、1.0 mL福林酚试剂、15.0 mL质量分数为5%的Na2CO3溶液,搅拌均匀后,加水定容到25 mL,在室温条件下静置2 h后,用分光光度计测定760 nm处的吸光值。多酚提取率按公式(1)计算:
多酚提取率(mg/100 g鲜果重)=y×20×100×N÷w
式(1)
式中:y为根据标准曲线的线性回归方程计算得到的多酚含量值,mg;20和100为提取物的稀释倍数;N为每100 g甜柿鲜果经去核和烘干等处理后得到干粉的质量,mg/100 g鲜果重;w为甜柿干粉的质量,mg。
1.2.3 柿果多酚提取的单因素实验 固定液料比为13∶1 mL∶g,提取液中NaHCO3的质量浓度为0.15%,提取时间为3 h,提取温度为 70 ℃,乙醇体积分数为70%的条件下,分别考察提取时间:1.5、2.0、2.5、3.0、3.5 h,提取温度:60、65、70、75、80 ℃,乙醇体积分数:65%、70%、75%、80%、85%对多酚提取率的影响。
1.2.4 柿果多酚提取工艺的优化 采用Box-Behnken方法,以提取时间(A)、提取温度(B)和乙醇体积分数(C)三个因素为自变量,根据单因素实验结果,进行响应面优化(表1)。
这位医生解释道,医生的水平有高有低,但都有共同的职业操守,绝不会刻意贻误病情,置病人安危于不顾,可能是因为每位医生的性格、用药习惯、诊断方式等差异,在病人眼中造成了“不说话不搭理我”、“开药和别的医生不同,恐怕是乱开”、“诊断过程很简单,看不出花了心思”等等误解。

表1 响应面实验设计因素与水平Table 1 Factors and levels of response surface methodology
1.2.5 柿果总酚对CL1-5细胞的生长抑制作用 以多西他赛为阳性对照,采用MTT法测定柿果多酚抗人肺癌细胞CL1-5生长活性[15]。人肺癌细胞系CL1-5生长于RPMI 1640培养基中(添加10%胎牛血清、100 U/mL青霉素和100 μg/mL链霉素),在95%的相对湿度、5% CO2浓度和37 ℃的温度条件下,培养CL1-5细胞。当细胞在培养瓶的生长面积达到80%以上时,弃去旧的培养基,用胰酶消化细胞,用新鲜培养基稀释至每毫升含1×105个细胞,在96 孔板中接种100 μL稀释细胞液,空白组加入100 μL培养基,37 ℃条件下培养12 h后,吸去旧培养液,在每孔中分别加入质量浓度12.5、25、50、100、200、400 μg/mL多酚提取液和12.5、25、50、100、200、400 ng/mL的新鲜RPMI 1640培养液,每个质量浓度重复5孔。对照组加入等体积的乙醇溶液,空白组加入等体积的培养基后,继续培养48 h,在所有的孔中均加入20 μL 5 mg/mL MTT溶液,将96孔板放入培养箱中继续培养4 h,4000 r/min离心5 min,弃上清液,在每孔中加入100 μL DMSO,振荡15 min后,用酶标仪检测570 nm波长处各孔的OD值。按公式(2)计算柿果多酚对CL1-5细胞的增殖抑制率。
细胞增殖抑制率(%)=[(OD正常组-OD处理组)/(OD正常组-OD空白组)]×100
式(2)
1.3 数据统计分析
利用Microsoft Excel软件整理实验数据,以SAS(statistical analysis system)统计软件分析实验结果,并以Microsoft Excel软件绘图。实验结果以平均数±标准差表示。
2 结果与分析
2.1 没食子酸标准曲线
以不同质量浓度(x)的没食子酸为横坐标、760 nm波长处的吸光度值(y)为纵坐标,绘制出了如图1的没食子酸标准曲线。所得标准曲线的线性回归方程为y=39.39x+0.030,相关系数R2=0.998。

图1 没食子酸标准曲线Fig.1 Standard curve of gallic acid
2.2 单因素实验
2.2.1 提取时间对柿果多酚提取率的影响 由图2可知,当提取时间小于3 h时,柿果多酚的提取率随提取时间的延长而不断增加,这是因为随着提取时间的延长,柿果多酚被不断从甜柿果实粉碎物中浸提出来,同时,随着提取时间的继续延长,浸提液中溶解的淀粉和蛋白质等也不断增加,提取液的黏度逐渐增大[16],在后续离心、浓缩和过滤等操作中,柿果多酚的分离效率降低,总酚提取率下降。所以,提取时间不宜超过3 h。

图2 提取时间对柿果多酚提取效果的影响Fig.2 The influence of extraction time on the extration of persimmon polyphenol

图3 提取温度对柿果多酚提取效果的影响Fig.3 The influence of extraction temperature on the extration of persimmon polyphenol
2.2.2 提取温度对柿果多酚提取率的影响 由图3可以看出,柿果多酚的提取率随着提取温度的升高而不断增加,当提取温度超过70 ℃时,随着提取温度的升高,多酚的提取效率不断降低。其原因可能是提取温度过高,多酚类物质会受到破坏,且会加快提取溶剂乙醇的挥发,另外,随着提取温度的升高,甜柿果实中其它物质的溶出率增加,提取液粘度增大,影响后续的多酚分离纯化,导致多酚提取率降低[17]。所以,柿果多酚的提取温度不宜超过70 ℃。
2.2.3 乙醇体积分数对柿果多酚提取率的影响 由图4可以看出,当乙醇体积分数小于75%时,柿果多酚的提取率随着乙醇体积分数的增加逐渐升高;当乙醇体积分数大于75%时,随着乙醇体积分数的增加,柿果多酚的提取率逐渐降低。这可能是因为,不同体积分数的乙醇在极性上存在着差异,体积分数为75%的乙醇与甜柿多酚类化合物极性相近,多酚类物质的溶解度最大;而在其它体积分数的乙醇中,多酚类物质的溶解性降低,其它物质的溶解度增加,柿果多酚的提取率降低[18]。所以,柿果多酚提取的适宜乙醇体积分数为75%。

图4 乙醇体积分数对柿果多酚提取效果的影响Fig.4 The influence of ethanol concentration on the extration of persimmon polyphenol
2.3 响应面实验结果与分析
以柿果多酚的提取率为响应值Y,通过Design-ExPert软件,对柿果多酚的提取温度(A)、提取时间(B)和乙醇体积分数(C)3个因素进行了响应面分析。对表2实验数据进行回归拟合后,得到甜柿果实多酚提取率Y对提取温度A、提取时间B和乙醇体积分数C的二次多项回归方程:
Y=3.14+0.24A-0.019B+0.016C-0.040AB-4.500E-3AC+0.021BC-0.32A2-0.57B2-0.22C2

表2 柿果多酚提取工艺优化响应面实验结果与分析Table 2 Results and analysis of response surface analysis for persimmon polyphenol extraction process optimization

表3 响应面实验结果方差分析Table 3 Variance analysis of response surface methodology
注:**为极显著,p<0.01;*为显著,p<0.05;-为不显著,p>0.05。
从表3可知,该回归模型具有极显著性(p<0.0001);模型的失拟项p>0.05,决定系数R2=0.9991,说明该模型拟合结果良好,可信度高。由各因素p值可知,提取时间(p<0.0001)、提取时间二次项、提取温度二次项和乙醇体积分数二次项对柿果多酚提取率都有极显著影响(p<0.01),提取温度、乙醇体积分数、提取时间和提取温度的交互项对柿果多酚有显著影响(p<0.05)。对交互项显著的因素进行分析,得到响应曲面图和等高线图(图5)。从图5可以看出,A、B的交互作用最为显著。

图5 提取时间、温度、乙醇体积分数对柿果多酚提取率影响的响应曲面图和等高线图Fig.5 Response surface plots and contour line of effects of extraction time,temperature and ethanol concentration on persimmon polyphenol extraction rate
根据响应面分析结果,得到乙醇浸提法提取柿果多酚的最佳提取参数为提取时间2.88 h,提取温度69.70 ℃,乙醇体积分数75.31%。在此最佳参数条件下,求得柿果多酚的最佳得率为3.186 mg/100 g鲜果重。
2.4 验证实验
为了验证响应面优化所得的结果是否可靠,根据优化后的提取条件,考虑到实际操作的需要,将优化后的提取条件修正为提取时间2.9 h,提取温度70 ℃,乙醇体积分数75%。在此条件下重复提取3次,得到柿果多酚的提取率为3.184 mg/100 g鲜果重,RSD值为0.58%,说明所建立的模型是可靠的。
2.5 柿果多酚对CL1-5细胞生长的抑制作用
甜柿果实的多酚主要成分为缩合单宁和没食子酸、儿茶素、表儿茶素等化合物,具有抑制肿瘤细胞生长、降血压、预防动脉粥状硬化等多种生物活性[19]。从图6可以看出,在细胞培养液中添加柿果多酚并培养48 h后,CL1-5细胞的半抑制浓度(IC50)值为73.8 μg/mL,对照多西他赛的半抑制浓度为36.7 ng/mL。柿果多酚具有抑制CL1-5细胞增殖的生物活性。
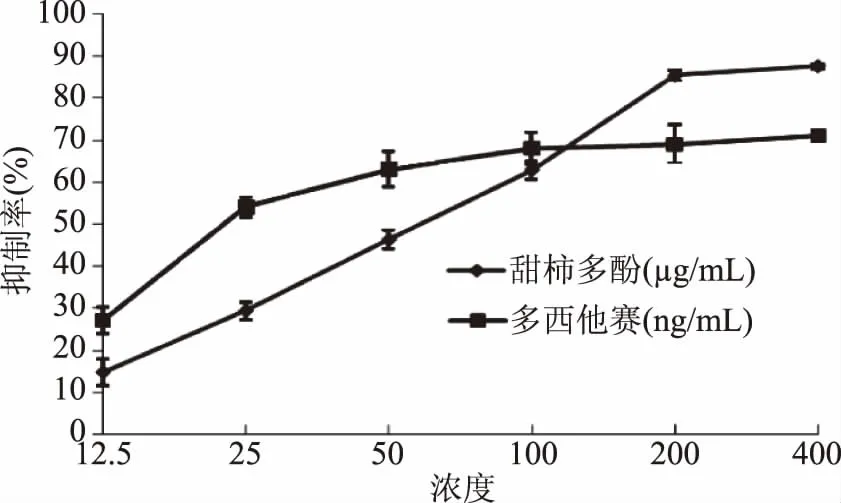
图6 柿果多酚对CL1-5细胞生长的抑制作用Fig.6 Inhibitory effect of persimmon polyphenol on the growth of CL1-5 cells
3 结论
在液料比为13∶1 (mL∶g)、提取液中NaHCO3的质量浓度为0.15%的条件下,对柿果多酚的提取时间、温度和乙醇体积分数进行单因素实验,根据单因素实验结果,通过响应面优化分析和验证,柿果多酚的最佳提取参数为:提取时间2.9 h、温度70 ℃、乙醇体积分数75%。在此条件下,从100 g甜柿鲜果中提取到了3.184 mg的多酚。本实验所得回归方程拟合度良好,预测最佳柿果多酚提取率和验证实验结果基本一致。体外抑制肺癌细胞CL1-5的IC50值为73.8 μg/mL,说明柿果多酚具有一定的抗肺癌细胞增殖的生物活性。
[1]王万双,罗正荣,蔡礼鸿. 柿品种鉴定及分类研究进展[J].园艺学报,1998,25(1):44-50.
[2]李鹏,张海生,牛国霞. 柿叶单宁提取技术研究[J]. 食品工业科技,2009(9):220-222.
[3]张永卓,张艳芳,罗正荣. 部分中国原产甜柿种质果实脱涩类型的鉴定[J]. 园艺学报,2006,33(2):370-373.
[4]袁录霞,张青林,郭大勇,等. 中国甜柿及其在世界甜柿基因库中的地位[J]. 园艺学报,2011,38(2):361-370.
[5]彭吕杨. 七种水果提取物抗氧化和抑制肿瘤活性研究[D].天津:天津大学,2014.
[6]张倩倩. 柿果多酚Zn2+纯化工艺及其降血脂抑菌作用研究[D]. 杨凌:西北农林科技大学,2012.
[7]韩卫娟,李加茹,梁玉琴,等. 柿果实和叶片中可溶性单宁含量的年变化[J]. 南京林业大学学报(自然科学版),2015,39(6):61-66.
[8]吕旭聪,贾瑞博,李燕,等. 灰树花抗氧化活性多酚的提取纯化及其鉴定[J]. 中国酿造,2016,35(3):74-79.
[9]卢宇,阿荣,张园园,等. 响应面法优化藜麦多酚提取工艺的研究[J]. 食品工业科技,2016,37(12):311-315.
[10]赵晓云,赵博,邢媛媛,等. 荷叶多酚的微波辅助提取工艺优化及其抗氧化活性研究[J]. 中国酿造,2010,29(3):79-83.
[11]王华斌,王珊,傅力. 酶法提取石榴皮多酚工艺研究[J]. 中国食品学报,2012,12(6):56-65.
[12]陈亮,李医明,陈凯先,等. 植物多酚类成分提取分离研究进展[J]. 中草药,2013,44(11):1501-1507.
[13]杨谷良,龙涛,韩露,等. 甜柿果实总黄酮提取工艺的优化及其抗氧化研究[J]. 中国酿造,2016,35(5):81-85.
[14]黄雨洋,王振宇. 红松树皮多酚的提取工艺及其抗氧化活性的研究[J]. 食品工业科技,2014,35(6):171-176.
[15]贾坤,李锐,张全. 姜黄素与茶多酚联用固体脂质纳米粒的制备及抗肿瘤活性研究[J]. 食品工业科技,2016,37(12):237-242.
[16]李珍,哈益明,李安,等. 响应面优化苹果皮渣多酚超声提取工艺研究[J]. 中国农业科学,2013,46(21):4569-4577.
[17]蒋边,潘进权,李恒,等. 响应面优化超声提取杨桃多酚的工艺研究[J]. 食品工业科技,2016,37(7):248-251.
[18]伍春,徐立,刘峻池,等. 响应曲面法优化新疆药桑桑皮总多酚提取工艺[J]. 食品科学,2011,32(2):104-107.
[19]Gu H F L C M,Xu Y J,Hu W F,et al. Structural features and antioxidant activity of tannin from persimmon pulp[J]. Food Research International,2008,41(2):208-217.
