纳米孔传感技术应用于核酸检测的研究进展
2018-03-02汪荣亮谷德健刘全俊
汪荣亮,谷德健,刘全俊
(东南大学生物科学与医学工程学院,江苏 南京 210096)
1 前 言
纳米孔作为目前最有潜力的单分子DNA测序工具而备受关注。在纳米孔传感技术中,单个分子穿过一个纳米尺度的孔从而形成可以检测的离子电流变化。通过对离子电流的检测可以得知该分子的结构组成的相关信息[1],是一种非标记的快速单分子检测方法。
纳米孔主要分为3类:①生物纳米孔,主要包括金色葡萄球菌α-溶血素蛋白纳米孔(α-hemolysin, α-HL)[2]、耻垢分枝杆菌孔道蛋白A(α-Mycobacterium smegmatis porin A,MspA)[3]和噬菌体phi29连接器[4]等。其中对α-HL 纳米孔研究最早、研究最多;MspA纳米孔孔道相对更窄更短,近年来也十分热门。②固态纳米孔,是人为制造的纳米级孔道,根据材质可分为氮化硅[5]、二氧化硅[6]、氧化铝[7]、玻璃毛细管[8]、二硫化钼[9](MoS2),石墨烯[10]纳米孔等。其中氮化硅材料因其具有较低的机械应力以及优良的化学稳定性,是目前应用最广泛的固态纳米孔,而二硫化钼和石墨烯单层的厚度(单层石墨烯约0.5 nm)和DNA碱基对(B-型DNA碱基对长度0.34 nm)相当,更适合进行纳米孔测序。③复合纳米孔[11],主要是将生物纳米孔与固态纳米孔结合,集中固态纳米孔可控制备和生物纳米孔噪声小的优势。与生物纳米孔相比,固态纳米孔在化学、热学、力学稳定性上具有明显优势,并可由常规半导体加工技术制成,既可以实现纳米孔的大规模加工,又可以控制其孔径;生物纳米孔的孔道小、信噪比比较好;而复合纳米孔的制作过程比较复杂、相关研究较少。基于各类纳米孔性质不同,纳米孔分别应用在DNA测序、DNA甲基化检测,DNA-蛋白相互作用、miRNA检测等单分子检测的热门方向。
2 DNA检测
2.1 DNA测序
2.1.1 直接测序
研究者首先研究同聚物通过纳米孔形成的电流信号之间的差别,由于PolyG容易形成高级结构,因此主要以poly(A/T/C)为主。Meller[12]通过α-HL检测poly(A/T/C)100,获得易位速度约为1 nt/μs。Venta[13]使用厚度5~8 nm、直径0.8~2 nm的氮化硅纳米孔,分别检测短链同聚物poly(A/T/C)30。Cabello-Aguilar[11]将α-HL插入化学沉积修饰后的PET纳米孔得到复合纳米孔,达到对poly(A/C/U/I)100的成功区分。随后,研究者开始将同聚物中的不同位置分别换成其它核苷酸。如Bayley小组在ployC的不同部位添加A[14],并成功区分。Manrao[15]使用M1MspA检测同聚物中的一个核苷酸的改变,并成功区分。这一系列的实验结果从原理上说明使用纳米孔实现DNA测序的可能。
2.1.2 控制DNA易位速率
DNA高速通过纳米孔的特性使得高速测序成为可能,但同时这种高速度也正是很多纳米孔测序技术的弱点。因为速度太快,检测的信号质量就不高,甚至很多小的信号根本就检测不到。在120 mV的条件下,DNA会以每个碱基对约1~20 μs的速度通过α-HL素纳米孔。这就需要探测器的检测带宽达到MHz级,才能检测到皮安级的电流强度。鉴于此,对于纳米孔测序技术来说,最为重要的一点就是如何控制并减慢DNA分子通过纳米孔的速度,同时尽量消除由于纳米孔表面相互作用给DNA分子跨孔动力学上造成的波动现象。
通过改变电解质溶液pH[16]、改变电解质[17]、电极化学修饰[18],都可以降低DNA易位速率。Kim[19]在纳米孔表面修饰正电荷基团,通过静电相互作用降低易位速率。Goto[20]借鉴凝胶层析的原理在纳米孔表面和内部加入经过表面修饰的纳米硅珠,降低单链DNA的易位速率至270 μs/bp。Li小组[21]则通过改变温度、盐离子浓度、溶液粘度,使用4~8 nm直径的固态纳米孔,将DNA易位速率最低速率降低至3 bp/μs。通过分子生物学手段,在生物纳米孔中将带负电荷氨基酸残基[22]突变为正电荷,也能大大延长DNA的过孔时间。
除了直接降低DNA易位速率,有人使用光镊或磁镊[23]给DNA一个反向作用力,降低DNA易位速率。通过光镊降低DNA易位速率200倍,从30 bp/μs降低为1.5 bp/μs。Bayley小组[24]通过使用链霉素生物素固定寡核苷酸,使用改造后的α-HL的3个识别位点R1、R2、R3,对polyC链中不同位置的4种核苷酸进行分辨。
2.1.3 DNA外切酶和聚合酶介导测序
DNA酶能与DNA链结合,受酶催化反应的速度的限制,速度可达每个核苷酸几个ms级别,这将使得检测信号容易获得。Baley小组[25]首先使用DNA外切酶I切下核苷酸,随后切下的核苷酸在电压的驱动下通过α-HL纳米孔,达到区分效果,甚至包括甲基化的dCMP。虽然可以实现对核苷酸的区分,但是通过外切酶测序方法仍然需要以下改进:①控制外切酶与纳米孔的距离,使得切下来的顺序被正确的检测;②对DNA外切酶I进行优化,使其在高盐条件下正常工作;③需要控制DNA外切酶I切割速率使其酶切速率均一。
更多的研究组采用DNA聚合酶控制DNA的易位速率。Wilson[26]和Hurt[27]通过DNA聚合酶Klenow大片段(KF DNA聚合酶)与纳米孔相结合,控制DNA分子-KF DNA聚合酶到达纳米孔,加入dGTP,统计KF-DNA复合物和KF-DNA-dGTP三体来检测。实验证明在纳米孔上进行的DNA合成可重复、特异性强、保真度高。而Olasagasti[28]使用T7 DNA聚合酶、Lieberman[29]使用phi29 DNA聚合酶与α-HL相结合拖拽DNA,实时测量DNA复制过程。Cherf[30]使用phi29 DNA聚合酶和α-HL相结合,通过设计DNA序列,使得DNA序列解链并通过α-HL纳米孔,然后在phi29 DNA聚合酶拖拽下进行合成各测序一次(图1b),初始测序错误率10%~24.5%,错误的原因可能有插入和缺失。使用类似DNA序列设计,Manrao[31]使用MspA纳米孔和phi29 DNA聚合酶相结合,达到了单碱基的分辨率,如图1所示。经过优化和阵列化测试,以使用phi29 DNA聚合酶与α-HL相结合技术为基础成立的Oxford公司,成功推出以纳米孔为基础的商用化MinION测序仪[32]。但MinION 仍存有系统错误,在测试的数据中,有一些读长没有错误,而另一块区域有不少错误。尽管纳米孔测序仪的系统误差可能意味着某些区域难以获得准确的序列,但测序行业仍然看好这一平台,这主要有几个方面的原因。首先,测序界的许多研究人员期望纳米孔数据能像PacBio的数据那样演化。其次,MinION顺应了测序仪更小巧、更便宜的潮流,能进入更多的科研实验室和临床环境。这意味着实时的病原体检测、医院的病床边测序以及实时的环境监控将很快成为现实。当然,要实现真正的便携式测序,还需要克服一些挑战,比如样品制备、试剂冷藏等。
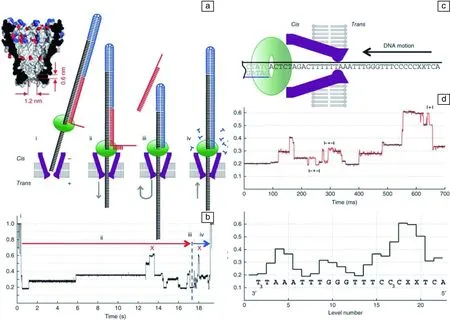
图1 在纳米孔中使用合成法进行DNA测序[31]:(a)MspA与phi29 DNA聚合酶结合,先解链通过纳米孔,再合成反向拉回通过纳米孔,(b)全过程的电流信号示意图,(c)DNA被phi29 DNA聚合酶反拉过孔的示意图,(d)电流信号与DNA序列对应Fig.1 Synthesis method used in nanopore for DNA sequencing[31]: (a) Crystal structure of M2-NNN MspA nanopore; (b) DNA passed through nanopore firstly and then went opposite direction by synthesis and the current signal of the whole process; (c) Illustration of DNA being dragged by phi29 DNAP during synthesis; (d) Typical current trace associated DNA sequence
2.2 DNA-蛋白质相互作用检测
在许多的细胞生命活动中,例如DNA复制、mRNA转录与修饰以及病毒的感染等都涉及到DNA与蛋白质之间的相互作用的问题。生物细胞中,DNA与蛋白结合紧密,调节表达活性发挥功能。而检测与DNA相互作用的蛋白质是个研究难题。
通过DNA-蛋白复合物与DNA分子通过纳米孔引起的阻塞电流的差异,Kowalczyk[33]通过分析DNA和DNA-RecA蛋白复合物通过8 nm固态纳米孔产生的信号的差别,用简单可控的检测方法进行与DNA复制、转录相关的蛋白质筛选。相关研究非常多,如Raillon[34]检测DNA与RNA聚合酶复合物,Ivankin[35]检测DNA与组蛋白的相互作用,Japrung[36]使用固态纳米孔检测SSB蛋白-DNA复合物,Squires[37]使用固态纳米孔检测可以与DNA相结合的转录因子,Yu[38]使用固态纳米孔区分锌指蛋白和DNA复合物,寻找单分子水平的DNA结合位点。Fanzio[39]将双链LNA探针共价结合到氮化硅薄膜,用以筛选NF-κB蛋白,用来检测细胞提取物里面的混合蛋白样品。
固态纳米孔孔径可控,可以用于与DNA结合的蛋白乃至DNA结合药物的筛选,也可以判断与DNA特异位点结合的蛋白质和结合位点的判断。除此之外,由于蛋白质的结构较为复杂,在正常条件下很难解折叠通过纳米孔。而寡聚核苷酸修饰后的蛋白质或多肽可以在电场驱动下由寡核苷酸引导过孔并解链蛋白[40],这也给蛋白质结构的解析提供新的研究手段。
2.3 DNA损伤检测
DNA存储着生物体赖以生存和繁衍的遗传信息,因此维护DNA分子的完整性对细胞至关重要。外界环境和生物体内部的因素都经常会导致DNA分子的损伤或改变,而且与RNA及蛋白质可以在胞内大量合成不同,一般在一个原核细胞中只有一份DNA,在真核二倍体细胞中相同的DNA也只有一对,如果DNA的损伤或遗传信息的改变不能更正,对体细胞就可能影响其功能或生存,对生殖细胞则可能影响到后代。而研究表明,核酸变异或修饰往往与癌症、衰老或疾病相关。例如脱氨基现象在DNA损伤中十分常见,将引发突变导致病变。Marshall[41]使用固态纳米孔检测DNA脱氨基化。酸性条件下,脱嘌呤碱基,导致易位速度明显变慢。
端粒末端序列常常包含TTAGGG重复序列,其中鸟嘌呤(G)的氧化产物是8-羟基鸟嘌呤(OG),是氧化损伤的生物标记。氧化损伤导致端粒序列变短,最终导致细胞衰老。Wolna[42]利用生物纳米孔检测端粒序列损伤后的包含T=T的G四联体,检测结构变化。Perera[43]利用端粒重复序列在NaCl溶液中形成G四联体,降低端粒序列通过α-HL的易位速率。而形成OG损伤的G四联体结构,无法形成G四联体。解折叠速率增快10倍,从而检测OG损伤的存在。
2.4 特异基因检测
除DNA测序外,纳米孔对特定基因的检测,原理上是通过在纳米孔内修饰与之杂交配对的探针,通过区分特异性杂交信号与非特异性信号,而达到检测效果。Balagurusamy[44]通过使用生物素连接DNA分子,与特异性DNA形成12 bp杂交区域,达到对DNA分子的杂交检测。Singer[45]使用PNA序列作为探针,检测基因组DNA内部特异序列。Tan等[46]通过化学修饰,在纳米孔内部连接特异性DNA探针分子,对电流信号进行分析,可以区分与探针杂交的DNA序列。
2.5 甲基化检测
DNA甲基化是真核细胞基因组中常见的表观遗传修饰,在调节细胞增殖、分化、个体发育等方面起重要作用,并且DNA甲基化水平异常与肿瘤的发生发展密切相关。现有的DNA甲基化检测方法主要为重亚硫酸盐测序[47]、甲基化特异性PCR[48]、甲基化荧光定量PCR法[49]和DNA微阵列法[50],然而这些处理方法往往需要大量DNA样本(源于重亚硫酸盐处理过程中DNA的降解)、大量测序成本或者PCR扩增甚至复杂探针的设计。PCR过程中又容易呈现出低的扩增效率、扩增偏性和工作量偏大等缺点。因此,一种快速而灵敏的甲基化判定方法将在临床诊断中具有重大价值。
Shim[51]使用固态纳米孔与甲基化结合蛋白(MBD)检测DNA甲基化位点。结合MBD蛋白的DNA阻塞电流相较于DNA分子增大3倍(图2 d和2e)。在进一步的工作中,他们[52]利用19 nm纳米孔区分短链(30,60,90 bp)ds DNA和甲基化结合蛋白MBP-ds DNA复合物,并通过电流增大的位置判断DNA甲基化的位点。
固态纳米孔孔径偏大,生物纳米孔对甲基化的细节信息则有着更细致的研究。Kang[53]则使用重亚硫酸盐修饰DNA,使得未甲基化的胞嘧啶C变为尿嘧啶U,而Hg2+结合到UT位置使得结构稳定。使用α-HL检测DNA,结合Hg2+的DNA过孔时间将明显延长。并以此原理,检测肿瘤抑制基因P16基因CpG岛内部的甲基化。Laszlo[54]则将合成测序的方法借鉴到甲基化碱基的检测过程当中,他们采用MspA纳米孔与phi29 DNA聚合酶相结合,测定DNA中CpG岛中的甲基化程度,其中5-甲基化胞嘧啶的准确率97%,5-羟甲基胞嘧啶的准确率97.5%(图2a~2c),首次实现了5-甲基胞嘧啶和5-羟甲基胞嘧啶的区分。Wescoe[55]则检测以XnCGY四碱基重复序列中的5种胞嘧啶:胞嘧啶、5-甲基胞嘧啶、5-羟甲基胞嘧啶、5-甲酰胞嘧啶和5-羧基胞嘧啶,准确率91.6%~98.3%。
相比于传统DNA甲基化检测方法,纳米孔具有以下优势:①可直接检测基因组DNA,无需扩增,扩增带来的误差也不存在;②基因组DNA可以在纳米孔中无限的保留,理论上可以进行多次重复测序,而重复测序可以增加准确率;③读长很长,基因组内部重复序列可以有效解决;④无需样品处理,检测成本相对较低。
2.6 重金属离子检测
重金属污染是全球化问题,吸引众多关注。环境污染方面的重金属主要是指汞、镉、铅、铬以及类金属砷等生物毒性显著的重金属元素。主要来源于自然或者人为的污染,主要包括火山喷发、煤炭发电、金矿冶炼、废弃物焚化等。如果重金属元素未经处理就直接排入河流、湖泊或海洋,继而在食物链的生物放大作用下,它们成千百倍地富集,最后进入人体,最终影响到人类。如Hg2+,是水银污染的常见形式,有神经毒性并可以导致肾脏和免疫系统的损坏。
Wen[56]设计含发夹结构的DNA探针,汞离子可以稳定T-T(胸腺嘧啶-胸腺嘧啶)错配,过孔时间将有所延长,从而与未结合的探针进行区分(图3a~3c)。探针对Hg2+选择性强,不受其他金属离子干扰,对Hg2+的检测限度达到7 nmol/L。利用相同原理,Zeng等[57]的研究中检测灵敏度低至0.5 nmol/L。Yang[58]设计G四联体探针(图3d和3e),检测Ba2+和Pb2+。与离子结合的探针的易位时间将延长,从而产生差别(图3e),据此可以测得离子的浓度,最低限可至0.8 nmol/L。目前痕量重金属离子检测主要依赖于原子吸收、原子荧光、电感耦合等离子体、质谱等实验室方法。尽管这些方法检测精度比较高,但仪器耗资昂贵、运行费用高、操作要求多,检测比较费时、费力,而且测量时需萃取、浓缩富集或抑制干扰等复杂前处理过程。而应用纳米孔检测尽管尚未达到现有检测精度,但其可重复利用及操作简单将是其持续研究的优势。
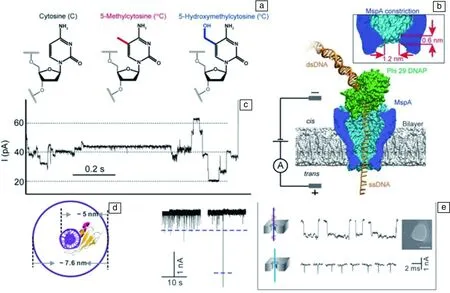
图2 纳米孔检测DNA甲基化[54]:(a)胞嘧啶、5-甲基化胞嘧啶和 5-羟甲基化胞嘧啶化学结构;(b)MspA-phi29 DNA聚合酶构成的实验装置示意图;(c)DNA通过MspA-phi29DNA聚合酶纳米孔装置生成的一段典型的易位电流信号;(d)甲基化DNA-MBD复合物俯视图;(e)比较甲基化DNA与甲基化DNA-MBD蛋白复合物通过12 nm固态纳米孔的易位信号Fig.2 DNA methylation detected by nanopore[54]: (a) Chemical structure of cytosine, 5-methylcytosine, and 5-hydroxymethylcytosine; (b) Schematic illustration of a typical MspA-phi29 DNA polymerase (DNAP) experiment; (c) A typical current trace of DNA being pulled through MspA by phi29 DNAP; (d) Top down view of methylated DNA-MBD complex; (e) Comparisons of translocation signatures for methylated DNA and methylated DNA-MBD complex through a 12 nm pore
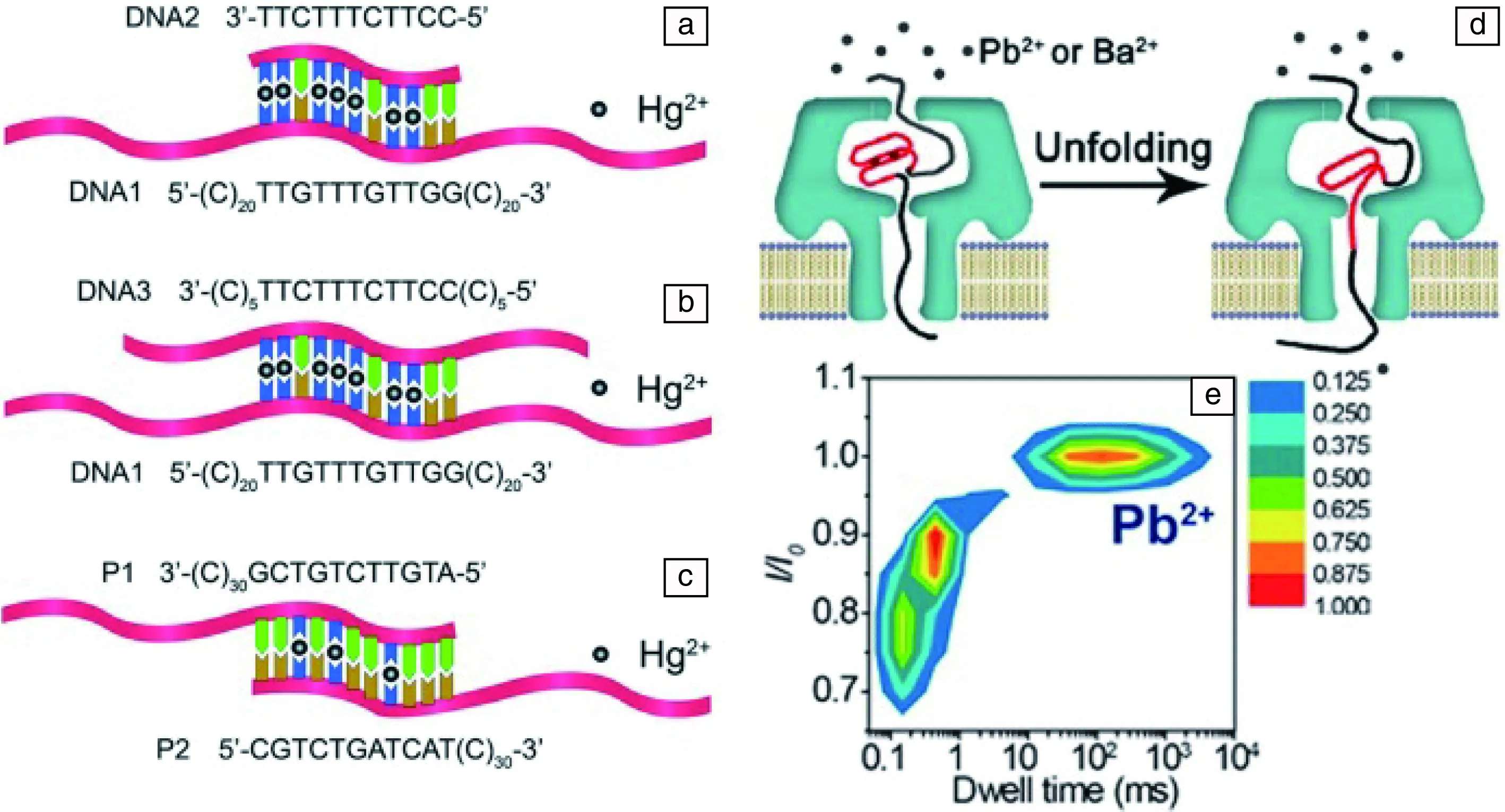
图3 设计特定DNA探针用于检测重金属离子:(a)~(c)三种不同杂交的DNA检测Hg2+ [56];(d)G四联体DNA检测Pb2+和Ba2+的原理示意图;(e)Pb2+结合的G四联体易位时间明显延长[58]Fig.3 Specific DNA probes being designed for sensing heavy metal ions: (a)~(c) Three different probes for sensing Hg2+[56]; (d)The principle of detecting Pb2+ and Ba2+ with G-quadruplex DNA; (e) Representation of the translocation time expanding of Pb2+-induced G-quadruplex through a single α-HL nanopore[58]
3 RNA检测
与DNA类似,RNA的研究也经历了核苷酸、寡聚物,到使用探针杂交检测、功能检测、结构检测的发展过程。 Bayley小组[59]将RNA分子通过生物素与链霉素固定在α-HL纳米孔内,通过突变的α-HL的R1识别位点的NNY残基成功区分rA、rC、rT碱基。Wanunu等[60]使用厚度7 nm、直径3 nm的氮化硅纳米孔分别检测25 bp的DNA、22 bp的RNA和tRNA分子。
miRNA是参与基因转录后水平调控的非编码内源性小分子RNA,研究报道,其与肿瘤的发生、转移、耐药等病理进程密切相关[61],并有望成为新的肿瘤标志物。特异性miRNA在细胞中成分复杂,浓度极低,且大小类似,针对miRNA的检测研究非常热门。使用纳米孔检测miRNA分子通常通过DNA探针分子达到对特异性miRNA的检测。Wang[62]使用α-HL的生物纳米孔,利用特异性的探针区分大小相近的miRNA分子,并通过检测6个肺癌病患的血液样本的miR-155分子,发现患者样本的miR-155分子相对于健康患者上升(图4a~4c)。Tian[63]使用肽核酸(PNA)探针从核酸混合物中检测特异性结合的miRNA分子。Zhang[64]使用不同长度的PEG修饰DNA探针,通过不同大小的阻塞电流,同时检测4种miRNA分子(图4d)。Sawafta[65]研究了丙型肝炎病毒(RNA病毒)在药物作用下的构象转变。病毒是弯曲结构,易位极其艰难,容易出现堵孔现象。而与药物结合的病毒的阻塞电流信号改变明显且变得相对较快,实验说明,该药物与RNA结合,改变了病毒的结构。据此,纳米孔可以用来检测与特定分子相互作用的药物筛选。tRNA具有二级结构甚至高级结构,而Andrew[66]通过在tRNA两端加上适配子使得tRNA在通过α-HL纳米孔时解折叠。使用phi29DNA聚合酶边合成边解折叠,同时降低tRNA分子的易位速率。通过对易位电流的解析,他们成功区分大肠杆菌中携带的甲酰甲硫酰胺(fMet)和赖氨酸(Lys)的tRNA分子。
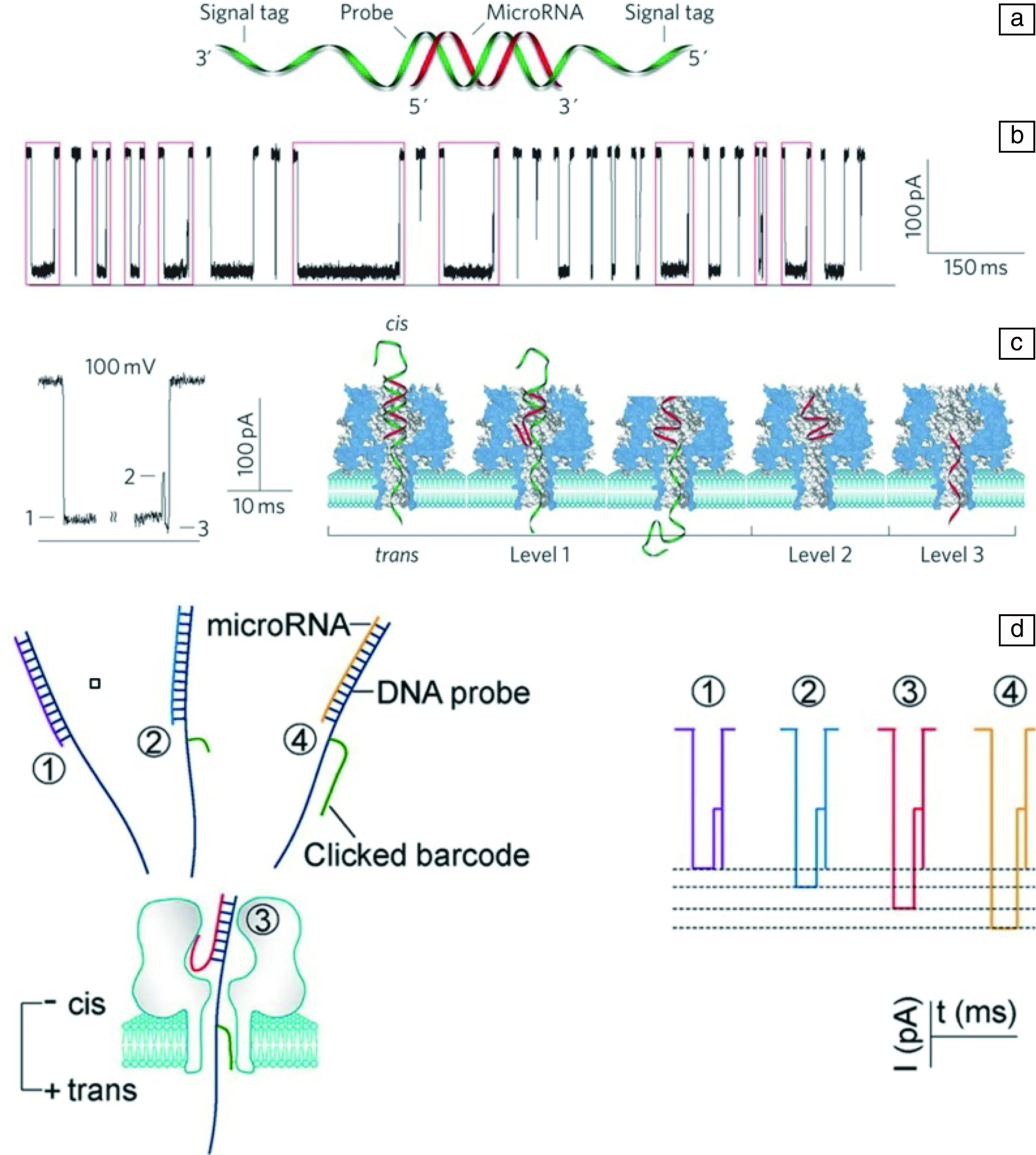
图4 使用DNA 探针检测miRNA 分子:(a)miRNA分子(红色)和DNA探针(绿色)杂交的图解;(b)100 mV偏置电压下100 nM miR-155和P155的混合物在cis池中混合后并通过纳米孔的阻塞事件的连续显示;(c)miRNA-探针复合物通过纳米孔时解链产生的多个电流水平的易位动力学过程[62];(d)使用长度不同的PEG分子作为条码检测多种miRNA分子[64]Fig.4 DNA probes being used to detect miRNA molecule: (a) Molecular diagram of a micro RNA (red) bound to a probe (green) bearing signal tags on each end; (b) Sequence of nanopore current blocks in the presence of 100 nM miR-155 and 100 nM P155 in the cis solution,100 mV; (c) Translocation dynamics of miR-155-P155 complex and Multi-level current generated by the unfolding process[62]; (d) Different PEG molecules were treated as barcodes for multiplex detection of miRNA molecule[64]
4 病毒检测
通过解析纳米孔易位事件阻塞电流信号可以得知目的分子的理化性质,如尺寸大小、形貌、结构、带电荷性质等等。纳米孔正越来越普遍地应用到表征纳米颗粒的尺寸和带电性质及多种形态的病毒分子。另外,对于柔性的生物分子来说(如DNA),其容易形成无规则的螺旋折叠结构[67]。对纳米孔测序技术来说,其中一个主要的挑战是理解DNA分子通过纳米孔的动态学过程[68],这对研究DNA测序非常重要。到目前为止,研究者对柔性生物分子通过纳米孔的复杂行为依然知之甚少。这一方面,也促使研究者寻找一种简单的一维的分子模型(如病毒)来进行纳米孔的研究。
McMullen[69]使用纳米孔分辨fd、M13病毒。Harms[70]构造了一种具有双孔的纳米孔来检测HBV病毒,相对于单孔,双孔检测信号变化不大,但检测信噪比有所提升。Darvish[71]则使用纳米孔区分出不同成熟型的HIV病毒。Yao等[72]使用α-HL纳米孔检测HBV的遗传物质DNA,其检测限度可低至10 pmd/L。Liu[73]研究fd病毒易位时与孔壁的相互作用,并将过孔事件分为3类:①直接过孔(低电压低浓度最多,主要事件)(图5a);②与孔壁相互作用后过孔(图5b);③未能过孔(图5c)。
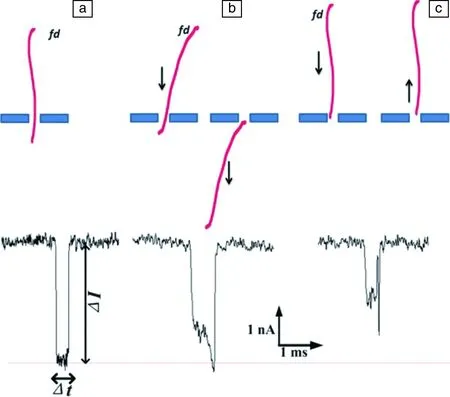
图5 fd病毒的3种典型的易位事件:(a)单个fd病毒易位行为导致的方型电流变化;(b)fd病毒先与纳米孔相互作用再易位;(c)fd病毒与纳米孔道相互作用却未能成功易位[73]Fig.5 Three typical models of translocation events of the fd virus: (a) The square-like current change of single fd virus translocation event; (b) The fd virus interacted with the nanopore before translocation; (c) The fd virus touched the mouth of the nanopore but failed to pass through[73]
5 结 语
综上所述,纳米孔传感检测技术因其快速、高效地对DNA进行非标记、无需扩增的测序潜能,将有望实现个体基因组测序成本的进一步下降,而备受关注。在核酸检测领域,纳米孔也取得长足的进步。但是要推出成功的检测仪器并扩大应用前景,仍有许多技术瓶颈需要克服。
(1)纳米孔制备技术改进
生物纳米孔不够稳定,它的稳定性仍是困扰其发展的最大瓶颈。现有的固态纳米孔制备主要通过透射电子显微镜(TEM)[74]、聚焦离子束(FIB)技术[75]。这些设备昂贵,且制备耗时长,制备费用高昂,无法批量制备,这显然不利于商业化推广。
(2)定量检测
在核酸检测领域,定量检测应用广泛。如对病毒的定量检测对临床诊断和用药十分重要,然而由于分子在纳米孔内的随机运动,纳米孔定量检测研究仍然非常少也很困难。
(3)检测分析一体化仪器构建
虽然纳米孔对分析物是实时检测,但由于热运动的存在,分子随机通过纳米孔,需要对分子过孔事件进行统计分析,进行数据处理,从样本的检测到拿到结论需要一定的时间。目前,各研究组已经开发分析软件,实现易位事件的通量处理。进一步的发展目标,将是实时定量PCR仪形成数据处理自动化,在减少人工劳力的同时,能极大提高检测通量。
References
[1] Kasianowicz J J,Brandin E, Branton D,etal.PNatlAcadSciUSA[J], 1996, 93(24): 13770-13773.
[2] Bayley H.CurrentOpinioninChemicalBiology[J], 2006, 10(6): 628-637.
[3] Butler T Z, Pavlenok M, DerringtonI M,etal.ProceedingsoftheNationalAcademyofSciencesoftheUnitedStatesofAmerica[C]. 2008, 105(52): 20647-20652.
[4] Wang S, Haque F, Rychahou P G,etal.ACSNano[J], 2013, 7(11): 9814-9822
[5] Dekker C.NatureNanotechnology[J], 2007, 2(4):209-215.
[6] Storm A J, Chen J H, Ling X S,etal.NatureMaterials[J], 2003, 2(8):537-540
[7] Venkatesan B M, Shah A B, Zuo J M,etal.AdvancedFunctionalMaterials[J], 2010, 20(8): 1266-1275.
[8] Gong X Q, Patil A V, Ivanov A P,etal.AnalyticalChemistry[J], 2014, 86(1): 835-841.
[9] Farimani A B, Min K, Aluru N R.ACSNano[J], 2014, 8(8): 7914.
[10] Banerjee S, Wilson J, Shim J,etal.AdvancedFunctionalMaterials[J], 2015, 25(6): 936-946.
[11] Cabello-Aguilar S, Balme S, Chaaya A A,etal.Nanoscale[J], 2013, 5(20): 9582-9586.
[12] Meller A, Nivon L, Brandin E,etal.ProceedingsoftheNationalAcademyofSciencesoftheUnitedStatesofAmerica[C]. 2000, 97(3): 1079-1084.
[13] Venta K, Shemer G, Puster M,etal.ACSNano[J], 2013, 7(5): 4629-4936.
[14] Ashkenasy N, Sanchez-Quesada J, Bayley H,etal.AngewandteChemieInternationalEdition[J], 2005, 44(9): 1401-1404.
[15] Manrao E A, Derrington I M, Pavlenok M,etal.PlosOne[J], 2011, 6(10).
[16] Fologea D, Gershow M, Ledden B,etal.NanoLetters[J], 2005, 5(10): 1905-1909.
[17] Kowalczyk S W, Wells D B, Aksimentiev A,etal.NanoLetters[J], 2012, 12(2):1038-1044.
[18] Krishnakumar P, Gyarfas B, Song W S,etal.ACSNano[J], 2013, 7(11): 10319-10326.
[19] Kim Y R, Min J, Lee I H,etal.Biosensors&Bioelectronics[J], 2007, 22(12): 2926-2931.
[20] Goto Y, Haga T,Yanagi I,etal.ScientificReports[J], 2015, 5: 16640.
[21] Fologea D, Uplinger J, Thomas B,etal.NanoLetters[J], 2005, 5(9): 1734-1737.
[22] Liu A, Zhao Q, Krishantha D M,etal.TheJournalofPhysicalChemistryLetters[J], 2011, 2(12): 1372-1376.
[23] Peng H B, Ling X S S.Nanotechnology[J], 2009, 20(18):7978-7984
[24] Stoddart D, Heron A J, Mikhailova E,etal.ProceedingsoftheNationalAcademyofSciencesoftheUnitedStatesofAmerica[C]. 2009, 106(19): 7702-7707.
[25] Clarke J, Wu H C, Jayasinghe L,etal.NatureNanotechnology[J], 2009, 4(4): 265-270.
[26] Wilson N A, Abu-Shumays R, Gyarfas B,etal.ACSNano[J], 2009, 3(4): 995-1003.
[27] Hurt N, Wang H Y, Akeson M,etal.JournaloftheAmericanChemicalSociety[J], 2009, 131(10):3772-3778
[28] Olasagasti F, Lieberman K R, Benner S,etal.NatureNanotechnology[J], 2010, 5(11):798-806.
[29] Lieberman K R, Cherf G M, Doody M J,etal.JournaloftheAmericanChemicalSociety[J], 2010, 132(50):17961-17972.
[30] Cherf G M, Lieberman K R, Rashid H,etal.NatureBiotechnology[J], 2012, 30(4): 344-348.
[31] Manrao E A, Derrington I M, Laszlo A H,etal.NatureBiotechnology[J], 2012, 30(4): 349-U174.
[32] Hargreaves A D, Mulley J F.PeerJ[J], 2015, 3: e1441.
[33] Kowalczyk S W, Hall A R, Dekker C.NanoLetters[J], 2010, 10(1):324-328.
[34] Raillon C, Cousin P, Traversi F,etal.NanoLetters[J], 2012, 12(3): 1157-1164.
[35] Ivankin A, Carson S, Kinney S R,etal.JournaloftheAmericanChemicalSociety[J], 2013, 135(41):15350-15352.
[36] Japrung D, Bahrami A, Nadzeyka A,etal.JournalofPhysicalChemistryB[J], 2014, 118(40): 11605-11612.
[37] Squires A, Atas E, Meller A.ScientificReports[J], 2015, 5: 11643.
[38] Yu J S, Lim M C, Huynh D T,etal.ACSNano[J], 2015, 9(5): 5289-5298.
[39] Fanzio P, Mussi V, Menotta M,etal.Biosensors&Bioelectronics[J], 2015, 64: 219-226.
[40] Biswas S, Song W, Borges C,etal.ACSNano[J], 2015, 9(10): 9652-9664.
[41] Marshall M M, Ruzicka J A, Taylor E W,etal.PlosOne[J], 2014, 9(7):e101632.
[42] Wolna A H, Fleming A M, Burrows C J.Biochemistry[J], 2014, 53(48): 7484-7493.
[43] Perera R T, Fleming A M, Johnson R P,etal.Nanotechnology[J], 2015,26(7):074002
[44] Balagurusamy V S, Weinger P, Ling X S.Nanotechnology[J], 2010,21(33): 335102.
[45] Singer A, Wanunu M, Morrison W,etal.BiophysicalJournal[J], 2010, 98(3): 598a-599a.
[46] Tan S, Wang L,Yu J ,etal.NanoscaleResearchLetters[J], 2015, 10: 205.
[47] Murrell A, Rakyan V K, Beck S.HumMolGenet[J], 2005, 14: R3-R10.
[48] Trinh B N, Long T I, Laird P W.Methods[J], 2001, 25(4):456-462.
[49] Eads C A, Danenberg K D, Kawakami K,etal.NucleicAcidsResearch[J], 2000, 28(8):E32.
[50] Sandoval J, Heyn H, Moran S,etal.Epigenetics[J], 2011, 6(6):692-702.
[51] Shim J, Humphreys G I, Venkatesan B M,etal.ScientificReports[J], 2013, 3:4422-4427
[52] Shim J, Kim Y, Humphreys G I,etal.ACSNano[J], 2015, 9(1): 290-300.
[53] Kang I, Wang Y, Reagan C,etal.ScientificReports[J], 2013, 3: 2381.
[54] Laszlo A H, Derrington I M, Brinkerhoff H,etal.ProceedingsoftheNationalAcademyofSciencesoftheUnitedStatesofAmerica[C]. 2013, 110(47):18904-18909.
[55] Wescoe Z L, Schreiber J, Akeson M.JournaloftheAmericanChemicalSociety[J], 2014, 136(47):16582-16587.
[56] Wen S, Zeng T, Liu L,etal.JournaloftheAmericanChemicalSociety[J], 2011, 133(45):18312-18317.
[57] Zeng T, Li T, Li Y,etal.Nanoscale[J], 2014, 6(15):8579-8584.
[58] Yang C, Liu L, Zeng T,etal.AnalyticalChemistry[J], 2013, 85(15):7302-7307.
[59] Ayub M, Bayley H.NanoLetters[J], 2012, 12(11): 5637-5643.
[60] Wanunu M, Dadosh T, Ray V,etal.NatureNanotechnology[J], 2010, 5(11): 807-814.
[61] Lu J, Getz G, Miska E A,etal.Nature[J], 2005, 435(7043):834-838.
[62] Wang Y, Zheng D, Tan Q,etal.NatureNanotechnology[J], 2011, 6(10):668-674.
[63] Tian K, He Z, Wang Y,etal.ACSNano[J], 2013, 7(5): 3962-3969.
[64] Zhang X, Wang Y, Fricke B L,etal.ACSNano[J], 2014, 8(4):3444-3450.
[65] Sawafta F, Clancy B, Carlsen A T,etal.Nanoscale[J], 2014, 6(12): 6991-6996.
[66] Andrew M S, Robin A S, Mark A,etal.FrontiersinBioengineeringandBiotechnology[J], 2015, 3:91.
[67] Mihovilovic M, Hagerty N, Stein D.PhysicalReviewLetters[J], 2013, 110(2):028102.
[68] Plesa C,van Loo N, Ketterer P,etal.NanoLetters[J], 2015, 15(1):732-737.
[69] McMullen A, LMcMulleniu X, Tang J,etal.PIeeeLesEastm[J], 2012(4):1-2.
[70] Harms Z D, Mogensen K B, Nunes P S,etal.AnalyticalChemistry[J], 2011, 83(24): 9573-9578.
[71] Darvish A, Goyal G, Kim M.AdvancesinGlobalHealththroughSensingTechnologies2015[C]. 2015, 9490.
[72] Yao F, Zhang Y, Wei Y,etal.ChemicalCommunicaiton(Cambridge) [J], 2014, 50(89):13853-13856.
[73] Liu L P, Wu H W, Kong J L,etal.ScienceofAdvancedMatertials[J], 2013, 5(12): 2039-2047.
[74] Wu M Y, Chen P, Ziese U,etal.Micron[J], 2010, 41(6):609-614.
[75] Das K, Freund J B, Johnson H T.Nanotechnology[J], 2014, 25(3): 035303.
