离子交换凝胶Capto-DEAE替代DEAESepharose纯化乙脑病毒抗原研究
2018-03-01胡雪芹
胡雪芹
(珠海市丽珠单抗生物技术有限公司,广东珠海 513000)
1 材料方法
1.1 分子筛层析原液制备
乙型脑炎病毒感染Vero细胞后收获的病毒液[1],用Millipore公司生产滤膜截留分子300 kD,超滤浓缩20倍左右,用β-丙内酯1∶4 000灭活,然后经过硫酸鱼精蛋白沉淀[2],再经过S-300凝胶过滤,收集第一峰得分子筛柱层析原液[3]。
1.2 层析工艺参数
两种层析凝胶的参数见表1。

表1 层析工艺参数
1.3 检测指标
蛋白含量、抗原含量、牛血清残留、vero细胞宿主蛋白及DNA残留、效力等检定均按2010版药典规定测定[4]。
1.4 疫苗半成品的制备
用20120303、20120304、20120401三批灭活水解液,经过硫酸鱼精蛋白沉淀,再经过凝胶过滤S-300纯化收集第一峰获得柱层析原液。分别经过DEAE Sepharose FF和Capto DEAE凝胶纯化,纯化后病毒经除菌过滤得疫苗原液,加入保护剂和铝佐剂,分别配制成半成品。
2 实验结果
2.1 离子交换层析
含有乙型脑炎病毒抗原的分子筛柱层析原液,分别上样吸附在DEAE Sepharose FF和Capto DEAE离子交换层析柱上,使用含NaCl的缓冲液线性洗脱,在280 nm紫外检测下,出现三个吸收峰,经ELISA法证实第一峰为乙型脑炎病毒抗原峰,第二、三峰为无抗原活性或比活差的杂蛋白峰,如图1和图2所示。
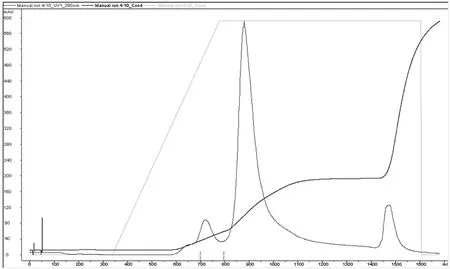
图1 乙型脑炎Capto DEAE离子交换层析图谱

图2 乙型脑炎DEAESepharose FF离子交换层析图谱
2.2 纯化图谱比较
从DEAE Sepharose FF凝胶纯化图谱来看,很难根据峰形收集目标抗原。Capto DEAE凝胶纯化图谱分离度好,可以根据峰形可将杂蛋白和目标抗原更好地分离,操作简单方便。
2.3 离子交换纯化前后抗原和杂质的检定数据比较
表2至表5为Capto DEAE和DEAE Sepharose FF三批纯化后原液的检测结果,Capto DEAE纯化后原液残留的牛血清白蛋白蛋白和宿主蛋白都比DEAE Sepharose FF凝胶纯化后原液低。从表2DNA残留纯化结果可以看出,两种凝胶对Vero细胞DNA的去除相同。从表1抗原EIA比活数据,Capto DEAE纯化后原液的比活比DEAE Sepharose FF高。Capto DEAE吸附载量高,流速快,工作效率高,并且收集液的抗原回收率高。
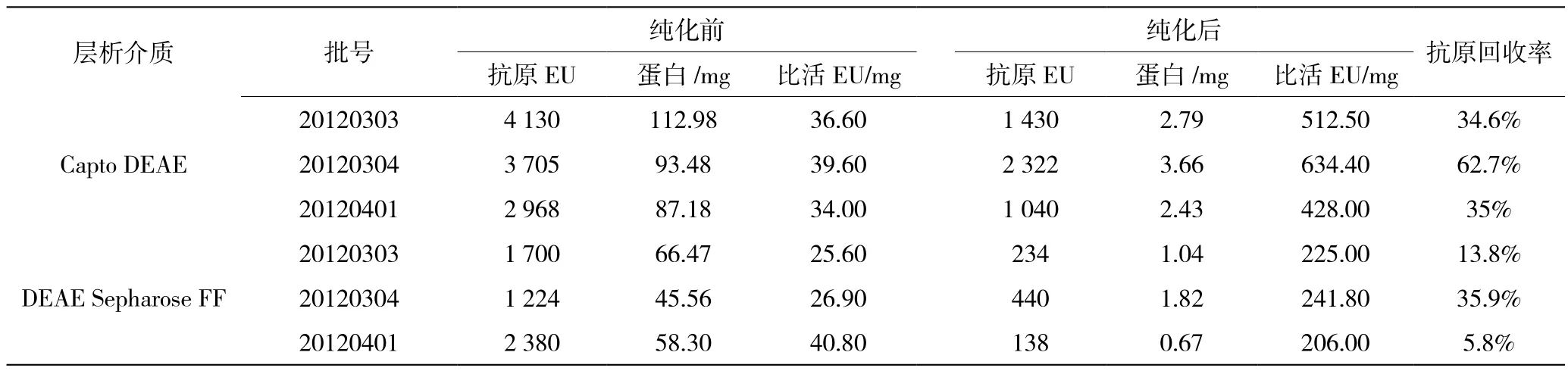
表2 抗原纯化结果比较

表3 DNA残留纯化结果比较
3 结论
用离子交换凝胶Capto-DEAE替代DEAESepharose纯化乙脑病毒抗原是可行性的。从DEAE Sepharose FF凝胶纯化图谱来看,很难根据峰形收集目标抗原。Capto DEAE凝胶纯化图谱分离度好,可以根据峰形可将杂蛋白和目标抗原更好地分离,操作简单方便。
Capto DEAE纯化后原液残留的牛血清白蛋白蛋白和宿主蛋白都比DEAE Sepharose FF凝胶纯化后原液低。Capto DEAE纯化后原液的比活比DEAE Sepharose FF高。Capto DEAE吸附载量高,流速快,工作效率高,并且收集液的抗原回收率高。不仅产品质量更好,而且生产效率也得到了提高。
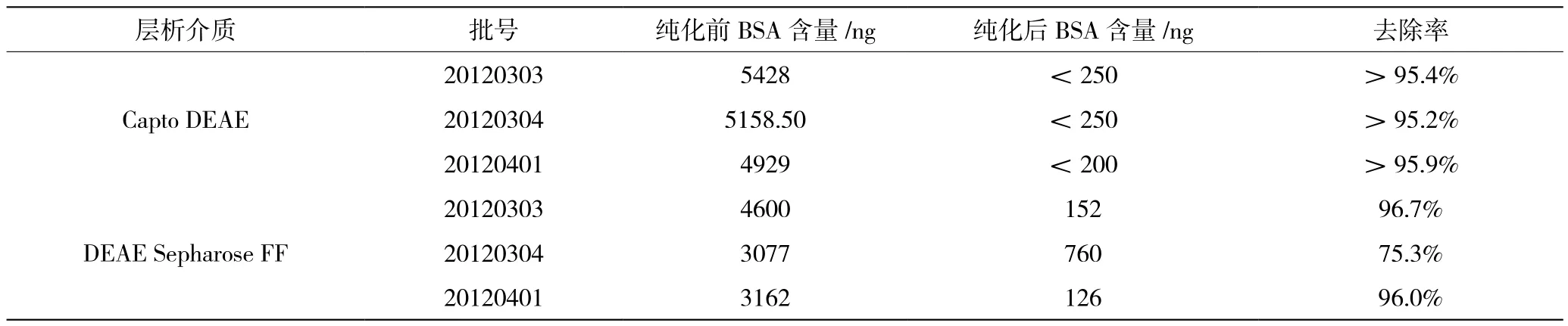
表4 牛血清白蛋白残留纯化结果比较

表5 宿主蛋白残留纯化结果比较
[1]王辉,过琴媛,张月兰,等.Vero细胞乙型脑炎纯化疫苗生产工艺参数的研究[J].微生物免疫学进展,2006,34(3):15-17.
[2]韩德胜,李振平,李薇,等.硫酸鱼精蛋白去除Vero细胞乙脑疫苗残余DNA方法的条件优化[J].微生物学免疫学进展,2007,35(4):14-18.
[3]鲁宏,窦志勇.人用精制Vero细胞狂犬病疫苗纯化方法选择[J].微生物学免疫学进展,2000,28(4):5-7.
