人肿瘤抑制因子folliculin的N端结构原核表达纯化
2018-03-01皮业勤吴哲俊申一凡陈婷陆昌瑞张云龙
皮业勤,吴哲俊,申一凡,陈婷,陆昌瑞,张云龙
(东华大学 生物科学与技术研究所,上海 201620)
Birt-Hogg-Dube´(BHD)综合征是一种常染色体显性遗传性疾病,1970年由Birt、Hogg和Dube三位加拿大医生发现,临床表现主要包括良性毛囊瘤、肾囊肿和肾肿瘤等[1-3]。直至2001年,对大量BHD综合征患者遗传连锁分析才发现其致病与BHD基因(又称FLCN基因)缺失或突变相关[4]。Nickerson,M.L.等探查了BHD综合征患者的嫌色细胞肾癌与FLCN二次突变相关,暗示了FLCN是一个肿瘤抑制基因[5];随后对裸鼠皮下注射FLCN缺陷细胞株长出肿瘤和注射转染野生型FLCN后显著降低肿瘤发生率对比,证明了FLCN的肿瘤抑制功能[6-7]。这些研究确定了FLCN是一种肿瘤抑制因子,但其与BHD综合征的致病关联尚未明确。
FLCN基因位于常染色体17p11.2,编码579个氨基酸的64kDa蛋白[8]。BLAST氨基酸序列比对发现,FLCN与现已知蛋白都没有显著同源性[9],但其在单细胞生物(酵母)到哺乳动物(咧齿类动物、犬类和人类)具有高度保守性[10],表明FLCN是一种关键的细胞调控因子。目前,FLCN的结构与功能研究仍处于模糊阶段。2012年,Nookala R.K.等利用X射线衍射技术解析了FLCN C端341-566氨基酸区段(FLCN-CT)三维结构,经结构比对发现其与DENN1B的DENN结构域相似,推测FLCN-CT具有鸟苷酸交换因子(GEF)功能[11],但这并不能解释FLCN突变或缺失导致BHD综合征的致病机理。笔者对FLCN二级结构预测发现,其1-360aa.区段多为无序结构,无序区域由于构象多变而发挥重要的生物学功能[12]。FLCN基因进化分析发现它是一个进化上非常保守的基因,特别是100-230aa.这段序列[11],说明FLCN的N端具有很重要的功能。
笔者使用的载体ppSUMO是pET28a改造而来的,表达的SUMO蛋白有助融合蛋白的高表达和溶解性[13]。在成功构建ppSUMO-N362重组质粒后,经表达纯化N362融合蛋白后切去标签,可获得纯度80%的N362蛋白。生物信息学分析发现N端多无序区域且保守区域100-230aa.有强疏水性,极易形成疏水性片段,推测其可能作为FLCN形成聚合体或转运结合的区域。总之,这些研究将为进一步FLCN结构与功能研究奠定了基础。
1 材料与方法
1.1 材料
质粒ppSUMO、pET28a-FLCN由本实验室保存,E.coli DH5α、E.coli BL21购自生工生物工程(上海)股份有限公司;Phusion DNA聚合酶和ULP1酶、质粒小量提取试剂盒购自Thermo Scientific公司,限制性内切酶 BamHI、XhoI和T4连接酶购自NEB公司;HRP-labeled 6×His 单抗购自Proteintech公司;Ni-NTA Agarose和琼脂糖凝胶DNA回收试剂盒购自QIAGEN公司,HiTrap Q FF 1mL强阴离子预装柱购自美国GE公司,超滤管购自MERCK公司,其他无机盐试剂均为国产分析纯。高压细胞破碎仪JNBIOJN-3000,蛋白纯化层析仪SCG p100。
1.2 FLCN的二级结构预测
在psipred网站(http://bioinf.cs.ucl.ac.uk/psipred)上输入人源FLCN的氨基酸序列可得到FLCN二级结构无序性的预测,它是基于DISOPRED3版本的预测结果。在expasy网站(https://web.expasy.org/protscale/)上输入人源FLCN的氨基酸序列可得到其氨基酸亲疏水性的预测结果。
1.3 ppSUMO-N362重组质粒的构建
以pET28a-FLCN为PCR模板设计引物,N362 F:5'- ATACAT GGATCC AAT GCC ATT GTT GCC CTG TGTC -3',N362 R:5'- ATACAT CTCGAG TTA ACG AAA ACT CGG TGC GC -3'(划线部分为酶切位点)。用常规PCR程序进行扩增。对载体和PCR产物进行5'BamH I和3'XhoI双酶切,切胶回收后用T4连接酶16℃连接过夜;连接产物转化至E.coil DH5α感受态细胞,摇菌抽提质粒电泳检测,条带正确的送生工测序鉴定。
1.4 N362融合蛋白表达并亲和纯化
将测序正确的重组质粒转化至E.coli BL21感受态细胞中,涂布平板后挑取单克隆过夜培养。次日将菌液加到1L的TB培养基中37℃ 225r/min培养至OD6000.6左右,加入终浓度0.1mmol/LIPTG诱导剂16℃过夜表达。
对表达好的菌液进行3500r/min 4℃离心30 min,弃上清后在冰上加入20mL bind buffer(25mmol/LNa2HPO4pH 8.0,500 mmol/L NaCl,10mmol/L咪唑)重悬菌沉,加入终浓度1mmol/LDMSF蛋白酶抑制剂,用高压细胞破碎机在4~6℃下1×105~1.5×105kPa破碎细胞两三次后,12 000 r/min 4℃离心1h。将上清加入预先用Bind Buffer(25 mmol/LNa2HPO4pH8.0,500 mmol/L NaCl,10 mmol/L咪唑)处理的Ni-NTA亲和层析柱中,重复结合两次后,加入大量的Wash buffer(25 mmol/LNa2HPO4pH8.0,500 mmol/LNaCl,20 mmol/L咪唑)洗涤,杂蛋白洗去后用Elute buffer(25 mmol/L Na2HPO4pH 8.0,500 mmol/L NaCl,250 mmol/L咪唑)洗脱目的蛋白;将洗脱液用30 kD超滤管浓缩保存。各组分用12%SDS-PAGE和Western blot进行检测。
1.5 N362融合蛋白离子交换纯化
N362融合蛋白的预测等电点是5.7,选用GE的HiTrap Q FF 1mL强阴离子预装柱,用SCGp100蛋白纯化层析系统来进行纯化。先用5CV BufferB(20 mmol/L磷酸盐缓冲液pH8.0,500 mmol/L NaCl)清洗柱子后,再用10CV Buffer A(20 mmol/L磷酸盐缓冲液pH8.0)平衡柱子,设置程序:用Buffer A和 Buffer B设置从0到500 mmol/L NaCl盐浓度梯度,共收集45mL,设置流速1mL/min,警报压力0.3 MPa,每管收集1mL。进样后开始程序,收集洗脱峰流出的样,用12% SDS-PAGE跑胶鉴定后将纯度高的目的蛋白用30kD超滤浓缩管浓缩保存。
1.6 用ULP1酶对融合蛋白酶切
将纯化好的融合蛋白和1 μLULP1酶加入到bufferA(50 mmol/LTris-HCl,pH 8.0,1 mmol/LDTT)定容至5mL,4℃条件下静止酶切过夜。将酶切好的蛋白溶液转移到平衡好的Ni-NTA亲和层析柱中,二次过柱收集穿出液。将穿出液用10kD超滤浓缩管浓缩保存。
2 结果与讨论
2.1 FLCN二级结构预测显示N端多无序区域
在psipred网站(http://bioinf.cs.ucl.ac.uk/psipred)上预测得到人源FLCN二级结构的无序区域如图1a所示,其中横坐标表示FLCN一级结构氨基酸的排列顺序,纵坐标表示蛋白无序性的可信度打分,可信度高于0.5即当蓝线高于灰色虚线时,对应的氨基酸被认为是无序的;橙色线显示无序蛋白质结合残基预测的可信度。从图中可以看到,FLCN的无序区段主要是在1-360 aa.即研究的N端,并且打分很高即可信度很高,具有很高的研究价值。
在expasy网站(https://web.expasy.org/protscale/)上预测人源FLCN的氨基酸亲疏水性的结果如图1b所示,其中横坐标表示FLCN一级结构氨基酸的排列顺序,纵坐标表示蛋白亲疏水性的可信度打分,正值表示疏水,负值表示亲水;可以看到FLCN的N端保守性区域100-230 aa.主要是正值且打分很好,说明有强疏水性即极易形成疏水性片段,推测可能作为FLCN形成聚合体或转运结合的区域。

图1 FLCN二级结构预测
2.2 ppSUMO-N362重组质粒构建
将扩增后的N362片段插入ppSUMO载体构建重组质粒ppSUMO-N362,将构建好的质粒与ppSUMO载体进行电泳,检查的结果如图2所示,测序结果显示构建成功且无突变。
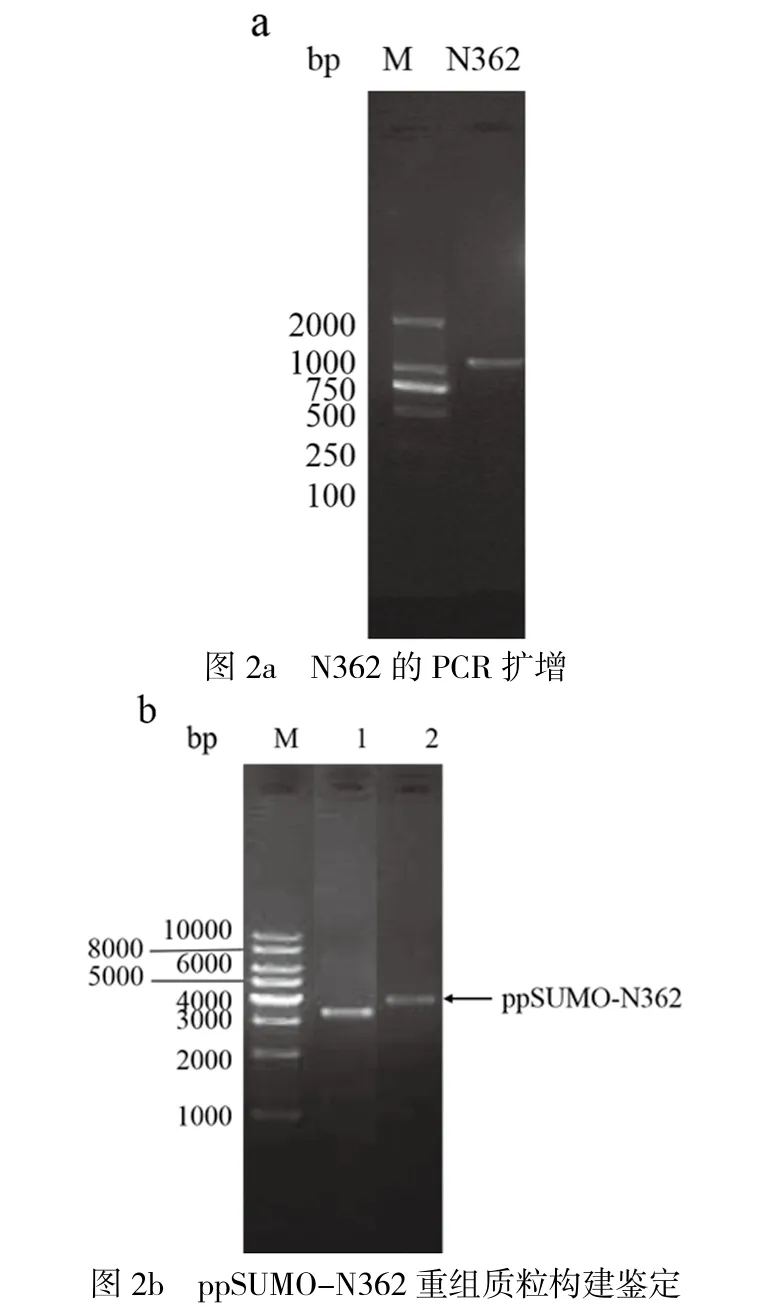
图2 ppSUMO-N362的克隆鉴定
2.3 (His)6-SUMO-N362融合蛋白镍柱亲和纯化
对表达菌进行诱导培养可以获得大量融合蛋白,经高压破碎细胞后融合蛋白大部分可融,经镍柱纯化时用大量的Wash Buffer漂洗后能将大部分杂蛋白洗去,洗脱的目的蛋白纯度可高达70%;Western Blot检查显示重组蛋白成功表达并且很少降解(图3上侧)。
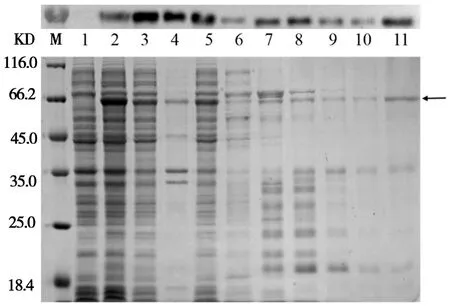
图3 (His)6-SUMO-N362融合蛋白表达纯化
2.4 (His)6-SUMO-N362融合蛋白离子交换后酶切
经镍亲和纯化后的融合蛋白纯度不是很高,所以尝试用HiTrap Q FF 1mL强阴离子预装柱来纯化融合蛋白,如图4所示,当升高洗脱液的盐浓度至300mmol/L NaCl时开始出峰,收集出峰处的洗脱液进行浓缩保存。用ULP1酶对浓缩蛋白低温过夜酶切,可以将绝大部分的重组蛋白切开,二次过柱后穿出的浓缩样纯度可达到80%(如图4)。

图4 (His)6-SUMO-N362融合蛋白的分子筛纯化
3 结论
本实验利用pET28a改造而来的ppSUMO载体来构建ppSUMO-N362重组质粒,融合蛋白的表达量和可溶性都很高,经镍柱一步纯化后获得纯度高达70%,使用强阴离子Q柱进行纯化的效果没有很好,接下来用ULP1酶切,可以将绝大部分的重组蛋白切开,二次过柱后穿出的浓缩样纯度达到80%,目前对于FLCN及其N端蛋白的结构还没有具体研究报道,纯化的FLCN N端片段为后期结构研究提供基础。
[1]Scalvenzi M,Argenziano G,Sammarco E,et al.Hereditary Multiple Fibrofolliculomas,Trichodiscomas and Acrochordons: Syndrome of Birt-Hogg-Dube [J].Journal of the European Academy of Dermatology and Venereology : JEADV,1998,11(1):45-47.
[2]Birt A R,Hogg G R,Dube W J.Hereditary Multiple Fibrofolliculomas with Trichodiscomas and Acrochordons[J].Archives of dermatolo gy,1977,113(12):1674-1677.
[3]Toro J R,Glenn G,Duray P,et al.Birt-Hogg-Dube Syndrome:a Novel Marker of Kidney Neoplasia [J].Archives of dermatolo gy,1999,135(10):1195-1202.
[4]Khoo S K,Bradley M,Wong F K,et al.Birt-Hogg-Dube Syndrome:Mapping of a Novel Hereditary Neoplasia Gene to Chromosome 17p12-q11.2 [J].Oncogene,2001,20(37):5239-5242.
[5]Nickerson M L,Warren M B,Toro J R,et al.Mutations in a novel gene lead to kidney tumors,lung wall defects,and benign tumors of the hair follicle in patients with the Birt-Hogg-Dube syndrome[J].Cancer Cell,2002,2(2):157-164.
[6]Yang Y,Padilla-Nash H M,Vira M A,et al.The UOK 257 Cell Line: a Novel Model for Studies of the Human Birt-Hogg-Dube Gene Pathway[J].Cancer Genet Cytogen,2008,180(2):100-109.
[7]Hudon V,Sabourin S,Dydensborg A B,et al.Renal Tumour Suppressor Function of the Birt-Hogg-Dube Syndrome Gene Product folliculin[J].J Med Genet,2010,47(3):182-189.
[8]Schmidt L S,Nickerson M L,Warren M B,et al.Germline BHDMutation Spectrum and Phenotype Analysis of a Large Cohort of Families with Birt-Hogg-Dube syndrome[J].American Journal of Human Genetics,2005,76(6):1023-1033.
[9]Vocke C D,Yang Y,Pavlovich C P,et al.High Frequency of Somatic Frameshift BHD Gene Mutations in Birt-Hogg-Dubeassociated Renal Tumors[J].Journal of the National Cancer Institute,2005,97(12):931-935.
[10]Singh S R,Zhen W,Zheng Z,et al.The Drosophila Homolog of the Human Tumor Suppressor Gene BHD Interacts with the JAK-STAT and Dpp Signaling Pathways in Regulating Male Germline Stem Cell Maintenance [J].Oncogene,2006,25(44):5933-5941.
[11]Nookala R K,Langemeyer L,Pacitto A,et al.Crystal Structure of Folliculin Reveals a hidDENN Function in Genetically Inherited Renal cancer [J].Open Biol,2012,2(8):120071.
[12]Babu M M.Intrinsically disordered proteins [J].Molecular bioSystems,2012,8(1): 21.
[13]Marblestone J G,Edavettal S C,Lim Y,et al.Comparison of SUMO Fusion Technology with Traditional Gene Fusion Systems:Enhanced Expression and Solubility with SUMO [J].Protein science:a publication of the Protein Society,2006,15(1):182-189.
