细胞DNA倍体分析法在良恶性胸腹水鉴别中的应用价值
2018-03-01刘海军梅金红王惟佳
刘海军,梅金红,王惟佳,徐 姗
(南昌大学第一附属医院病理科,南昌 330006)
目前,胸腹水的诊断大多依靠常规脱落细胞学分析法,部分医院同时使用染色体分析法,但这两种方法均需要花费医生大量的时间观察诊断,而且对诊断医生的诊断能力及经验水平要求比较高。有文献报道胸水中通过细胞学诊断法癌细胞检出率仅有50%左右[1],恶性腹水癌细胞检出率也只有40%[2],而在基层医院,由于细胞检验医生的经验不足或缺乏,其检出率可能进一步的降低或误诊率增高,而染色体分析法因为对检测医生的高要求,一般只在三级甲等医院有此检查项目,基层医院很难开展。近年来,随着新技术细胞DNA倍体分析法的开展,现已在较多的细胞领域发挥着一定作用,特别是DNA倍体分析对于宫颈癌及其癌前病变的早期诊断及筛查,诊断符合率高,取材方便,检查简单无创,是一种较为简便的普查方法[3]。本实验通过DNA倍体分析、常规脱落细胞学分析法、染色体分析法的对比,探讨其在胸腹水良恶性诊断中的价值。
1 材料与方法
1实验对象及材料
1.1 研究对象 选择南昌大学第一附属医院2015年7月-2015年12月期间送检胸腹水标本274例。其中女120例,男154例,最大者92岁,最小者13岁,平均年龄57.3岁。
1.2 实验试剂 细胞DNA染色试剂 (福建MOTIC公司提供)。巴氏染色液套装(南昌雨露实实验器材有限公司)。瑞氏染液(自配:取1g瑞氏染料放置乳钵内,用乳棒磨至细粉末,加少许甲醇溶解再充分研磨,之后再加较多量甲醇研磨,静置片刻,将上层液体倒入甲醇空瓶,再加甲醇研磨,重复数次,直至乳钵内染料用完为止,之后加甲醇至500ml,摇匀,密封瓶口,存室温暗处储存3个月以上)。姬姆萨染液(自配:以1克的姬姆色素染料放入碾钵中,用乳棒磨至细粉末后加入10ml甘油,继续研磨混匀,之后移入烧杯中,另加甘油至60ml充分混匀,56℃水浴溶解两小时,再加入60ml甲醇混匀,即配成姬姆色素原液,此原液用前用PBS(PH7.2)稀释十倍左右就可以使用,就为姬姆萨工作液。工作液可保存1个月左右)KCL,冰醋酸,甲醇,乙醇,二甲苯等。
1.3 实验方法
1.3.1 标本的预处理 取胸腹水100ml经3200R/Min离心10min,去上清液取细胞沉淀,如细胞沉淀不能满足诊断,继续重复此步骤。之后细胞沉淀分成两份,一份做常规脱落细胞学及染色体检查,一份放入胸腹水DNA保存液中2h以上,做DNA倍体分析。
1.3.2 脱落细胞学分析法 制片:取细胞沉淀推片4张,自然凉干,一张固定于95%乙醇中15min以上,之后做巴氏染色,另3张做瑞氏-姬姆萨染色。染色:
1.3.2.1 巴氏染色操作流程 95%乙醇固定(15min)→清水冲洗多次→苏木素染液 (3-5min)→清水冲洗三次→蓝化→95%乙醇漂洗→橙黄染液 (1-10s)→95%乙醇漂洗→95%乙醇漂洗→100%乙醇漂洗→EA50(3-5m)→95%乙醇漂洗→95%乙醇漂洗→无水乙醇漂洗→无水乙醇 (2min)→二甲苯(2min)→中性树胶封片。
1.3.2.2 瑞-姬染色流程玻片在瑞氏染液浸染(1min)→直接转移到37℃姬姆萨工作液中浸染(15-25 min)→自来水冲洗→室温凉干→镜检。脱落细胞学分析法阅片:全部染色体片均由两名副主任以上医师阅片、判读。
1.3.3 染色体分析方法 制片:取10ml 0.075mol/L KCL低渗液于细胞沉淀中,混匀,37℃水浴(20min)→加固定液 (冰乙酸 3:1)2ml混匀,预固定(10min)→1500R/Min 离心(10min),去上清液→加固定液10ml混匀,第一次固定 (30min)→1500R/Min离心(10min),去上清液→加固定液10ml混匀,第二次固定(30min)→1500R/Min离心(10min)→调节细胞浓度,滴片4张→37℃老化玻片过夜→瑞氏染液浸染(1min)→直接转移到37℃姬姆萨工作液中浸染(60-90min)→自来水冲洗→室温凉干→中性树胶封片→镜检。染色体分法析阅片:全部染色体片均由两名副主任以上医师阅片、判读。
1.3.4 DNA倍体分析 制片:标本经保存液固定2h以上后,震荡混匀,经1500R/MIN离心后去上清液,取细胞悬液制薄层细胞学片,风干,固定。采用Feulgen染色做DNA定量分析。
细胞DNA定量分析[4]:Feulgen染色的涂片采用全自动DNA倍体细胞定量分析检测仪[MotiCytometer,麦克奥迪(夏门)医疗诊断有限公司]对全片进行扫描,经专门的分析和诊断软件处理后,可对标本内所有的细胞核内的DNA含量进行定量测定,打印DNA倍体分析直方图和细胞点阵分布图,根据诊断软件所做出的DNA倍体分析结果各处理意见完成检测报告。所有被检测细胞中出现指数 (DI)>2.5的细胞即认为是DNA倍体异常。凡DI>2.5以上细胞的玻片,必须由细胞学技术员在显微镜下逐一对DI>2.5的细胞进行核实,以排除系统将垃圾和重叠的细胞核误认为癌细胞或异常细胞。具体分析结果见表1。

表1 DNA倍体分析在胸腹水检查中判断方法
1.4 统计方法 实验结果应用SPSS 19.0统计软件分析,以率(%)表示,采用 χ2检验,P<0.05 为差异有统计学意义。
2 结果
2.1 常规脱落细胞学分析法、DNA倍体分析法、和染色体分析法检测结果 见表2,其中染色体检测法阳性率最高,为40.88%,其112例阳性结果得到病理证实为恶性肿瘤(腺癌86例、淋巴瘤4例、非小细胞型癌4例、鳞癌2例、其他恶性16例),9例可疑结果中2例得到病理证实为恶性,2例为阴性,另5例未得到病理结果证实,患者出院或转院,实验结果按阴性病例统计。DNA倍体分析法阳性率为23.36%,16例可疑病例中11例得到病理证实为恶性,3例为阴性,另2例未得到病理证实,实验结果按阴性病例统计。脱落细胞学分析法阳性率为27.73%,31例可疑病例中16例得到病理证实为恶性,7例为阴性,8例未得到病理证实,实验结果按阴性病例统计。
2.2 DNA倍体分析法与细胞学分析法和染色体分析法结果评价 实验结果发现,DNA倍体分析法与细胞分析法比较,差异无统计学意义(χ2=2.49,P>0.05);DNA倍体分析法与染色体分析法比较,差异有统计学意义(χ2=12.28,P<0.05)。染色体分析法阳性准确率较高,达97.44%。以染色体分析法结果为对照,DNA倍体分析法与染色体分析结果特异性为79.20%,敏感性为57.14%;细胞学分析法与染色体分析结果特异性为83.58%;敏感性为67.86%。
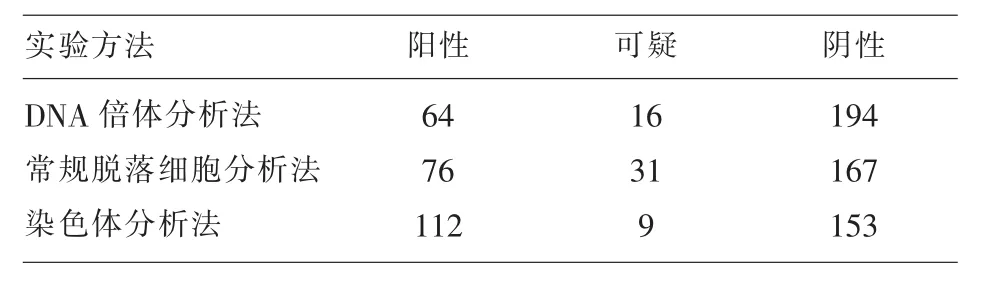
表2 DNA倍体分析与染色体分析结果
3 讨论
当前,临床上胸腹水定性诊断可用的方法一般有三种:常规脱落细胞学分析法、染色体分析法和DNA倍体分析法。传统的方法即为常规脱落学分析法,此方法具有实验方法简便,对设备要求不高,但由于诊断细胞学主要是观察细胞形态变化,因此对医生的诊断能力存在一定的考量,存在一定的局限性。胸腹水染色体检查项目虽然诊断阳性率较高,但实验方法繁杂,对医生的诊断水平比常规脱落细胞学更高,故其在医院(特别是基层医院)推广到了一定的限制。目前,仅在少许大型医院开展。DNA倍体分析技术是近年来发展的新技术,并现越来越受到临床的重视[5-8],在宫颈癌,乳腺癌,食管癌,口腔肿瘤等多种肿瘤早期诊断中取得了较高的诊断价值[9]。但在胸腹膜腔积液中的研究报道较少。人体90%细胞都处于细胞周期中的静止期,胸膜腔和腹膜腔表层的间皮细胞都属于这一期,其DI为1。当间皮细胞处于分裂期时,其DI随着细胞核内DNA合成和染色体的分离发生变化,但应该都在1-2之间,因此细胞DNA含量变化可以直接反映细胞增殖的能力[10]。恶性胸腹水中的肿瘤细胞具有无限增殖能力,其细胞核DNA的含量明显增加,测定细胞核DNA含量可以作为判断恶性胸腹水的客观依据。本研究共收集274例胸腹水标本,同时使用DNA倍体分析法、常规脱落细胞分析法和染色体分析法检测,其中染色体分析法准确率最高,达97.44%,以染色体分析法对对照,DNA倍体分析法的特异性为79.20%,敏感性为57.14%,DNA倍体分析法与细胞分析法差异无统计学意义,说明DNA倍体分析法与常规脱落细胞分析法检测结果相差不大,其结果可以作为诊断良恶性肿瘤提供参考依据。
DNA倍体分析法阴性结果较多,这是因为DNA倍体分析法只能针对肿瘤细胞已经发生DNA倍体改变的肿瘤细胞做出诊断,对DNA倍体未发生改变的二倍体肿瘤检测呈假阴性[9]。但也有可能是DNA倍体分析细胞量本身不够,导致假阴性的出现。可疑病例分析中,经病理证实为恶性肿瘤放入阳性病理统计中,因产生胸腹水的原因较多,且炎症也可能导致细胞发生不典型增生,使细胞产生异型,所以对于病理证实未阴性和没有病理证实的病例和均放入阴性病例统计中,此分析可能会增加假阴性结果,但如果影像和临床检查均没有证据证明有肿瘤占位性病变,那么胸腹水很可能是非肿瘤性病变,建议此病例随访观察。
综上对比分析,DNA倍体分析为可以像常规脱落细胞分析一样,作为胸腹水检查的辅助检查手段之一,因其技术要求相对较低,人员培训时间短,报告时间短等特点,故比其余两种方法更容易开展。在日常的检查过程中,也可以一份标本同时做DNA倍体分析及常规脱落细胞学检查,两种检查相互对照,可以大大的提高检查的阳性率,因DNA倍体分析是全电脑扫描,也可以很大程度的减少阅片医生的劳动强度。所以,DNA倍体分析法在胸腹水良恶性的判断中具有一定的价值。
[1]陈灏珠.实用内科学[M].第11版.北京卫生出版社.2001.1642-1648.
[2]汤钊奠.现代肿瘤学[M].上海:上海医科大学出版社.1993.6441.
[3]刘晓艳.DNA倍体技术在宫颈癌和癌前病变筛查中的价值探讨[J].中国医学创新,2014,8:20-21.
[4]梅金红,徐姗,韩永良,等.不能明确意义的不典型鳞状细胞伴DNA倍体异常在宫颈早期病变筛查中的意义[J].中华病理学杂志,2013,42(12):829-832.
[5]Duarte CE,Carvalho CR,Silva-Filho AL,et al.Adaptation ofimage cytometry methodology for DNA ploidy analysis of cervicalepitheli-um samples:a pilot study[J].Taiwan J Obstet Gynecol,2014,53(2):227-231.
[6]Ermiah E,Abdalla F,Buhmeida A,et al.Prognostic significanceof DNA image cytometry in Libyan breast cancer[J].Oncology,2012,83(3):165-176.
[7]Zhao L,Wei WQ,Zhao DL,et al.Population-based study ofDNA image cytometry as screening method for esophageal cancer[J].World J Gastroenterol,2012,18(4):375-382.
[8]K?mmerer PW,Koch FP,Santoro M,et al.Prospective,blinded comparison of cytology and DNA-image cytometry of brush biopsies for early detection of oral malignancy[J].Oral Oncol,2013,49(5):420-426.
[9]陶伟,李俊.细胞DNA定量分析在鉴别良恶性胸腹水中的应用价值[J].安徽医科大学学报,2015,50(7):1016-1019.
[10]Carpagnano GE,Costantino E,Palladino GP,et al.Microsatellite alterations and cell-free DNA analysis:could they increase thecytology sensitivity in the diagnosisofmalignantpleural effusion?[J].Rejuvenation Res,2012,15(3):265-273.
