人乳头瘤病毒和宫颈液基细胞学检测在宫颈癌、癌前病变筛查中的应用
2018-03-01石亚春卓延峰
石亚春,卓延峰
宫颈癌的发生和发展过程与人乳头瘤病毒(HPV)感染具有一定程度的相关性,故在宫颈癌早期筛查中HPV检测具有高敏感性和高特异性的优势和特点[1]。但又由于HPV大都属于一过性感染,并不能完全等同于宫颈病变,所以在早期筛查中增加并联合其他检查项目对于提高检测阳性率意义重大[2]。临床研究表明,宫颈液基细胞学检查(TCT)在宫颈癌筛查中具有一定的作用,其能够对患者进行宫颈细胞病理学分级,直接反应鳞状细胞的病理学特征[3]。因此,本研究以2015年1月至2016年12月期间在宁波市奉化区妇幼保健院进行宫颈癌筛查的女性作为临床研究对象,并就HPV与TCT在宫颈癌和癌前病变筛查中的联合应用价值予以研究和分析,现将结果报道如下。
1 资料与方法
1.1 一般材料 收集进行宫颈癌筛查的1 298例患者作为临床研究对象。所有研究对象均表现为阴道分泌物增加、阴道接触性出血、水样或米泔状排液、宫颈糜烂或息肉等临床症状,严格排除妊娠期及月经期者、筛查前1 d行性生活者和阴道局部用药者。患者均自愿参与研究,并签署知情同意书。依据患者及其家属意见,将患者分为TCT检测组、HPV检测组以及TCT联合HPV检测组。TCT检测组367例,年龄27~59岁,平均(45.62±8.37)岁;孕次1~4次,平均(2.06±0.39)次;产次0~3次,平均(1.23±0.28)次。HPV检测组582例,年龄 26~ 58岁,平均(44.76±7.19)岁;孕次 1~ 4次,平均(2.14±0.47)次;产次 0~3次,平均(1.19±0.24)次。TCT联合HPV检测组349例,年龄26~58岁,平均(44.76±7.19)岁;孕次 1~4次,平均(2.14±0.47)次;产次 0~3次,平均(1.19±0.24)次。对所有患者均进行阴道镜活检,将病理学结果作为“金标准”。3组患者年龄、孕次、产次差异均无统计学意义(均> 0.05)。
1.2 研究方法
1.2.1 宫颈TCT 患者检测前24 h内禁止性生活,72 h内未行阴道冲洗,且在非月经期通过膜式液基薄层细胞学检测系统进行检测。宫颈癌细胞学诊断选用国际癌症协会(2001)标准分为正常范围或存在良性反应性改变、意义不明的不典型鳞状细胞和腺细胞(ASCUS和AGUS)、不除外高度鳞状上皮内病变的不典型鳞状细胞(ASC-H)、低度鳞状上皮内病变(LSIL)、高度鳞状上皮内病变(HSIL)以及鳞状上皮细胞癌(SCC)和腺癌(AC)。细胞学阳性为ASCUS及其以上病变,即ASCUS/AGUS、ASC-H、LSIL、HSIL、SCC 及 AC。
1.2.2 HPV-DNA检测 采用深圳亚能公司生产的HPV分型检测试剂盒,通过PCR方法学检测HPV-DNA的含量。本次试剂盒能够开展23种HPV基因型,包括 18 种高危亚型(16、18、31、33、35、39、45、51、52、53、56、58、59、66、68、73、83、MM4)和 5种低危亚型(6、11、42、43、44)。
1.2.3 阴道镜及病理组织学检测 阴道镜选用深圳乐夫科技有限公司生产的LF-3000B数码电子阴道镜,分别在3、6、9、12点以及异常病灶处取镜下活检,并送病理科进行组织学检测。病理检查诊断标准总体分为4个级别,即正常、炎症、CIN以及宫颈鳞癌。CIN又可分为3个级别,即轻度不典型增生(CINⅠ),中度不典型增生(CINⅡ),重度不典型增生及原位癌(CINⅢ)。
1.3 评价指标 对 3组患者检测结果进行评价,并比较3组患者检测方法的敏感性、特异性、阳性预测值及阴性预测值等指标。
1.4 统计方法 采用SPSS 18.0统计软件进行统计学处理,计数资料比较采用2检验<0.05为差异有统计学意义。
2 结果
2.1 TCT检测与病理学检查结果的比较 在367例行宫颈TCT检查的患者中,阳性患者231例,病理学检查阳性结果为257例;诊断符合率为89.89%,见表1。
2.2 HPV检测结果与病理检测结果的比较 在582例行HPV检测的患者中,阳性患者353例。炎症、CINⅠ、CINⅡ、CINⅢ/原位癌、浸润癌HPV阳性率分别为 48.42%(199/411)、86.30%(63/73)、89.47%(34/38)、95.92%(47/49)和90.91%(10/11),其余宫颈病变HPV阳性率高于炎症(2=35.83、23.49、39.70、7.74,均< 0.05)。
2.3 宫颈TCT联合HPV检测结果与病理学检测结果的比较 在349例行宫颈TCT联合HPV检测的患者中,209例宫颈TCT和HPV检测均为阳性,60例宫颈TCT和HPV检测均为阴性,51例宫颈 TCT阳性而HPV阴性,29例宫颈TCT阴性而HPV阳性。炎症、CINⅠ、CINⅡ、CINⅢ/原位癌、浸润癌TCT联合HPV检测阳性率分别为 40.19%(86/214)、90.16%(55/61)、91.43%(32/35)、93.55%(29/31),87.50%(7/8);其余宫颈病变宫颈液基细胞学联合HPV检测阳性率高于炎症(=47.46、31.68、30.96、7.09,均< 0.05),见表 2。2.4 3组检测方法对宫颈癌及癌前病变筛查效果的比较 TCT联合HPV检测组宫颈癌和癌前病变筛查的敏感性和阴性预测值高于TCT检测组和HPV检测组(2=7.77、13.76、55.15、8.39,均<0.05),见表 3。
3 讨论
由于恶性肿瘤细胞较正常细胞更容易从原位脱落,通过提取脱落的肿瘤细胞或组织并对其性质予以深入细致的鉴定,这也是目前临床上对于肿瘤诊断的常用方法,即细胞学检查[4]。TCT检测能够将电子技术与物理学技术得到充分的结合,使标本样品呈现薄层制片效果,图像所示细胞更加清晰,层次结构更加明朗,上皮异常细胞也更易辨识,故以此筛查宫颈癌对于提高准确率及降低假阳性率均具有重要意义[5]。本研究结果表明,在367例行宫颈TCT检查的患者中,阳性患者231例,而病理学检查阳性结果为257例,诊断符合率为89.89%。
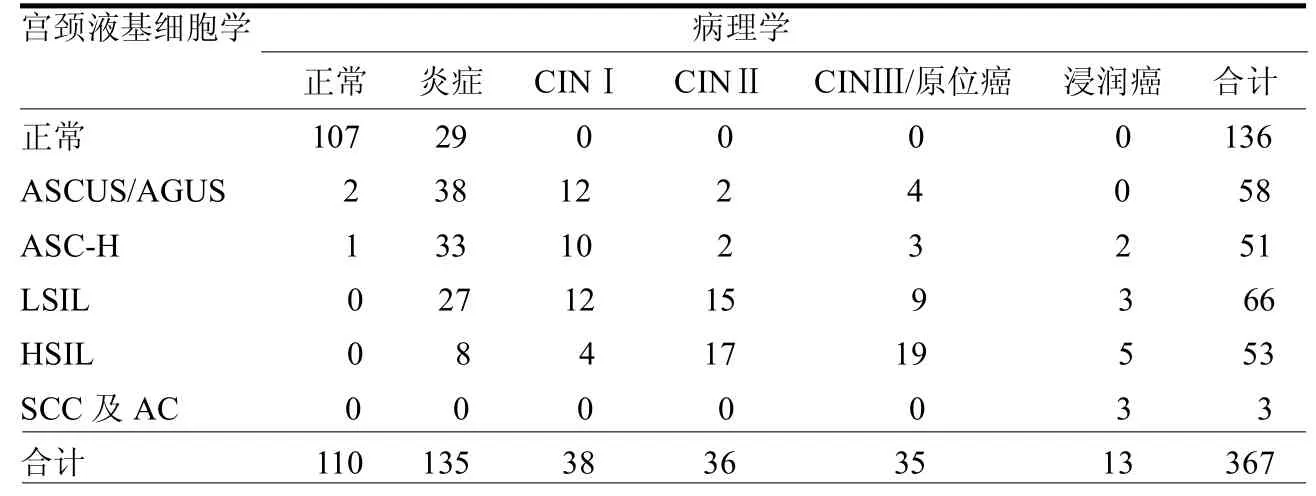
表1 宫颈液基细胞学检测与病理学检测结果比较 例

表2 宫颈液基细胞学联合HPV检测结果与病理学检测结果的比较 例

表3 3组检测方法对宫颈癌及癌前病变筛查效果的比较 %
随着对宫颈癌发病机制研究的不断深入,越来越多的证据表明宫颈癌的发生发展与患者感染HPV密切相关,几乎所有的流行病学及分子生物学研究均表明HPV感染是宫颈癌和癌前病变发生发展的必要先决条件,所以针对宫颈癌的HPV检查应运而生,并在宫颈癌筛查和诊断中发挥了一定的作用[6]。本研究结果也显示,在582例行HPV检测的患者中,阳性患者353例;在不同级别的宫颈病变中,其余宫颈病变HPV阳性率均明显高于宫颈炎症(均< 0.05)。
本研究结果也证实与TCT检测组和HPV检测组相比,TCT联合HPV检测组能够明显提高宫颈癌和癌前病变筛查的敏感性和阴性预测值(均< 0.05)。因此,HPV联合TCT检测相对于单独HPV检测及单独TCT检测更加准确和灵敏,其不仅能够弥补TCT检测相对主观性的弊端,更能够增加HPV检测与宫颈病变发展关系的重要程度,从而降低漏诊率。
[1]Coldman AJ,Gondara L,Smith LW,et al.Disease detection and resource use in the safety and control arms of the HPV FOCAL cervical cancer screening trial[J].Br J Cancer,2016,115(12):1487-1494.
[2] Tranberg M,Bech BH,Blaaker J,et al.Study protocol of the CHOiCE trial:a three-armed,randomized,controlled trial of home-based HPV self-sampling for non-participants in an organized cervical cancer screening program[J].BMC Cancer,2016,16(1):835-836.
[3] Muangto T,Chanthasenanont A,Lertvutivivat S,et al.Experience of Combined Liquid Based Cervical Cytology and High-Risk HPV mRNA for Cervical Cancer Screening in Thammasat University Hospital[J].AsianPacJCancerPrev,2016,17(9):4409-4413.
[4] 刘志红,邹艳芬.宫颈液基细胞学检查与高危型HPV检测早期筛查宫颈癌前病变的对比分析[J].现代肿瘤医学,2016,24(8):1269-1271.
[5] Parkpinyo N,Inthasorn P,Laiwejpithaya S,et al.Benefits of Cervical Cancer Screening by Liquid-Based Cytology as Part of Routine Antenatal Assessment[J].Asian Pac J Cancer Prev,2016,17(9):4457-4461.
[6] Chatzistamatiou K,Moysiadis T,Moschaki V,et al.Comparison of cytology,HPV DNA testing and HPV 16/18 genotyping alone or combined targeting to the more balanced methodology for cervical cancer screening[J].Gynecol Oncol,2016,142(1):120-127.
