基于缺氧诱导因子及PI3K-AKT-mTOR信号通路诱导佐剂关节炎滑膜血管新生的实验观察
2018-03-01张晓军刘健万磊黄传兵黄旦齐亚军
张晓军,刘健,万磊,黄传兵,黄旦,齐亚军
(1.安徽中医药大学,合肥 230038;2.安徽中医药大学第一附属医院)
类风湿关节炎(RA)炎症会造成关节变形、甚至残废,严重影响患者生存质量。RA病理本质为血管炎和滑膜炎[1]。滑膜炎和血管炎的形成过程受多种因素调节,其中滑膜血管新生的形成与RA病理表现密切相关。研究发现新生血管生成不仅是维持滑膜细胞增生的必要条件,而且与滑膜炎症程度有关[2]。RA滑膜血管新生机制复杂,近年来,磷脂酰肌醇3激酶(PI3K)/蛋白激酶B(AKT)信号通路和缺氧诱导因子1-α(HIF-1α)表达失衡成为研究的热点[3]。HIF-1α是缺氧状态下滑膜血管生成的核心调控因子,HIF-1α可以通过合成一氧化氮使血管舒张,上调血管内皮生长因子(VEGF-Α)表达使滑膜血管通透性增加。而VEGF-Α可以通过血小板衍生生长因子等一系列作用,诱导血管内皮细胞迁移和增生,产生细胞外基质,进而形成加重滑膜血管新生形成[4]。哺乳动物雷帕霉素靶向蛋白(mTOR)是HIF-1α的正性调节因子。PI3K-AKT-mTOR信号通路可以导致HIF-1a含量增加,进而促进滑膜血管新生形成。笔者通过弗氏完全佐剂(FCA)复制佐剂关节炎(AA) 大鼠模型,通过观察AA大鼠滑膜血管新生表现,检测滑膜血管PI3K-AKT-mTOR通路及HIF-1α表达,并分析PI3K-AKT-mTOR信号通路、HIF-1α与滑膜血管新生的关系,探讨RA滑膜血管新生的原因。
1 材料与方法
1.1 实验动物 大鼠:SD大鼠,由安徽省实验动物中心提供。实验动物经安徽中医学院第一附属医院和基础研究伦理委员会批准审核通过,清洁级标准饲养。
1.2 试剂 FCA:Sigma,USA,批号:116K8706;HIF-1α:Bioworld公司,USA,批号:22061046-1;VEGF-A试剂盒:美国santa cruz生物技术公司,批号:sc-507;VEGF-A试剂盒:圣塔克鲁兹公司,USA,批号:sc-1045;MVD试剂盒:圣塔克鲁兹公司,USA,批号:sc-376975;白细胞介素-6(IL-6)、白细胞介素-10(IL-10)试剂盒: RD公司,USA,批号:2013012205、2012100204。羊抗PI3K、鼠抗AKT1、兔抗p- AKT1、兔抗mTOR抗体:圣塔克鲁兹公司,USA,批号: sc-48637、sc-5298、sc-135650、sc-8319;兔抗内皮抑素(ES):abcam公司,USA,批号:ab01387。
1.3 仪器与设备 病理切片机: LEICA,德国,型号:2235;显微摄像系统:OLYMPUS,日本,型号:BX51T-32000-2;高速冷冻离心机:Sigma,德国,型号:2-16PK。电泳仪:美国Amersham公司,型号:EPS-301;凝胶图像分析仪:美国Bio-RAD公司,型号:Gel Doc XR。
1.4 方法
1.4.1 模型制备与分组 采用随机数字表法将30只将大鼠均分为正常组和模型组。向模型组大鼠注射FCA 0.1mL致炎,复制成 AA大鼠模型[5],致炎后第19天开始检测指标。
1.4.2 血清HIF-1α、VEGF-A、IL-6、IL-10表达的检测 采用ELISA法检测大鼠血清MVD、HIF-1α、VEGF-A。具体步骤依照试剂盒操作。
1.4.3 滑膜MVD测定 将各组大鼠无菌取双膝关节滑膜,常规制备石蜡包埋切片,行SABC法染色。采用山羊抗鼠MVD多克隆抗体标记血管内皮细胞(一抗浓度稀释比例1∶200),显微镜下观察各组血管新生情况。在×100倍的视野下计数3个微血管密集区的微血管数,取其平均值表示MVD[6]。
1.4.4 滑膜PI3K、AKT、p-AKT、mTOR蛋白检测 制备滑膜组织蛋白样品,取15 μg总蛋白上样电泳、转膜,封闭、孵育PI3K、AKT、p-AKT、mTOR一抗2 h,分别采用抗羊、小鼠、兔二抗孵育1 h。用增强化学发光法显色,曝光,冲洗,用扫描仪对胶片进行扫描、摄像;采用图像分析软件对条带进行分析处理,计算各组条带的灰度值,以条带与各组内参β-actin灰度值的比值做为滑膜PI3K、AKT、p-AKT、mTOR蛋白的表达量[7]。

2 结果
2.1 足跖肿胀度、关节炎指数的变化 关节炎模型复制前,两组大鼠关节症状差异无统计学意义。致炎后,模型组关节症状均明显高于正常组(P<0.01)。见表1。

表1 两组大鼠足跖肿胀度及关节炎指数变化
2.2 血清HIF-1α、VEGF-A、IL-6、IL-10变化 与正常组比较,模型组大鼠血清IL-6、HIF-1α、VEGF-A 明显升高,IL-10 表达降低(P<0.05或P<0.01)。见表2。

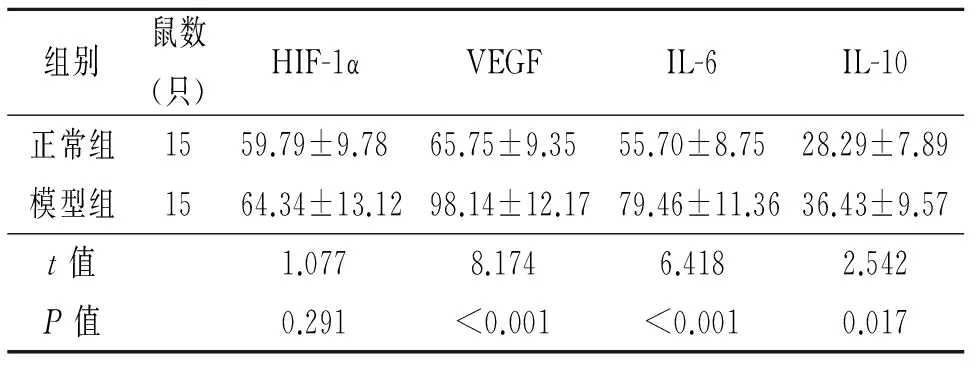
组别鼠数(只)HIF-1αVEGFIL-6IL-10正常组1559.79±9.7865.75±9.3555.70±8.7528.29±7.89模型组1564.34±13.1298.14±12.1779.46±11.3636.43±9.57t值1.0778.1746.4182.542P值0.291<0.001<0.0010.017
2.3 大鼠滑膜血管MVD计数比较 模型组大鼠滑膜组织新生血管丰富、数量多、密集,MVD 明显高于正常组 (P<0.01)。见图1。
2.4 大鼠滑膜组织PI3K、AKT1、p-AKT1、mTOR蛋白表达 与正常组比较,模型组大鼠滑膜组织PI3K、AKT1、p-AKT1、mTOR均升高。见图2。
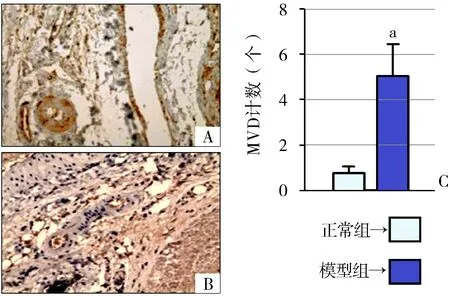
A:正常组(SP法,×200),B:模型组(SP法,×200),C:正常组和模型组MVD比较(与正常组比较,aP<0.01)
图1两组大鼠滑膜血管微血管密度变化
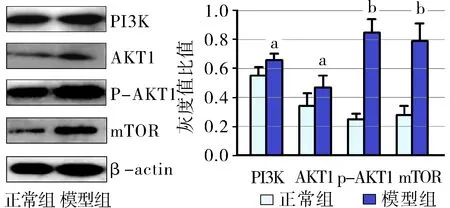
与正常组比较,aP<0.05,bP<0.01
图2两组大鼠滑膜PI3K、AKT、p-AKT、mTOR比较
2.5 相关性分析 相关性分析显示,HIF-1α与MVD、VEGF-A呈正相关,PI3K与MVD计数、 p-AKT1蛋白呈正相关,PI3K、p-AKT1与VEGF-Α、HIF-1α呈正相关,mTOR与VEGF-A、PI3K、AKT呈正相关(P<0.05)。见表3。
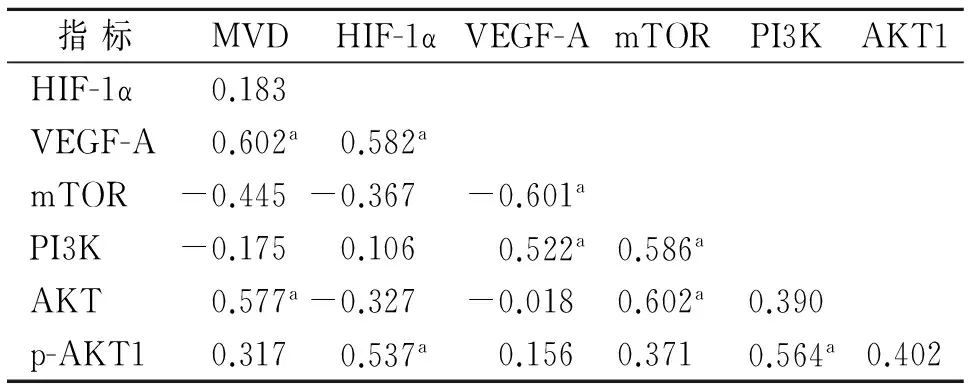
表3 两组观察指标的相关性分析(r值)
注: 采用PEARSON相关性分析,aP<0.05
3 讨论
PI3K/AKT信号通路激活、HIF-1α、VEGF-Α表达失衡可能是滑膜血管新生的重要因素[8]。PI3K/AKT通路是RA滑膜血管新生的重要调节因子,HIF-1α是调节氧稳态的转录因子,能够调节VEGF-Α表达,进而诱发血管形成和血管通透性增加[9-10]。PI3K /AKT通路过度激活会促使HIF-1α、VEGF-Α表达升高。PI3K/AKT通路和HIF-1α、VEGF-Α表达之间的连系点是mTOR。mTOR是PI3K/AKT下游底物。PI3K/AKT激活mTOR可以调节细胞增殖和生长。
PI3K具有调节细胞新陈代谢、增殖、凋亡的作用。PI3K/AKT通路激活可参与组织细胞炎性反应的增强,并导致低氧环境诱导的滑膜血管的分化、生长,从而发挥其介导参与细胞生长、发育和血管调节作用的生物学效应。PI3K的活化而使AKT 发生磷酸化。AKT是PI3K的效应器,P-AKT通常被认为是PI3K激活的标志。PI3K激活后逐渐激活AKT,活化的AKT能够促进细胞增殖、抑制凋亡,增加细胞因子的基因表达[11]。因此,PI3K激活AKT过程中滑膜血管新生发生的重要启动点。同时,滑膜血管生成与HIF-1α、VEGF-Α表达有关。HIF-1α是VEGF-Α激活和滑膜血管新生形成的调节蛋白,HIF-1α的高表达可直接参与滑膜血管新生的形成。HIF-1α可参与滑膜炎的发生、发展过程,HIF-1α表达高低可反映关节炎症的程度。VEGF-Α、HIF-1α在RA滑膜血管新生中起直接诱导作用。VEGF-Α可致血管内皮细胞分裂、增殖,导致RA血管新生形成。PI3K/AKT通路可调节HIF-1α表达,进而诱导VEGF-Α表达[12]。同时,VEGF-Α的分泌也受PI3K/AKT通路的调节。本研究显示,AA大鼠滑膜血管PI3K、AKT表达升高,且PI3K、p-AKT与VEGF-Α、HIF-1α呈正相关,而VEGF-Α、HIF-1α表达随之升高。说明AA大鼠滑膜中PI3K /AKT通路的过度激活可能会上调HIF-1α、VEGF-Α的表达,进而介导的转录活动,促进滑膜血管新生形成。本次研究结果与文献[13-14]研究结论一致。
mTOR对滑膜细胞的增殖分化起作用。滑膜炎症的进一步增加会使关节腔处于缺氧的微环境中,处于缺氧状态的滑膜细胞通过新生血管生成,导致滑膜细胞炎性细胞不断浸润,恶性循环加重滑膜炎症和关节炎程度。HIF-1α是缺氧状态下调控关节腔微环境和滑膜血管新生的关键因子[15]。mTOR的激活可以明显增加HIF-1α蛋白的合成。mTOR在PI3K /AKT通路过度激活后,可引起mTOR通路的激活,从而进一步导致HIF-1α升高,加重滑膜炎症和滑膜血管新生的形成。研究[16]显示,mTOR能增强缺氧诱导因子HIF-1α的表达,而HIF-1α表达的增加,会进一步促进与滑膜血管新生密切相关的VEGF-Α表达,加重滑膜血管新生的形成。笔者研究结果发现AA大鼠滑膜血管出现新生变化时,mTOR蛋白表达升高,同时,滑膜血管HIF-1a和VEGF表达升高,相关性分析亦显示,mTOR与VEGF表达呈正相关。提示mTOR、HIF-1a、VEGF-Α可能共同参与滑膜血管新生的过程。进一步联系PI3K/AKT蛋白表达发现,mTOR表达与PI3K、AKT蛋白表达呈一定相关性。这说明PI3K/AKT信号传导通路的过度激活,可能会导致mTOR表达量增加,进而刺激HIF-1a分泌升高,而HIF-1a表达升高会增强其下游基因VEGF-Α等的转录活性,促进滑膜新生血管生成。此结果与Lin等[17]研究结论相似。研究[18]表明,mTOR可以增加HIF-1α转录活性,增加HIF-1α蛋白表达和合成;mTOR还可促进热休克蛋白的表达,而热休克蛋白不但具有刺激滑膜炎性增加的作用,还具有抑制HIF-1α蛋白的功能。
总之,根据以上研究结果,笔者推测mTOR一方面受PI3K/AKT信号通路诱导激活,一方面可以增加滑膜HIF-1α蛋白的合成或抑制其降解,使得HIF-1α蛋白水平增加,导致VEGF-A升高,从而通过促进滑膜新生血管生长,参与滑膜炎症的过程和血管病变。
[1] TANAKA Y.Pathological mechanisms in rheumatoid arthritis[J].Nihon Rinsho,2013,71(7):1147-1152.
[2] HWANG SR,SEO DH,AL-HILAL TA,et al.Orally active desulfated low molecular weight heparin and deoxycholic acid conjugate,6ODS-LHbD,suppresses neovascularization and bone destruction in arthritis[J].J Control Release,2012,163(3):374-384.
[3] LI GQ,ZHANG Y,LIU D,et al.PI3 kinase/Akt/HIF-1α pathway is associated with hypoxia-induced epithelial-mesenchymal transition in fibroblast-like synoviocytes of rheumatoid arthritis[J].Mol Cell Biochem,2013,372(1/2):221-231.
[4] SEN D,CHAPLA A,WALTER N,et al.Nuclear factor (NF)-κB and its associated pathways are major molecular regulators of blood-induced joint damage in a murine model of hemophilia[J].J Thromb Haemost,2013,11(2):293-306.
[5] 徐叔云,卞如濂,陈修.药理实验方法学[M].3版.北京:人民卫生出版社,2002:919-921.
[6] 张育,周玮,顾健,等.沙利度胺及氨甲蝶吟抗CIA大鼠滑膜血管新生及其作用机制的研究[J].实用临床医药杂志,2008,12(5):23-27.
[7] 张钧田.现代药理实验方法[M].北京:首都医科大学,中国协和医科大学联合出版社,1998:1383.
[8] CURY V,MORETTI AI,ASSIS L,et al.Low level laser therapy increases angiogenesis in a model of ischemic skin flap in rats mediated by VEGF,HIF-1α and MMP-2[J].J Photochem Photobiol B,2013,125(4):164-170.
[9] BHATTACHARYA D,SINGH MK,CHAUDHURI S,et al.T11TS impedes glioma angiogenesis by inhibiting VEGF signaling and pro-survival PI3K/Akt/eNOS pathway with concomitant upregulation of PTEN in brain endothelial cells[J].J Neurooncol,2013,113(1):13-25.
[10] WESTRA J,BROUWER E,VAN ROOSMALEN IA,et al.Expression and regulation of HIF-1alpha in macrophages under inflammatory conditions;significant reduction of VEGF by CaMKII inhibitor[J].BMC Musculoskelet Disord,2010,11(1):61.
[11] MATSUDA S,NAKANISHI A,WADA Y,et al.Roles of PI3K/AKT/PTEN pathway as a target for pharmaceutical therapy[J].Open Med Chem J,2013,7(1):23-29.
[12] PARK JH,LEE JY,SHIN DH,et al.Loss of Mel-18 induces tumor angiogenesis through enhancing the activity and expression of HIF-1α mediated by the PTEN/PI3K/Akt pathway[J].Oncogene,2011,30(45):4578-4589.
[13] TIAN T,NAN KJ,WANG SH,et al.PTEN regulates angiogenesis and VEGF expression through phosphatase-dependent and -independent mechanisms in HepG2 cells[J].Carcinogenesis,2010,31(7):1211-1219.
[14] FIGLIN RA,DE SOUZA P,MCDERMOTT D,et al.Analysis of PTEN and HIF-1alpha and correlation with efficacy in patients with advanced renal cell carcinoma treated with temsirolimus versus interferon-alpha[J].Cancer,2009,115(16):3651-3660.
[15] WESTRA J,BROUWER E,BOS R,et al.Regulation of cytokine-induced HIF-1alpha expression in rheumatoid synovial fibroblasts[J].Ann N Y Acad Sci,2007,1108:340-348.
[16] AGANI F,JIANG BH.Oxygen-independent regulation of HIF-1:novel involvement of PI3K/ AKT/mTOR pathway in cancer[J].Curr Cancer Drug Targets,2013,13(3):245-251.
[17] LIN CH,LI CH,LIAO PL,et al.Silibinin inhibits VEGF secretion and age-related macular degeneration in a hypoxia-dependent manner through the PI-3 kinase/Akt/mTOR pathway[J].Br J Pharmacol,2013,168(4):920-931.
[18] SHIN JM,JEONG YJ,CHO HJ,et al.Melittin suppresses HIF-1α/VEGF expression through inhibition of ERK and mTOR/p70S6K pathway in human cervical carcinoma cells[J].PLoS One,2013,8(7):e69380.
