白藜芦醇对TNF-α诱导的离体大鼠肺动脉内皮细胞损伤及MCP-1表达的影响*
2018-03-01林建伟严建平王良兴
陈 淳, 林建伟, 严建平△, 王良兴
(1浙江省人民医院呼吸内科, 杭州医学院附属人民医院呼吸内科, 2浙江大学附属邵逸夫医院心血管内科, 浙江 杭州 310014; 3温州医科大学附属第一医院呼吸内科, 浙江 温州 325000)
肺血栓栓塞症(pulmonary thromboembolism,PTE)为临床常见病、危重病[1]。急性PTE后严重肺动脉高压是该病死亡的直接原因,其发病机制复杂,是一个多因素参与的过程。近年来研究表明,急性肺栓塞后栓塞血管周围大量炎症细胞浸润引起内皮功能紊乱,是引起肺动脉高压的首要因素[2]。单核细胞趋化蛋白1(monocyte chemoattractant protein-1,MCP-1)属于炎症趋化因子,可在急性肺损伤发生后募集大量炎症细胞至损伤部位形成正反馈,产生一系列炎症相关介质造成肺血管内皮细胞损伤,从而引起肺动脉压力升高[3]。
中药单体白藜芦醇(resveratrol,Res)是一种植物多酚,除具有心血管的保护作用外,其抗炎效应也已被证实[4]。研究报道,白藜芦醇可有效抑制MCP-1在血管炎症模型中释放[5],且白藜芦醇在血管动脉粥样硬化形成过程中同样可通过减少MCP-1的表达,预防血管壁泡沫细胞生成[6]。本研究在体内部分结果亦已证实,白藜芦醇可有效降低急性肺栓塞后MCP-1的大量表达,有助于缓解急性肺栓塞后肺动脉高压。因此,本实验在离体大鼠肺动脉内皮细胞(rat pulmonary artery endothelial cells,RPAECs)中加用肿瘤坏死因子α(tumor necrosis factor-α,TNF-α),诱导MCP-1大量表达,体外模拟急性PTE后的炎症反应状态,探究白藜芦醇是否可下调MCP-1表达,减少对内皮细胞的损伤。
本实验采用离体培养大鼠肺动脉内皮细胞,通过TNF-α诱导内皮细胞MCP-1表达,观察白藜芦醇对MCP-l表达的影响,同时探讨白黎芦醇降低TNF-α诱导离体大鼠肺动脉内皮细胞MCP-1表达的作用机制。
材 料 和 方 法
1实验动物、试剂及仪器
SPF级健康成年雄性SD大鼠6只,体重300~350 g,购于上海中科院,许可证号为SCXK(浙)2005-0019,饲养于温州医科大学实验动物中心层流实验室,温度25 ℃,湿度70%,昼夜照明12/12 h。
白藜芦醇(Sigma-Aldrich);兔抗鼠MCP-1多克隆抗体(Abcam);SYBR Green Real-Time PCR Master Mix (TOYOBO);MCP-1特异性中和抗体C1142(Centocor);RPMI-1640培养基、胎牛血清和TRIzol(Gibco)。PowerLab系统(ADInstruments);S1000 PCR仪(Bio-Rad)。
2实验方法
2.1大鼠肺动脉内皮细胞的分离和培养 取SPF级健康成年雄性的SD大鼠6只,参照文献描述的方法[7],分离肺动脉,用显微剪将肺动脉剪成1.5 mm×1 mm×1 mm大小的组织块,放入25 cm2无菌培养瓶(1%明胶预置,4 ℃过夜,用前2 h移入37 ℃、5% CO2,95%湿度恒温CO2培养箱)培养,固化2 h后,小心加入含20%胎牛血清的RPMI-1640培养液2 mL,放入培养箱中静置培养。约48 h后,可见较多内皮细胞爬出,60 h后将肺组织块轻轻吸出,更换培养液,继续培养。7 d左右可见细胞已融合成单层,RPAECs的形态为多边形,呈典型的“铺路石”样生长,即可行传代培养,取第4代培养细胞用于实验。
2.2大鼠肺动脉内皮细胞的鉴定 细胞形态鉴定采用倒置相差显微镜观察,贴壁生长的细胞胞质透明,彼此融合生长,细胞呈多边形、短梭形,呈现典型的“铺路石”和“鹅卵石”样生长。免疫细胞化学鉴定参考第Ⅷ因子相关抗原免疫组化染色试剂盒(Sigma-Aldrich)说明,以不加 I 抗为阴性对照,鉴定所培养细胞为肺动脉内皮细胞。
2.3白藜芦醇合适作用浓度的确定 应用CCK-8法测定不同浓度白藜芦醇对RPAECs活力的影响,以确定实验中药物的合适浓度。取对数生长期的RPAECs,消化吹打成单细胞悬液,调整细胞浓度至5×107/L,将细胞接种到96孔板中,每孔加100 μL,培养24 h。细胞生长至次融合状态时,更换无血清培养液培养24 h。将RPAECs混悬培养液(1×107/L)分别加入3块96孔板中,每块板均分6组,即对照组、调零组和白藜芦醇0.5 μmol/L、5 μmol/L、50 μmol/L和500 μmol/L处理组,每组接种6孔,24 h后吸出培养液,用含4% 胎牛血清的RPMI-1640洗3遍,各孔中留100 μL,分别在培养1、4和8 h时各取出其中一块96孔板,于各孔分别加入CCK-8试剂10 μL,37 ℃培养2 h,选择450 nm波长,在酶联免疫检测仪上测吸光度值(A)值。根据测定数值选择对RPAECs活性无影响的白藜芦醇最高浓度进行实验。
2.4实验分组 实验分为正常组(control组)、溶剂对照组(solvent组)、TNF-α组(10 μmol/L)、TNF-α+C1142(10 μg/L)组(C1142组)和TNF-α+白藜芦醇组(Res组),每组分成1、4和8 h 3个时点。实验前取生长良好的对数生长期细胞,经胰酶消化分组接种。待细胞长满60%~80%左右,换无血清RPMI-1640培养液饥饿培养24 h,然后行药物干预。将各组细胞置于37 ℃、5% CO2、95%湿度恒温CO2培养箱中分别培养1、4和8 h。
2.5TUNEL法检测并计算肺动脉内皮细胞凋亡指数 各组选取1张肺细胞切片,置于64 ℃烘箱1 h,二甲苯脱蜡3次,每次各5 min。后依次置于100%、95%、90%、80%和70%乙醇中各5 min水化;PBS缓冲液冲洗5 min,滴加蛋白酶K(现配),37 ℃水浴箱消化30 min;PBS缓冲液洗涤2次,每次5 min;灭活过氧化酶,滴加3%过氧化氢溶液室温静置10 min;PBS缓冲液洗3次,每次5 min;每张玻片滴加TUNEL反应混合液(现配)约50 μL,加盖玻片,置孵育盒中,37 ℃恒温水浴箱中反应60 min;PBS缓冲液冲洗3次,每次5 min,滴加Convert-POD,加盖玻片置于37 ℃恒温水浴箱30 min,PBS缓冲液冲洗3次,每次3 min,室温下加DAB显色试剂混合液,显色约90 s,显微镜下观察,适时停止反应,苏木素复染5 s,双蒸水冲洗,依次由低到高浓度置于上述乙醇溶液各3 min脱水,置二甲苯2次,每次3 min,中性树胶封片固定。
细胞核中出现棕色颗粒为TUNEL 阳性细胞,即凋亡细胞。选择阳性细胞区域,高倍镜下分别计数D16目镜测微网网格中阳性细胞数和细胞总数。每张切片计数10个网格,重复3次,取平均值,计算凋亡指数(apoptotic index,AI),AI(%)=TUNEL阳性细胞数/细胞总数×100%。
2.6Real-time PCR检测MCP-1的mRNA表达 使用TRIzol从100 mg快速冻存组织中萃取总RNA。RNA浓度在波长260 nm处的吸光度定量,RNA纯度在波长260 nm和280 nm(A260/A280)检测。取1 μg总RNA与2 μL 5×RT buffer、0.5 μL RT enzyme mix和0.5 μL primer mix进行逆转录,将逆转录终产物溶于10 μL去RNA酶水中备用。MCP-1上游引物序列为5’-GTCTCTGTCACGCTTCTG-3’,下游引物序列为5’-TGCTGGTGATTCTCTTGTAG-3’;内参照GAPDH上游引物序列为5’-AGAACATCATCCCTGCATCC-3’,下游引物序列为5’-TGGATACATTGGGGGTAGGA-3’。PCR反应条件为95 °C 2 min;95 °C 15 s、62 °C 1 min, 40个循环。所有PCR结果由ABI 7500 System SDS软件分析,实验数据使用2-ΔΔCt方法计算。
2.7Western blot检测MCP-1的蛋白表达水平 所有细胞的蛋白浓度均使用BCA法检测,采用15%的分离胶和5%的浓缩胶进行SDS-PAGE,用兔抗大鼠MCP-1多克隆抗体(1∶1 000)4 ℃封闭过夜后,再与辣根过氧化物酶标记的羊抗兔 II 抗(1∶5 000)孵育2 h;化学发光、显影、定影;将胶片进行扫描,用Quantity One凝胶图像分析软件分析各组蛋白表达。
3统计学处理
全部数据采用SPSS 16.0统计软件分析。所有数据进行正态性检验,计量资料用均数±标准差(mean±SD)表示;多组样本均数比较进行方差齐性检验,组间比较采用单因素方差分析(one-way ANOVA),方差齐性者两两比较采用LSD法,方差不齐者进行Dunnet’s T3检验。以P<0.05为差异有统计学意义。
结 果
1细胞鉴定
在倒置光学显微镜下,RPAECs呈梭型,细胞中心有卵圆形细胞核,细胞呈多边形、短梭形,呈现典型的“铺路石”、“鹅卵石”样生长,见图1;第Ⅷ因子相关抗原免疫染色呈棕黄色阳性,说明培养的细胞是肺动脉内皮细胞,见图2。

Figure 1. The morphological observation of RPAECs under light microscope (×100).
图1RPAECs光镜下的形态
Figure 2. Identification of the RPAECs (Ⅷ factor-related antibody for immunostaining, ×400).
图2RPAECs的免疫细胞化学鉴定
2各组RPAECs细胞8h在倒置光学显微镜下的形态改变
在倒置光学显微镜下,control组与solvent组RPAECs相互融合呈贴壁生长,无细胞凋亡;TNF-α组RPAECs有较多凋亡,细胞皱缩且细胞数量较solvent组显著减少;C1142组也出现部分细胞凋亡现象,但较TNF-α组凋亡细胞数量较少(P<0.05),大部分细胞仍能贴壁生长,见图3、4。
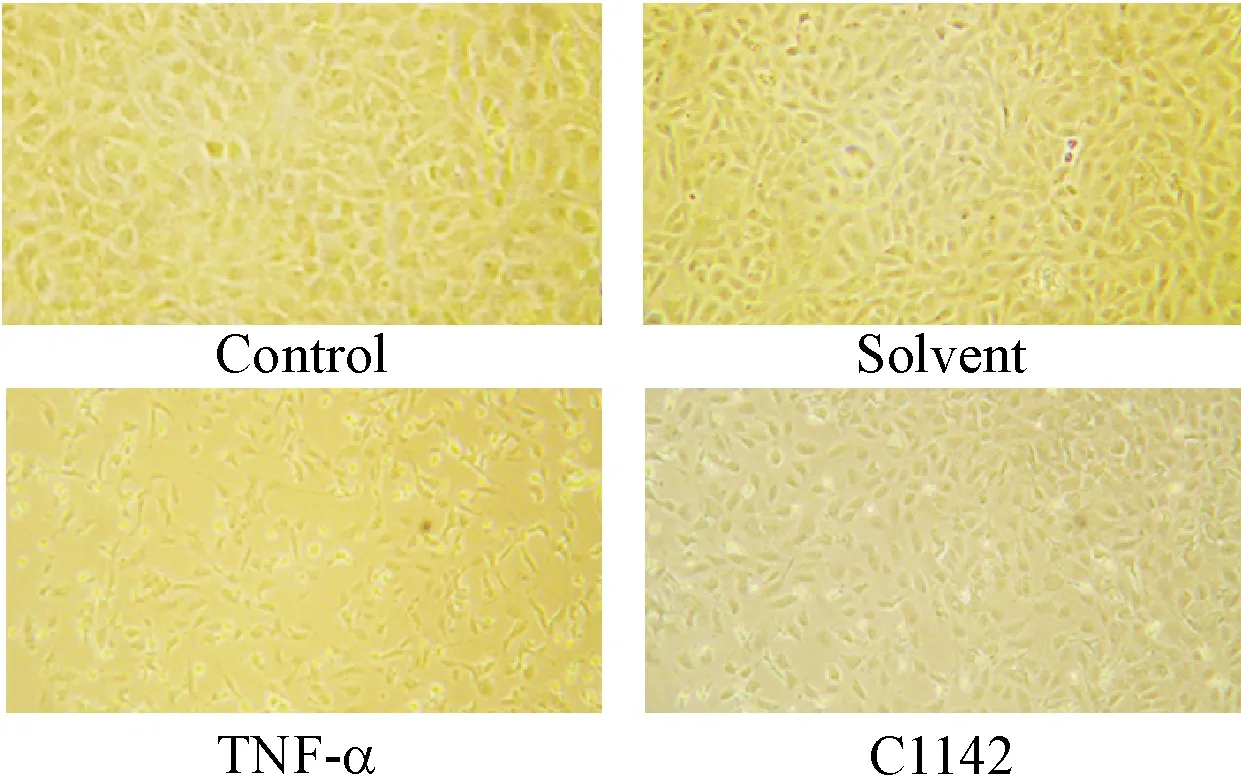
Figure 3. The morphological changes of RPAECs at 8 h in different groups (×100).
图38h各组RPAECs在倒置光学显微镜下形态学改变
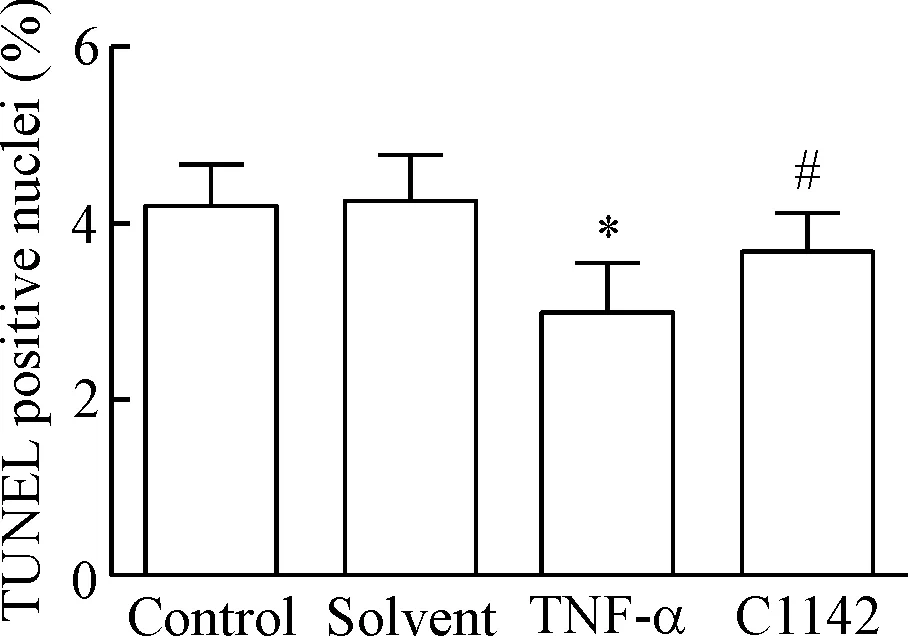
Figure 4. The effects of C1142 on the apoptosis of RPAECs at 8 h in different groups. Mean±SD.n=6.*P<0.05vscontrol group;#P<0.05vsTNF-α group.
图48hMCP-1特效中和抗体C1142对各组RPAECs凋亡的影响
3不同浓度白藜芦醇对RPAECs增殖的影响
当白藜芦醇<50 μmol/L时,随着白藜芦醇浓度升高, 处理组的A450有增高的趋势,但与对照组相比差异无统计学显著性;而当白藜芦醇≥50 μmol/L时,处理组的A450有下降的趋势(P<0.05),提示低于50 μmol/L的白藜芦醇对RPAECs的细胞活力没有影响,而当白藜芦醇>50 μmol/L时,细胞活力下降。因此选用50 μmol/L的白藜芦醇作为处理组合适浓度作用于RPAECs,观察白藜芦醇对RPAECs表达MCP-1的影响,见表1。
4白藜芦醇对RPAECs中MCP-1mRNA表达的影响
与control组比较,各相同时点,solvent组MCP-1的mRNA表达差异无统计学显著性;RPAECs经TNF-α刺激后,MCP-1的mRNA表达水平较solvent组显著升高(P<0.05)。Res组MCP-1的mRNA表达水平分别较TNF-α刺激组显著降低(P<0.05),见图5。
表1白藜芦醇对肺动脉内皮细胞活力的影响
Table 1. The effects of resveratrol (Res) on the cell activity of RPAECs (Mean±SD.n=6)

Res(μmol/L)A4501h4h8h00.83±0.340.88±0.420.94±0.360.50.84±0.230.90±0.321.14±0.4350.84±0.270.90±0.331.10±0.40500.78±0.35∗0.77±0.36∗0.75±0.37∗5000.77±0.38∗0.73±0.32∗0.71±0.24∗
*P<0.05vs0 μmol/L group.
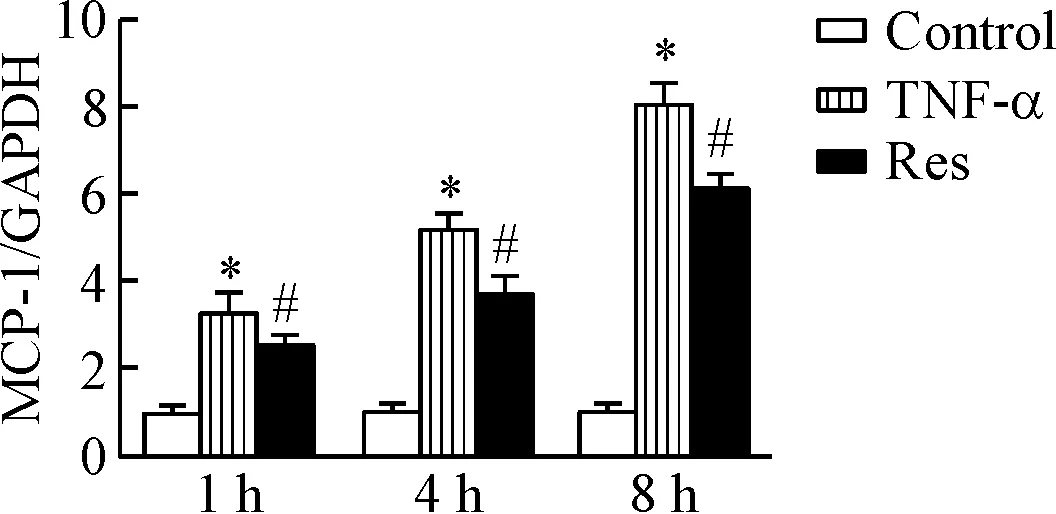
Figure 5. The effect of resveratrol (Res) on the mRNA expression of MCP-1 in RPAECs. Mean±SD.n=6.*P<0.05vscontrol group;#P<0.05vsTNF-α group.
图5白藜芦醇对大鼠肺动脉内皮细胞MCP-1mRNA表达的影响
5白藜芦醇对RPAECs中MCP-1蛋白表达的影响
与control组比较各相同时点的变化,solvent组的MCP-1 蛋白表达差异无统计学显著性;RPAECs经TNF-α诱导后,MCP-1 的蛋白表达水平较solvent组显著增高(P<0.05);Res组的MCP-1 蛋白表达较TNF-α组显著降低(P<0.05),见图6。
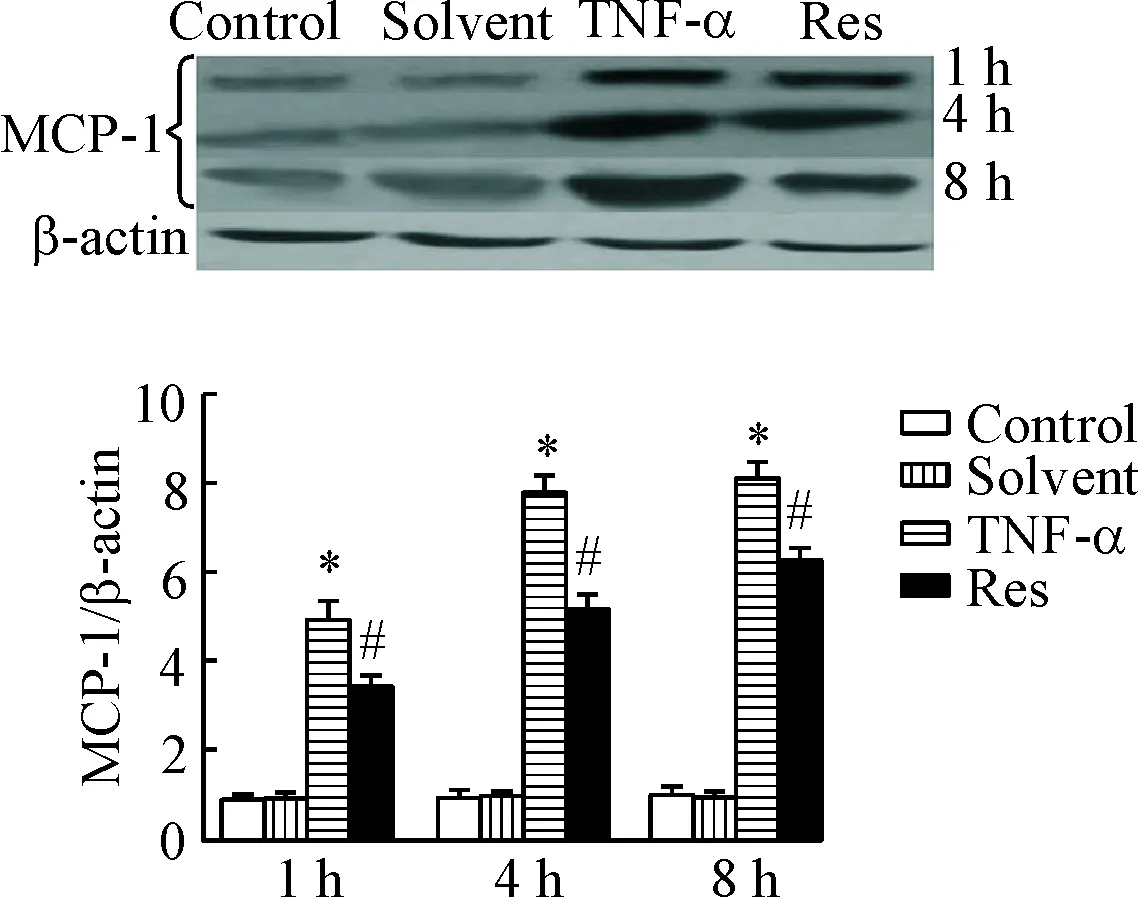
Figure 6. The effect of resveratrol (Res) on protein expression of MCP-1 in RPAECs. Mean±SD.n=6.*P<0.05vscontrol group;#P<0.05vsTNF-α group.
图6白藜芦醇对各组RPAECs细胞MCP-1蛋白表达的影响
讨 论
PTE是血栓堵塞肺动脉引起肺循环障碍的临床和病理生理综合征,急性PTE后肺动脉高压是引起死亡的主要原因。传统认为,血栓对肺血管系统的机械阻塞程度是肺动脉压力升高的主要决定因素。但近年来研究发现肺栓塞后机械性阻塞虽已基本解除,仍存在肺动脉高压,因此认为肺栓塞时肺部炎症细胞的浸润以及这些炎症细胞产生的细胞因子可能在肺栓塞后肺动脉高压的形成中起着非常关键的作用[8]。
肺栓塞后,肺血管内皮细胞广泛受损,大量缩血管物质被释放,如内皮素和血管紧张素等均使肺血管收缩。又有研究指出,肺血栓在血管内移动时,发生血小板活化并脱颗粒,释放血管活性物质,包括5-羟色胺、二磷酸腺苷、组胺、前列腺素H2及12-脂氧化酶产物[9-10]。同时血小板活化因子和12-脂氧化酶产物又诱发出中性粒细胞,释放花生四烯酸代谢产物,如血栓素A2及白三烯B4、C4和D4等,这些物质均致肺小动脉收缩,反射性引起交感神经释放儿茶酚胺,加重肺动脉收缩,引起肺动脉高压[10-11]。
既往多种报道指出炎症介质如TNF-α、白细胞介素(interleukin,IL)-1β、IL-6和内皮素(endothelin,ET)-1等在急性肺栓塞后表达明显升高[11-13],且TNF-α可刺激肺动脉内皮细胞中单核细胞趋化蛋白-1大量表达[14-16]。MCP-1是活化和聚集炎症细胞至血管内皮细胞的重要介导者。Eagleton等[17]发现在肺栓塞早期,肺动脉壁中MCP-1表达量明显升高,同时在栓塞后3 h即有炎症细胞浸润肺动脉壁。MCP-1可在急性肺损伤发生后募集大量炎症细胞至损伤部位形成正反馈,产生一系列炎症相关介质造成肺血管内皮细胞损伤引起肺动脉压力升高[18]。
为进一步证实MCP-1表达是否加重对肺动脉内皮细胞的损伤,本实验选取大鼠离体肺动脉内皮细胞培养,加入TNF-α诱导MCP-1大量表达状态,体外模拟急性PTE后大量炎症因子表达的内环境,并加用MCP-1特效中和抗体C1142干预观察血管内皮细胞形态改变。在倒置光学显微镜下,观察到正常对照组与溶剂对照组RPAECs相互融合且呈贴壁生长,无细胞凋亡改变;TNF-α组RPAECs有较多凋亡及细胞皱缩且细胞数量较solvent组显著下降。TNF-α+C1142组也出现部分细胞凋亡,但较TNF-α组凋亡细胞数量明显减少,大部分细胞仍能贴壁生长。提示TNF-α诱导MCP-1的大量表达可加重RPAECs损伤,有助于肺动脉高压的形成。由此可得,降低MCP-1表达,减少对RPAECs损伤可能是急性PTE后肺动脉压力的一种有效手段。
中药单体白藜芦醇属芪类化合物, 目前已经在21个科、31个属的72 种植物中发现了白藜芦醇,其中,葡萄、虎杖和花生中白藜芦醇含量较高,具有抗氧化、抗肿瘤和抗炎等多种作用。Zhu 等[6]在研究中证实白藜芦醇可通过发挥抗炎效应,抑制TNF-α诱导的MCP-1表达,从而预防肥胖相关性疾病的发生。亦有报道指出白藜芦醇在人脐静脉内皮细胞中,可抑制由IL-1 刺激产生的MCP-1合成与分泌,成为白藜芦醇保护心血管系统的机制之一。白藜芦醇降低急性PTE后MCP-1表达的效应在本研究第一部分在体实验中亦被证实,该结果已被《Life Science》录用[19]。
本实验通过培养大鼠离体RPAECs,进一步探究白藜芦醇对TNF-α诱导MCP-1表达的效应。Wes-tern blot及real-time PCR结果发现,白藜芦醇可显著下调由TNF-α诱导的MCP-1 mRNA和蛋白水平,表明白藜芦醇可通过下调TNF-α诱导MCP-1的表达,减少对单核细胞的募集,减轻炎症细胞及炎症介质对肺动脉内皮细胞的损伤。然而,目前关于白藜芦醇如何下调TNF-α诱导的MCP-1表达,减少肺动脉内皮细胞损伤的机制仍尚不明确。丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPKs)是生物细胞内一类丝氨酸/苏氨酸蛋白激酶。多项研究表明,MAPKs信号转导通路将细胞外刺激信号转导至细胞质及其核内,在引起生物学反应(如细胞分化、增殖、转化和凋亡等)过程中具有十分重要的作用。p38 MAPK通路是1993年发现的信号转导通路,属于MAPKs成员之一,其一旦被激活,细胞质中的非磷酸化p38 MAPK转化为磷酸化p38 MAPK,而后移位到细胞核内。既往研究证实p38 MAPK是MCP-1产生的关键上游分子,抑制p38 MAPK通道可以减少MCP-1的大量表达[20-21]。Gresele等[22]发现白藜芦醇在急性缺血性心脏疾病中可通过p38 MAPK信号转导通路减少大量炎症趋化因子产生。Chakraborty等[23]亦报道白藜芦醇可通过抑制p38 MAPK信号转导通路激活减少炎症反应发生。SB203580是p38 MAPK的特异性的吡啶异咪哒唑类抑制剂的突出代表。本实验后续实验将加用p38 MAPK通路特效抑制剂SB203580预孵育,继续探究白藜芦醇是否可通过抑制p38 MAPK信号转导通路减少TNF-α诱导后MCP-1的大量表达,抑制肺动脉内皮细胞损伤的分子机制。
综上所述,本研究显示MCP-1的大量表达参与TNF-α诱导后肺动脉内皮细胞的损伤;白藜芦醇可降低TNF-α诱导后大鼠离体RPAECs中MCP-1表达,从而减少内皮细胞损伤;白藜芦醇可成为一种新型的预防肺动脉内皮损伤的药物。
[1] Smulders YM. Pathophysiology and treatment of haemodynamic instability in acute pulmonary embolism: the pivotal role of pulmonary vasoconstriction[J]. Cardiovasc Res, 2000, 48(12):23-33.
[2] Winn RK, Harlan JM. The role of endothelial cell apoptosis in inflammatory and immune diseases[J]. J Thromb Haemost, 2005, 3(8):1815-1824.
[3] Sener G, Topaloglu N, Sehirli AO, et al. Resveratrol alleviates bleomycin-induced lung injury in rats[J]. Pulm Pharmacol Ther, 2007, 20(11): 642-649.
[4] Park DW, Baek K, Kim JR, et al. Resveratrol inhibits foam cell formation via NADPH oxidase 1-mediated reactive oxygen species and monocyte chemotactic protein-1[J]. Exp Mol Med, 2009, 41(3):171-179.
[5] Asou H, Koshizuka K, Kyo T, et al. Resveratrol, a natural product derived from grapes, is a new inducer of diffe-rentiation in human myeloid leukemias[J]. Int J Hematol, 2002, 75(5):528-533.
[6] Zhu J, Yong W, Wu X, et al. Anti-inflammatory effect of resveratrol on TNF-α-induced MCP-1 expression in adipocytes[J]. Biochem Biophys Res Commun, 2008, 369(2):471-477.
[7] Adkison JB, Miller GT, Weber DS, et al. Differential responses of pulmonary endothelial phenotypes to cyclical stretch[J]. Microvasc Res, 2016, 71(3): 175-184.
[8] Kimura H, Okada O, Tanabe N, et al. Plasma monocyte chemoattractant protein-1 and pulmonary vascular resistance in chronic thromboembolic pulmonary hypertension[J]. Am J Respir Crit Care Med, 2001, 164(2):319-324.
[9] Matoba K, Kawanami D, Ishizawa S, et al. Rho-kinase mediates TNF-alpha-induced MCP-1 expression via p38 MAPK signaling pathway in mesangial cells[J].Biochem Biophys Res Commun, 2010, 402(4):725-730.
[10] Doggerll SA. The role of 5-HT on the cardiovascular and tenal systems and the clinical potention of 5-HT modulation[J]. Expert Opin Investig Drugs, 2013, 12(5):805-823.
[11] Wakefiels TW, Strieter RM, Schaub R, et al. Venous thrombosis prophylaxis by inflammatory inhibition without anticoagulation therapy[J]. J Vasc Surg, 2010, 31(2):309-324.
[12] Eagleton MJ, Henke PK, Luke CE, et al. Inflammation and intimal hyperplasia associated with experimental pulmonary embolism[J]. J Vascular Surg, 2002, 36(3):581-588.
[13] Taheri SA, Shenoy S, Murawski S, et al. Diagnosis of pulmonary embolism by use of urinary TNFα and its soluble TNF receptor I[J]. Angiology, 1999, 50(9):703-706.
[14] 庞宝森, 王 辰, 伍燕兵, 等. 急性多发性微小血栓所致犬肺栓塞时对细胞因子的影响[J]. 中华医学杂志, 2012, 82(15):1067-1069.
[15] Sica A, Wang JM, Colotta F, et al. Monocyte chemotactic and activating factor gene expression induced in endothe-lial cells by IL-1 and tumor necrosis factor[J]. J Immunol, 1990, 144(8):3034-3038.
[16] Rollins BJ, Yoshimura T, Leonard EJ, et al. Cytokine-activated human endothelial cells synthesize and secrete a monocyte chemoattractant, MCP-1/JE[J]. Am J Pathol, 1990, 136(6):1229-1233.
[17] Eagleton MJ, Henke PK, Luke CE, et al. Inflammation and intimal hyperplasia associated with experimental pulmonary embolism[J]. J Vasc Surg, 2002, 36(3): 581-588.
[18] Langer F, Schramm R, Bauer M, et al. Cytokine response to pulmonary thromboendarterectomy[J]. Chest, 2004, 126(1):135-141.
[19] Chen C, Wang Y, Cai X, et al. Resveratrol downregulates acute pulmonary thromboembolism-induced pulmonaryartery hypertension via p38 mitogen-activated protein kinase and monocyte chemoattractant protein-1 signaling in rats[J]. Life Sci, 2012, 90(19-20):721-727.
[20] Cullen JP, Morrow D, Jin Y, et al. Resveratrol, a polyphenolic phytostilbene, inhibits endothelial monocyte chemotactic protein-1 synthesis and secretion[J]. J Vasc Res, 2007, 44(1):75-84.
[21] Shui H, Gao P, Si X, et al. Mycophenolic acid inhibits albumin-induced MCP-1 expression in renal tubular epithelial cells through the p38 MAPK pathway[J]. Mol Biol Rep, 2010, 37(4):1749-1754.
[22] Gresele P, Pignatelli P, Guglielmini G, et al. Resveratrol at concentrations attainable with moderate wine consumption stimulates human platelet nitric oxide production[J]. J Nutr, 2008, 138(9):1602-1608.
[23] Chakraborty PK, Mustafi SB, Raha S. Pro-survival effects of repetitive low-grade oxidative stress are inhibited by simultaneous exposure to resveratrol[J]. Pharmacol Res, 2008, 58(5-6):281-289.
