性别对L-精氨酸诱发的昆明小鼠慢性胰腺炎的影响*
2018-03-01范建伟许小凡辛嘉萁段丽芳
范建伟, 许小凡, 辛嘉萁, 吴 楠, 段丽芳, 张 红△
(陕西中医药大学 1基础医学院, 2医学科研实验中心, 陕西 咸阳 712046)
慢性胰腺炎(chronic pancreatitis,CP)是临床上常见的消化系统疾病,主要表现为胰腺实质的慢性炎症。CP病因复杂,以胰腺渐进性、不可逆性破坏引起胰腺内外分泌腺功能缺陷为特征,严重影响患者的生活质量[1]。L-精氨酸(L-arginine)腹腔注射是一种被普遍认可的复制急性胰腺炎(acute pancreatitis,AP)动物模型方法[2-3],近期也有学者开始尝试将其用以复制CP模型[4],实验结果显示L-精氨酸能够诱发胰腺的慢性炎症和纤维化,但是我们课题组在以往的实验中发现,此种方法复制的CP模型病变程度不够均一,相关指标的组内差异较大,影响了对CP实验药物疗效的评判。在探寻L-精氨酸造模不均一的原因时,本课题组发现在慢性胰腺炎的诱发过程中雄性小鼠的胰腺病理损伤程度似乎重于雌性小鼠,然而,不同性别小鼠对L-精氨酸造模的敏感性是否存在差异目前尚不清楚。因此,本研究通过观察L-精氨酸对CP 的诱导作用及性别对成模的影响,拟寻找一种稳定、均一的CP造模方法,确保CP相关药物疗效评价的可靠性。
材 料 和 方 法
1药品、试剂和仪器
L-精氨酸(A6969-100G)购于Sigma-Aldrich;抗F4/80(18705-1-AP)抗体购于Proteintech;抗α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA;bs-10196R)抗体和抗纤维连接蛋白(fibronectin,FN;bsm-33143M)抗体购于博奥森试剂公司;抗GAPDH(BM1623)抗体、HRP标记的羊抗兔(BA1054)及羊抗小鼠(BA1050)II 抗购于博士德试剂公司;ECL化学发光试剂盒购于碧云天;Masson染色试剂盒购于南京建成生物研究所;RNA提取试剂(9767)、反转录及real-time PCR试剂(RR047A、RR820A)购于TaKaRa;其它试剂为当地生物制剂公司提供的分析纯化学试剂。Western blot电泳仪器(Bio-Rad);7500 PCR仪(ABI);FluorChem FC3化学发光凝胶成像系统(ProteinSimple)。
2实验方法
2.1动物分组及造模 健康昆明小鼠84只,雌雄小鼠各42只,6~8周龄,体重20~28 g,购于第四军医大学动物实验中心(合格证号0001249),实验前适应性饲养1周。随机分为4组(对照组n=18,每时点6只;CP组n=24,每时点8只):雌性对照(female control, F-control)组、雌性CP(F-CP)组、雄性对照(male control,M-control)组和雄性CP(M-CP)组。CP组给予腹腔注射20% L-精氨酸(3 g/kg),每周1次,每次2轮,间隔1 h。对照组给予腹腔注射与L-精氨酸等体积的生理盐水。
2.2标本采集与检测 分别在造模后2、4和6周麻醉处死动物,完整摘除胰腺,均匀分配胰腺头、体、尾部,将部分胰腺组织置于10%中性甲醛溶液浸泡固定,另一部分胰腺组织迅速放入液氮中速冻,再转入-80 ℃冰箱保存,用于后续提取RNA及蛋白。
2.3胰腺组织病理学观察 经10%中性甲醛溶液浸泡固定后的胰腺组织脱水、石蜡包埋、3 μm切片,HE及Masson染色观察胰腺组织形态学改变及纤维化程度。
2.4免疫组织化学染色观察胰腺组织F4/80的表达 取胰腺组织3 μm切片常规脱蜡至水,枸橼酸缓冲液煮沸抗原修复后室温冷却,PBS洗3次,每次5 min,3% H2O2室温孵育10 min,阻断内源性过氧化物;正常山羊血清封闭液室温孵育40 min;抗F4/80的 I 抗(1∶150) 4 ℃过夜,生物素化羊抗兔IgG II 抗(1∶500),37 ℃孵育1 h;SABC,37 ℃孵育30 min;DAB显色、复染、镜检、脱水、封片。
2.5Real-time PCR检测胰腺组织白细胞介素6(interleukin-6,IL-6)、α-SMA及FN的mRNA表达 IL-6、α-SMA及FN引物序列见表1,按试剂盒的操作步骤提取胰腺组织总RNA并逆转录成cDNA。以cDNA为模板进行PCR,反应条件(20 μL体系):SYBR 10 μL,上、下游引物(10 μmol/L)各0.8 μL,ROX reference dye Ⅱ 0.08 μL,cDNA(20 mg/L) 6 μL,ddH2O 2.32 μL。扩增条件为:50 ℃预热 2 min;95 ℃预变性 10 min;95 ℃变性 5 s、60 ℃退火30 s、72 ℃延伸 30 s,共40个循环。以GAPDH作为内参照,计算目的基因的相对表达量。

表1 引物序列
2.6Western blot 检测胰腺组织α-SMA及 FN的蛋白表达 取胰腺组织50 mg,加蛋白裂解液500 μL充分匀浆,冰上孵育1 h,10 000 r/min、4 ℃离心10 min,提取上清液,BCA法进行蛋白定量后,加入6×loading buffer将样品稀释至4 g/L。以相应分子量的Marker为参照,SDS-PAGE,电转移至PVDF膜,封闭液(5%脱脂奶粉)中缓慢摇荡1 h,滴加 I 抗分别为GAPDH(1∶1 000)、α-SMA(1∶400)及FN(1∶400),4 ℃摇床孵育过夜。TBST漂洗3次(每次5 min)。HRP标记的 II 抗(羊抗小鼠或羊抗兔IgG 1∶2 000),室温孵育1 h。 TBST漂洗3次(每次5 min)。滴加ECL,在Protein Simple化学发光成像系统中,选取适当时间曝光并拍照。
3统计学处理
采用SPSS 13.0 统计软件进行数据处理。所有数据均以均数±标准差(mean±SD)表示,各组间数据比较采用单因素方差分析,以P<0.05表示差异有统计学意义。
结 果
1胰腺组织病理学变化及纤维化程度
如图1、2所示,雌、雄对照组小鼠胰腺小叶及导管结构正常;雌性小鼠在造模后2周仅见胰腺轻度间质水肿、少量炎症细胞浸润,而雄性小鼠除大量胰腺组织萎缩、坏死及炎症细胞浸润外,还可见少量胶原纤维的沉积;雄性小鼠在造模后4和6周时胰腺损伤进一步加重,可见腺泡萎缩形成管状化,胰腺组织结构大面积消失,被胶原纤维所取代,而雌性小鼠的胰腺损伤程度明显轻于雄性小鼠,造模后6周仅见少量胰腺腺泡细胞萎缩、纤维化沉积及炎细胞浸润。

Figure 1. The pancreatic morphology of the mice induced by 20% L-arginine (HE staining, ×100).
图1胰腺组织的病理学改变
2胰腺组织α-SMA的表达
如图3所示,与造模前相比较,造模后2周雄性CP组胰腺α-SMA的mRNA表达水平明显升高,而雌性CP组无明显变化。造模后4和6周,雄性CP组胰腺α-SMA mRNA的表达较2周时有所下降,但仍维持较高水平;雌性CP组α-SMA的mRNA表达则较2周明显升高,但其表达水平仍低于同时点的雄性CP组(P<0.05)。

Figure 2. The degree of fibrosis in pancreatic tissues (Masson staining, ×100).
图2胰腺组织的纤维化程度改变

Figure 3. The mRNA expression of α-SMA in the pancreas of mice. Mean±SD.n=6.*P<0.05,**P<0.01vsfemale group;#P<0.05,##P<0.01vssame-sex control group.
图3各组胰腺组织α-SMAmRNA表达的变化
如图4所示,在造模后2周,雌、雄CP组α-SMA的蛋白表达均未见明显升高,但在造模后4和6周α-SMA的蛋白水平则随着病程进展明显升高,雄性小鼠的α-SMA的蛋白表达水平明显高于同时点的雌性小鼠(P<0.05)。
3胰腺组织FN的表达变化
如图5所示,与造模前相比较,在造模后2周雄性CP组胰腺FN的mRNA表达水平即开始升高,至6周时急剧升高;而雌性CP组胰腺FN的mRNA表达水平虽较对照组有所升高,但与同时点的雄性CP组相比较仍明显较低(P<0.01)。

Figure 4. The protein level of α-SMA in the pancreas of mice. Mean±SD.n=6.**P<0.01vsfemale group;#P<0.05,##P<0.01vssame-sex control group.
图4各组胰腺组织α-SMA蛋白表达的变化
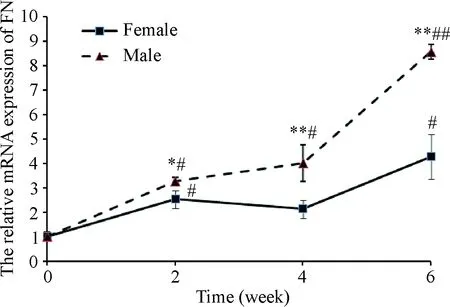
Figure 5. The mRNA expression of FN in the pancreas of mice. Mean±SD.n=6.*P<0.05,**P<0.01vsfemale group;#P<0.05,##P<0.01vssame-sex control group.
图5各组胰腺组织FNmRNA表达的变化
如图6所示,在造模后2周,雌、雄组胰腺FN的蛋白表达水平均未见明显变化,随着造模时间的延长,FN的蛋白表达水平有所升高,尤其是在造模后6周雄性组小鼠FN的蛋白表达明显高于同时点的雌性组小鼠(P<0.01)。
4胰腺组织巨噬细胞浸润
如图7所示,空白对照组胰腺组织结构良好,无炎症细胞的浸润,故未见巨噬细胞表面标志物F4/80阳染表达。复制CP模型后,可见胰腺组织F4/80阳染的巨噬细胞数量增加,尤以雄性组小鼠明显;雄性小鼠在造模后4和6周胰腺组织可见大量F4/80阳染的巨噬细胞,明显高于雌性小鼠。
5胰腺组织IL-6的mRNA表达
如图8所示,与造模前相比较,造模后2周,雌、雄小鼠胰腺IL-6的mRNA表达水平均明显升高,但雄性小鼠的表达水平显著高于雌性小鼠(P<0.01)。
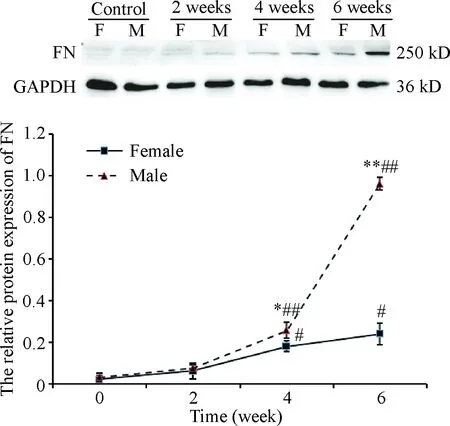
Figure 6. The protein level of FN in the pancreas of mice. Mean±SD.n=6.*P<0.05,**P<0.01vsfemale group;#P<0.05,##P<0.01vssame-sex control group.
图6各组胰腺组织FN蛋白表达的变化
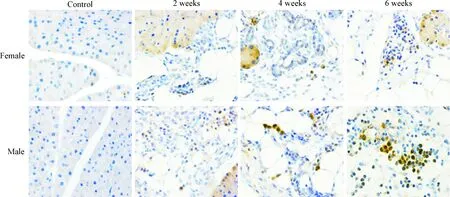
Figure 7. F4/80 activity in the pancreas of mice with chronic pancreatitis (IHC, ×400).
图7各组胰腺组织F4/80表达的变化
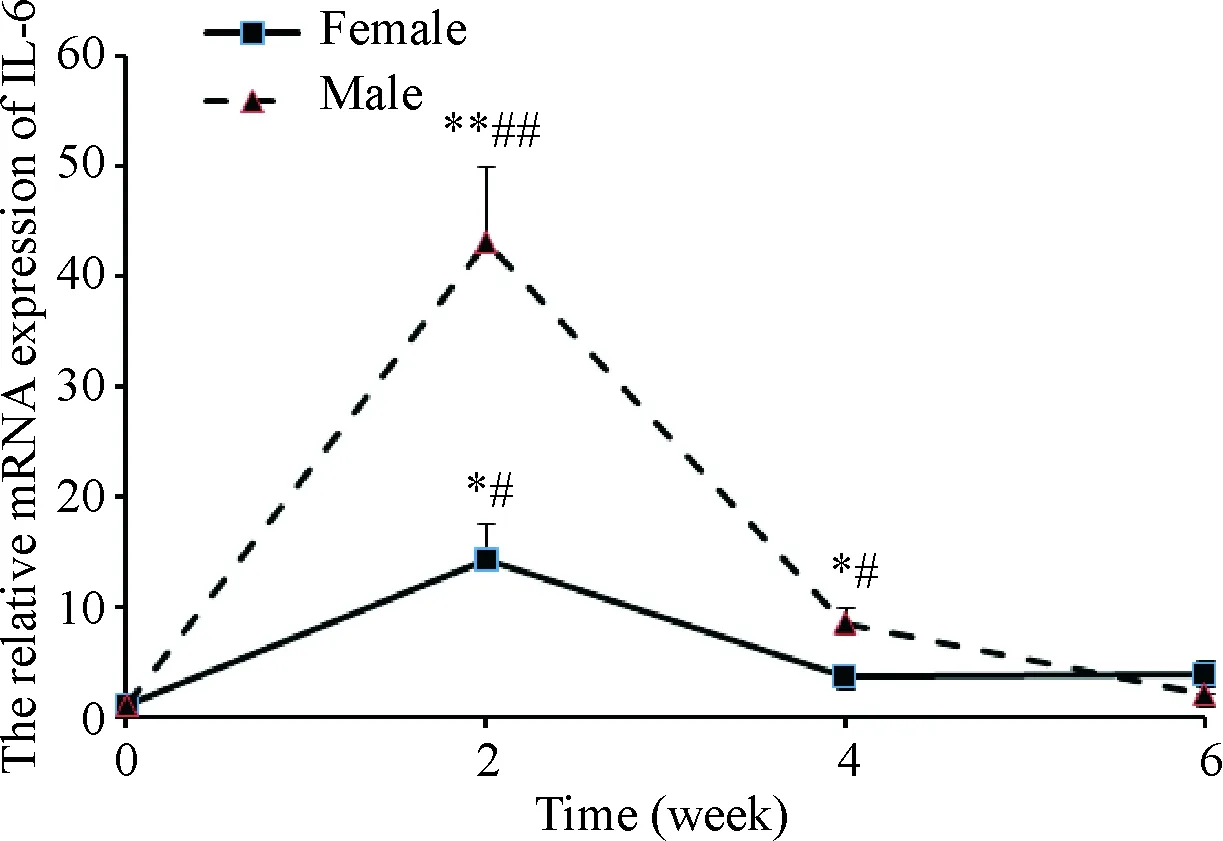
Figure 8. The mRNA expression of IL-6 in the pancreas of mice. Mean±SD.n=6.*P<0.05vsfemale group;#P<0.05vssame-sex control group.
图8各组胰腺组织IL-6mRNA表达的变化
在造模后4周,2组小鼠IL-6的mRNA水平均有所下降,但雄性小鼠的表达水平仍明显高于雌性小鼠(P<0.05)。
讨 论
L-精氨酸是一氧化氮(nitric oxide,NO)的生成底物,可通过减少多胺合成,抑制核酸和蛋白质的产生[5-6]。Tani等[7]首次发现腹腔注射L-精氨酸可以造成胰腺腺泡细胞的损伤,后续的研究对其原因进行分析认为:一方面L-精氨酸可能通过抑制胰腺腺泡细胞蛋白质合成损害细胞;另一方面L-精氨酸可能通过促进NO合成,引起血管扩张和胰腺低灌注,导致胰腺发生缺血坏死及炎症反应[5,8-9]。大量研究证实,L-精氨酸可诱发胰腺急性炎症反应,已被广泛用于复制AP动物模型[2-3,10]。胰腺纤维化是CP发病的中心环节,有研究认为胰腺纤维化发生的重要原因与反复发作的坏死性炎症反应有关[11],而L-精氨酸所复制的AP模型可见胰腺组织的炎症和坏死发生,学者们近年来也开始尝试将其用于CP动物模型的复制,经多项研究证实,反复多次腹腔注射L-精氨酸能够诱发胰腺的慢性炎症和纤维化,是复制小鼠CP动物模型的可靠方法[4,12]。然而我们在前期的研究中多次反复采用L-精氨酸复制小鼠CP模型,发现L-精氨酸腹腔注射诱发的胰腺损害程度在不同个体间存在明显的差异,模型病变不够均一。搜寻其原因,发现L-精氨酸造模后6周雄性小鼠胰腺纤维化的程度似乎明显超过雌性小鼠。那么,L-精氨酸复制的小鼠CP胰腺损伤程度是否存在性别差异值得深入研究。
为了探明CP进展过程中性别对其病程的影响,我们采用相同周龄健康昆明小鼠,观察造模后2周、4和6周雌雄小鼠胰腺损伤程度及炎症反应的变化。研究发现,雌雄空白对照组小鼠胰腺小叶及导管结构正常,在造模后2周,雌性小鼠仅见胰腺轻度间质水肿、少量炎细胞浸润,而雄性小鼠除了大量胰腺组织萎缩、坏死及炎性细胞浸润外,还可见少量胶原纤维的沉积。造模后4周、6周雄性小鼠的胰腺损伤进一步加重,可见腺泡萎缩形成管状化结构,胰腺组织结构大面积消失,被胶原纤维所取代。雌性小鼠的胰腺损伤程度明显轻于雄性小鼠,在造模后6周仅见少量腺泡细胞萎缩、纤维化沉积,及胰腺炎细胞浸润。近年来的研究显示,胰腺纤维化的本质就是细胞外基质(extracellular matrix, ECM)的过度沉积,而ECM的生成与胰腺星状细胞(pancreatic stellate cell,PSC)活化密切相关[13-15]。PSC活化后的主要表现为[16-17]: 细胞体积变大,增殖活跃,细胞内脂滴消失; 表达α-SMA;产生ECM,如I型、III型胶原蛋白和FN等。已有大量研究证实PSC在胰腺纤维化中的核心地位,指出胰腺纤维化程度与PSC的活化程度呈正相关[18]。本研究亦发现,雄性小鼠造模后胰腺组织α-SMA和FN的mRNA和蛋白质表达水平均明显增高,与雌性小鼠相比表达时点更早,随着造模时间的延长,其表达水平更高。故提示L-精氨酸诱导的CP模型在雄性小鼠纤维化出现更早,病变程度更严重。而流行病学研究亦显示,CP多见于40岁以上患者,发病率在不同性别存在明显差异,男性发病率明显高于女性,达3.38∶1[19]。
其实性别差异在很多疾病的动物模型均有存在,许君望等[20]采用四氯化碳诱导大鼠肝纤维化动物模型,发现雌、雄大鼠对CCl4致肝纤维化的反应性存在明显差别,雌性大鼠的反应性明显弱于雄性大鼠。在小鼠急性肝损伤动物模型的研究中,谢湘媚等[21]发现雄性小鼠对CCl4诱导急性肝损伤的耐受性低于雌性小鼠。张琪娟等[22]采用蛋氨酸和胆碱缺乏饮食诱导昆明小鼠非酒精性脂肪肝炎模型,发现雄性小鼠肝损伤程度更为严重,存在明显性别差异,尤其体现在炎症反应上。进一步分析雌雄小鼠CP成模程度差异的原因,我们发现在造模后2周、4周雄性小鼠胰腺巨噬细胞表面标志物F4/80免疫组化的阳染率明显高于雌性小鼠,而胰腺IL-6的mRNA表达水平在雄性小鼠造模后2周亦明显升高,与同时点雌性小鼠比较存在非常显著差异,提示雄性小鼠在造模后早期胰腺组织就有炎细胞大量浸润,引发更加严重的炎性反应。
综上所述,L-精氨酸腹腔注射给药方式简单、价格相对低廉,且可以成功诱发小鼠胰腺纤维化,是一种可靠的CP造模方式。但本研究发现L-精氨酸所诱发的CP在雌雄小鼠存在差异,主要表现为胰腺组织炎症损伤、腺泡萎缩及胰腺间质纤维化程度的差异,这一差异可能与促炎因子IL-6表达上调,加强炎症反应的同时促进PSC活化有关。由于L-精氨酸诱导的CP在昆明小鼠存在明显的性别差异,提示我们:在进行药物疗效评价的相关实验研究中,应选择同种性别的小鼠,以免因性别不同造成动物间模型程度的差异,影响药物疗效评价的客观性。鉴于雄性小鼠可能对L-精氨酸更敏感,引发的胰腺炎症反应及纤维化程度出现更早、更明显,认为雄性小鼠更适用于L-精氨酸复制CP动物模型,建议最好选择雄性小鼠进行治疗对比实验,更有利于对CP治疗药物的疗效评价。
[1] Stram M, Liu S, Singhi AD. Chronic pancreatitis[J]. Surg Pathol Clin, 2016, 9(4):643-659.
[2] Hegyi P, Rakonczay Z Jr, Sari R, et al. L-arginine-induced experimental pancreatitis[J]. World J Gastroenterol, 2004, 10(14):2003-2009.
[3] 张晓芹, 贾晓云, 李 涛, 等. 清胰汤对L-精氨酸诱发的重症急性胰腺炎小鼠胰腺p-STAT3表达的影响[J]. 中国病理生理杂志, 2011, 27(11):2175-2179.
[4] 沈佳庆, 王兴鹏. 左旋精氨酸诱导小鼠慢性胰腺炎模型的建立[J]. 胃肠病学和肝病学杂志, 2011, 20(11):1010-1012.
[5] 赖铭裕, 梁志海, 唐国都, 等. 腹腔注射左旋精氨酸诱导急性坏死性胰腺炎大鼠模型[J]. 世界华人消化杂志, 2006, 14(22):2233-2236.
[6] 孙保亮, 张苏明, 夏作理, 等. 一氧化氮与脑血管痉挛性神经元损伤和L-精氨酸的作用[J]. 中国病理生理杂志, 2004, 20(1):77-80.
[7] Tani S, Itoh H, Okabayashi Y, et al. New model of acute necrotizing pancreatitis induced by excessive doses of arginine in rats[J]. Dig Dis Sci, 1990, 35(3):367-374.
[8] Hishikawa K, Nakaki T, Suzuki H, et al. Role of L-arginine-nitric oxide pathway in hypertension[J]. J Hypertens, 1993, 11(6):639-645.
[9] Sakuma I, Stuehr DJ, Gross SS, et al. Identification of arginine as a precursor of endothelium-derived relaxing factor[J]. Proc Natl Acad Sci U S A, 1988, 85(22):8664-8667.
[10] 张晓芹, 贾晓云, 史迎莉, 等. 灯盏花素通过抑制MCP-1的表达对L-精氨酸诱发重症急性胰腺炎小鼠的治疗作用研究[J]. 中国现代医学杂志, 2013, 23(35):17-21.
[11] Manohar M, Verma AK, Venkateshaiah SU, et al. Pathogenic mechanisms of pancreatitis[J]. World J Gastroin-test Pharmacol Ther, 2017, 8(1):10-25.
[12] Hu N, Shen Y, Liu F, et al. Morphological and immunobiochemical analysis of the liver in L-arginine induced experimental chronic pancreatitis[J]. Pancreatology, 2017, 17(2):247-254.
[13] 陈碧君, 孙子林, 李凤飞, 等. 胰腺星状细胞活化相关的信号转导通路[J]. 生命科学, 2012, 24(6):583-587.
[14] Apte MV, Pirola RC, Wilson JS. Pancreatic stellate cells: a starring role in normal and diseased pancreas[J]. Front Physiol, 2012, 3:344.
[15] Apte M, Pirola RC, Wilson JS. Pancreatic stellate cell: physiologic role, role in fibrosis and cancer[J]. Curr Opin Gastroenterol, 2015, 31(5):416-423.
[16] Bachem MG, Schneider E, Gross H, et al. Identification, culture, and characterization of pancreatic stellate cells in rats and humans[J]. Gastroenterology, 1998, 115(2):421-432.
[17] Masamune A, Shimosegawa T. Signal transduction in pancreatic stellate cells[J]. J Gastroenterol, 2009, 44(4):249-260.
[18] Apte M, Pirola R, Wilson J. The fibrosis of chronic pancreatitis: new insights into the role of pancreatic stellate cells[J]. Antioxid Redox Signal, 2011, 15(10):2711-2722.
[19] Yadav D, Lowenfels AB. The epidemiology of pancreatitis and pancreatic cancer[J]. Gastroenterology, 2013, 144(6):1252-1261.
[20] 许君望, 王 云, 龚 均, 等. 实验性肝纤维化形成的性别差异及雌激素的作用[J]. 胃肠病学和肝病学杂志, 2008, 17(6):496-499.
[21] 谢湘媚, 刘志伟, 林少宾, 等. 四氯化碳致小鼠急性肝损伤的性别差异及其与雄激素受体表达的关系[J]. 解剖学研究, 2007, 29(6):417-419.
[22] 张琪娟, 李继斌, 肖晓秋, 等. 蛋氨酸和胆碱缺乏饮食诱导非酒精性脂肪肝炎的作用及性别差异[J]. 上海交通大学学报: 医学版, 2014, 34(1):30-35.
