姜黄素对肺炎链球菌诱导BEAS-2B细胞SLPI、TNF-α和IL-1β表达的影响*
2018-03-01李海燕温顺航张海邻李昌崇
余 璐, 林 立, 李海燕, 温顺航, 张海邻, 李昌崇
(温州医科大学附属第二医院, 育英儿童医院, 浙江 温州 325027)
肺炎链球菌(Streptococcuspneumoniae,SP)是儿童社区获得性肺炎的最常见病原细菌。肺炎链球菌肺炎的严重度与细菌表面毒力因子及宿主自身免疫反应密切相关。
分泌型白细胞蛋白酶抑制因子(secretory leukocyte protease inhibitor,SLPI)存在于上皮细胞,包括气管和支气管上皮细胞及肺泡II型上皮细胞,是一种非糖基化单链多肽蛋白,具有抗菌、抗病毒和抗炎等多方面生物学活性[1]。有研究表明,姜黄素(curcumin,Cur)具有抑菌、抗炎和抗氧化等多种生物学活性,在细菌感染性疾病中有治疗潜能,但Cur在溶液中稳定性低,因而生物学活性受影响,而其衍生物Y20(C21H16BrF3O)和6B(C26H25NO7)稳定性高,克服了姜黄素这一缺点。目前SP感染后SLPI的分泌情况及Cur及其衍生物Y20和6B对SLPI表达的影响尚无定论。本研究通过建立SP体外感染模型,以Cur、Y20和6B预处理,在感染各时点检测SLPI、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、白细胞介素1β(interleukin-1β,IL-1β)、Toll样受体2(Toll-like receptor 2,TLR2)和核因子κB(nuclear factor-κB,NF-κB)p65的水平,探讨Cur及其衍生物对SP感染时SLPI、TNF-α和IL-1β表达的调控及可能机制,同时比较3种药物对SP感染后SLPI、TNF-α和IL-1β表达的不同影响。
材 料 和 方 法
1实验材料
1.1细胞与细菌 肺炎链球菌购自美国模式培养物集存库(American Type Culture Collection,ATCC)。人支气管上皮细胞BEAS-2B 购自中科院上海细胞生物研究所细胞库。
1.2主要试剂 澳洲胎牛血清、DMEM高糖培养基、0.25%胰蛋白酶、0.02% EDTA溶液、链/青霉素、二甲基亚砜(dimethyl sulfoxide,DMSO)和磷酸盐缓冲液(phosphate buffer saline,PBS)等购自Thermo Fisher Scientific;抗NF-κB p65和TLR2抗体购自Cell Signaling Technology;人TNF-ɑ和IL-1β ELISA定量试剂盒购自上海西塘有限公司;TRIzol试剂购自Invitrogen;逆转录试剂盒购自TaKaRa;哥伦比亚血琼脂平板购自温州康泰生物科技有限公司;姜黄素、Y20和6B由温州医科大学药学院梁广教授馈赠。PCR引物由上海捷瑞生物工程有限公司设计合成。
2实验方法
2.1体外感染模型建立 用0.25%胰蛋白酶消化贴壁培养的BEAS-2B细胞,用含10%胎牛血清的完全培养基制成单细胞悬液,以3×108/L密度铺于6孔板,实验分为空白对照(control)组、SP感染(SP)组和药物干预组(分别为Cur、Y20和6B组),置于恒温培养箱内培养1 d(37 ℃、5% CO2)。待细胞生长汇聚至80%左右时,换无双抗的完全培养基,空白对照组和SP感染组加入1‰ DMSO,药物干预组分别加入浓度为10 μmol/L的Cur、Y20和6B预处理6 h。3种药物皆使用DMSO溶解,分别配置浓度为10 μmol/L,最终使各处理组培养液中DMSO浓度固定为1‰。根据感染复数(multiple of infection,MOI)=20在每组中加入吸光度(A)为0.5的SP菌悬液(1.5×108CFU),置于细菌培养箱中培养1、3、6和9 h。
2.2qPCR检测BEAS-2B细胞SLPI、TNF-α和IL-1β的mRNA相对表达 取体外感染模型,弃去培养液,每孔加入1 mL TRIzol提取RNA,按逆转录试剂盒说明书逆转成cDNA,进行qPCR检测。配制成10 μL的体系,包括cDNA 1 μL、SYBR 5 μL、上下游引物各1 μL及DEPC水2 μL。反应体系为95 ℃ 5 min;95 ℃ 10 s、60 ℃ 10 s、72 ℃ 10 s,进行45个循环。每组设置3个复孔,各时点实验独立重复3次,数据分析采用2-ΔΔCt法分析。引物序列见表1。
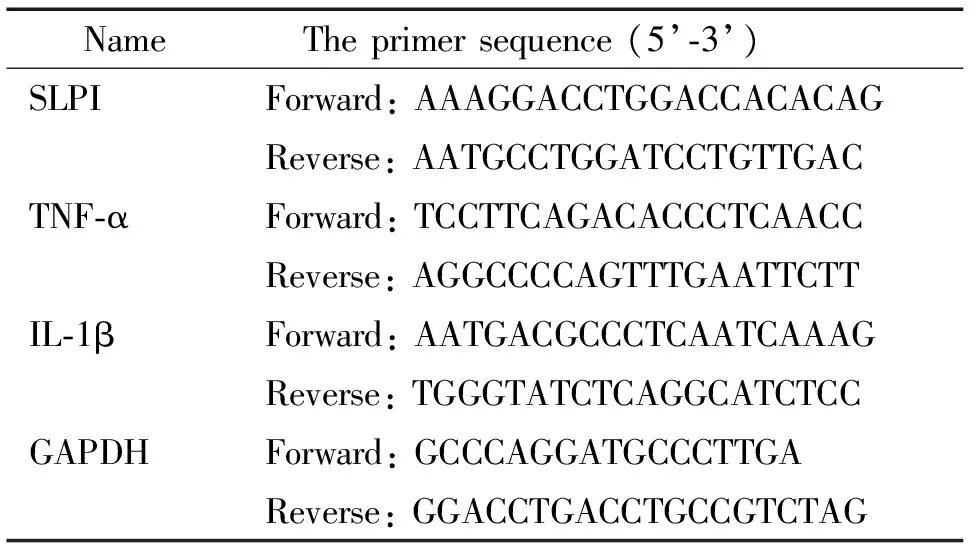
表1 qPCR的引物序列
2.3ELISA法检测BEAS-2B细胞TNF-α和IL-1β的蛋白含量 收集不同感染时间的细胞培养液,离心取上清后按说明书测定TNF-α和IL-1β蛋白表达量,采用多功能酶标仪于450 nm处测A值,绘制标准曲线,根据吸光度值换算TNF-α和IL-1β含量。每组设3个复孔,实验独立重复3次。
2.4Western blot检测细胞BEAS-2B TLR2和NF-κB p65蛋白的水平 收取不同感染时间的细胞,弃去培养液,PBS清洗3遍后,每孔加入70 μL裂解液于冰上裂解20 min。超声,离心,配制20 μL体系,100 ℃变性10 min,8% SDS-PAGE,转膜,5%脱脂牛奶封闭2 h,TBST洗膜3次,每次5 min,加入1∶500稀释的抗TLR2抗体和1∶1 000稀释的抗NF-κB p65抗体4 ℃孵育16~18 h,次日取出,TBST洗膜,加入1∶5 000稀释的II抗,室温摇床孵育2 h,再次洗膜后,进行曝光、显色。
3统计学处理
采用GraphPad Prism 6进行数据处理和作图,实验数据利用SPSS 19.0进行统计学分析。实验数据以均数±标准差(mean±SD)表示,进行方差齐性检验,多组均数间的比较采用单因素方差分析,各组均数间的两两比较用SNK-q检验。以P<0.05为差异有统计学意义。
结 果
1SP诱导BEAS-2B细胞表达SLPI及Cur、Y20和6B对SLPI表达的影响
SP感染组SLPI的mRNA表达随感染时间增加有所不同,感染时间为1 h和3 h时,SLPI的mRNA表达较对照组增加(P<0.05),6 h表达量反而降低,而后随着感染时间的增加而增加(P<0.05);Cur、Y20和6B干预组SLPI的mRNA表达也随着感染时间的变化发生类似变化,但其SLPI的mRNA表达水平较SP感染组均有上升,其中感染3 h时Cur干预组SLPI表达量增加最为明显(P<0.05), 6B干预6 h组增加明显(P<0.05), Y20干预9 h组增加明显(P<0.05),见表2。
表2肺炎链球菌感染BEAS-2B细胞不同时间及不同药物处理后SLPI的mRNA表达变化
Table 2. The mRNA expression of SLPI in BEAS-2B cells incubated with SP for different time and with different treatments (Mean±SD.n=4)

Group1h3h6h9hControl1111SP1.845±0.179∗1.465±0.065∗1.145±0.0792.241±0.210∗Cur1.466±0.0382.050±0.122#1.569±0.136△2.302±0.226Y201.881±0.1451.697±0.1801.254±0.066△3.036±0.438#6B1.395±0.1581.015±0.0541.908±0.392#2.388±0.199
*P<0.05vscontrol group;#P<0.05vsSP group;△P<0.05vs6B group.
2SP诱导BEAS-2B细胞TNF-α和IL-1β的表达及Cur、Y20和6B的作用
检测BEAS-2B细胞在SP感染3、6和9 h 后TNF-α和IL-1β的mRNA和蛋白表达,其中 SP感染组的TNF-α在感染不同时点较对照组相比均有所增加,且在感染6 h时表达水平最高(P<0.05);Cur、Y20和6B处理组的TNF-α表达较感染组相比明显下降(P<0.05)。SP感染组的IL-1β表达较对照组上调,药物处理后表达有较明显的下降,且以6B预处理组的TNF-α和IL-1β下降最为明显(P<0.05),见表3、4。
表3肺炎链球菌感染BEAS-2B细胞不同时间及不同药物处理后TNF-α的mRNA和蛋白表达变化
Table 3. The expression of TNF-α at mRNA and protein levels in the BEAS-2B cells incubated with SP for different time and with different treatments (Mean±SD.n=4)
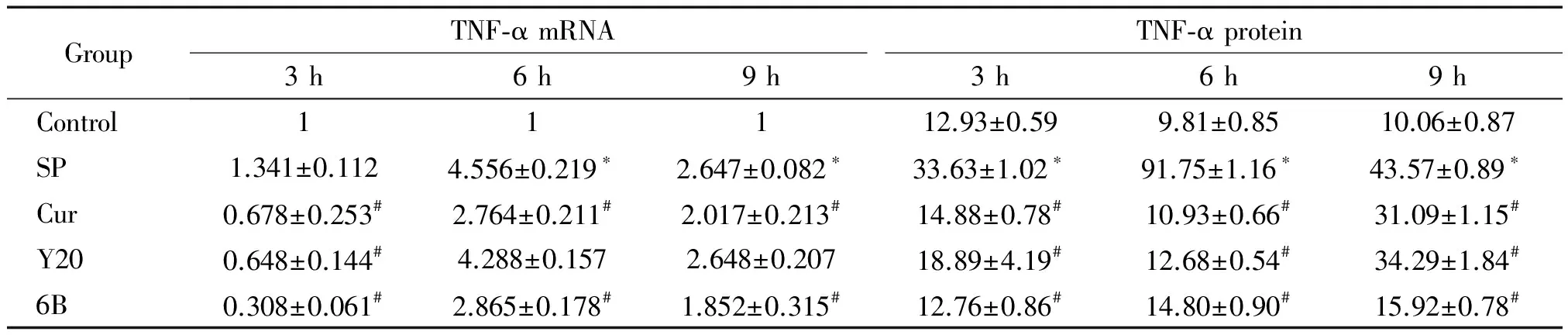
GroupTNF⁃αmRNATNF⁃αprotein3h6h9h3h6h9hControl11112.93±0.599.81±0.8510.06±0.87SP1.341±0.1124.556±0.219∗2.647±0.082∗33.63±1.02∗91.75±1.16∗43.57±0.89∗Cur0.678±0.253#2.764±0.211#2.017±0.213#14.88±0.78#10.93±0.66#31.09±1.15#Y200.648±0.144#4.288±0.1572.648±0.20718.89±4.19#12.68±0.54#34.29±1.84#6B0.308±0.061#2.865±0.178#1.852±0.315#12.76±0.86#14.80±0.90#15.92±0.78#
*P<0.05vscontrol group;#P<0.05vsSP group.
表4肺炎链球菌感染BEAS-2B细胞不同时间及不同药物处理后IL-1β的mRNA及蛋白表达变化
Table 4. The expression of IL-1β at mRNA and protein levels in the BEAS-2B cells incubated with SP for different time and with different treatments (Mean±SD.n=4)
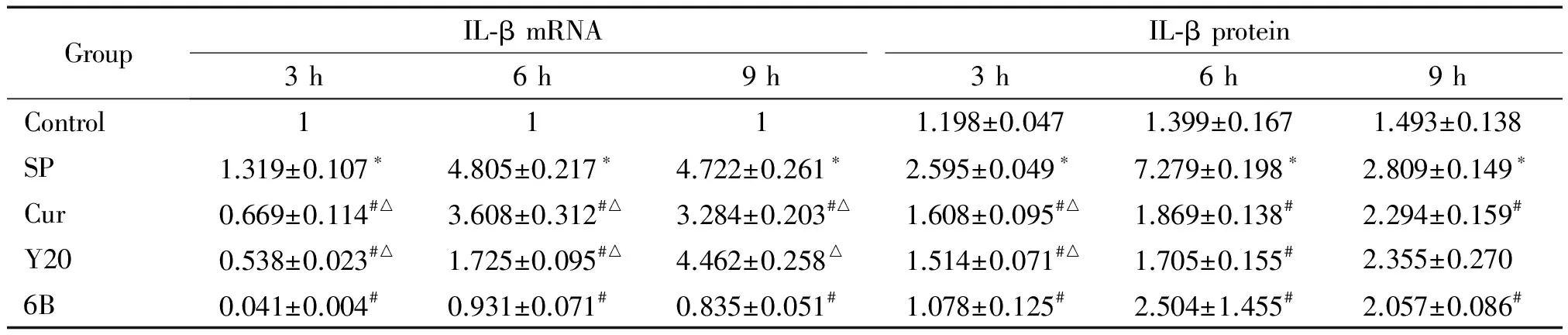
GroupIL⁃βmRNAIL⁃βprotein3h6h9h3h6h9hControl1111.198±0.0471.399±0.1671.493±0.138SP1.319±0.107∗4.805±0.217∗4.722±0.261∗2.595±0.049∗7.279±0.198∗2.809±0.149∗Cur0.669±0.114#△3.608±0.312#△3.284±0.203#△1.608±0.095#△1.869±0.138#2.294±0.159#Y200.538±0.023#△1.725±0.095#△4.462±0.258△1.514±0.071#△1.705±0.155#2.355±0.2706B0.041±0.004#0.931±0.071#0.835±0.051#1.078±0.125#2.504±1.455#2.057±0.086#
*P<0.05vscontrol group;#P<0.05vsSP group;△P<0.05vs6B group.
3SP诱导BEAS-2B细胞TLR2和p-NF-κBp65表达及Cur、Y20和6B的作用
检测BEAS-2B细胞在不同感染时段TLR2和p-NF-κB p65蛋白水平的变化,结果显示,感染3、6和9 h时,SP感染组TLR2和p-NF-κB p65的蛋白水平高于正常对照组(P<0.05);Cur组、Y20组和6B组TLR2和p-NF-κB p65的蛋白水平较 SP感染组有所下降(P<0.05),且在同一感染时点,6B组TLR2的蛋白水平下降程度较Cur组和Y20组更明显,在感染9 h,6B组p-NF-κB p65的蛋白水平下降较Cur组和Y20组尤为显著(P<0.05),见图1~3。
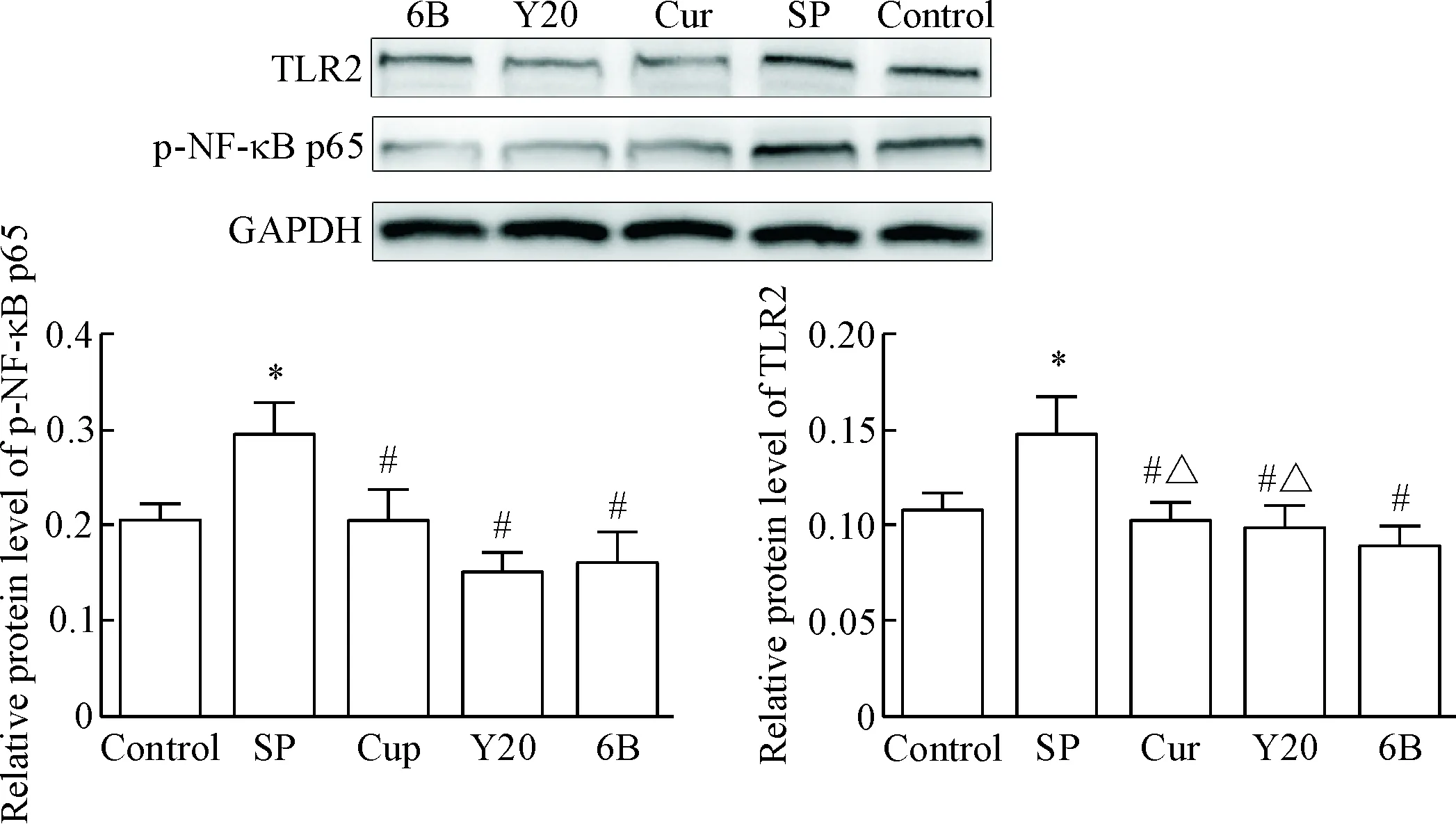
Figure 1. The protein levels of TLR2 and p-NF-κB p65 in the BEAS-2B cells infected with SP for 3 h. Mean±SD.n=5.*P<0.05vscontrol group;#P<0.05vsSP group;△P<0.05vs6B group.
图1肺炎链球菌感染BEAS-2B细胞3hTLR2和p-NF-κBp65的蛋白水平变化
讨 论
SP长期定植于人体鼻咽部,是5岁以下儿童社区获得性肺炎的首要细菌病原。有报道,发展中国家平均每年有近10万小于5岁的儿童死于肺炎链球菌引起的肺炎、脑膜炎和脓毒血症等疾病[2-3]。近年来多重耐药菌的出现及儿童用药的特殊性,使得抗生素的选择越来越局限,新型抗菌药物或增强抗菌肽抗菌能力的制剂已引起越来越多的关注。SLPI是人体固有抗菌肽,在抵御病原菌入侵具有重要作用。姜黄素经常被用于细菌性疾病的治疗,而众多研究证实,姜黄素及其衍生物在抑制细菌生长及治疗细菌性疾病中是有潜力的。但姜黄素水溶性差,在溶液中的稳定性低,其衍生物Y20(C21H16BrF3O)是在姜黄素结构基础上去除β-二酮结构的衍生物,6B(C26H25NO7)则是在其基础上加入氮杂白藜芦醇,稳定性相对较高,生物学活性较好。本研究选择Cur及其衍生物Y20和6B作为干预药物,观察3种药物对SP感染BEAS-2B细胞SLPI、TNF-α和IL-1β的影响,以期筛选出抗SP感染效应较优的药物。本实验通过建立SP体外感染模型,以Cur、Y20和6B预处理,探讨SP感染时SLPI、TNF-α和IL-1β表达水平及Cur、Y20和6B对SLPI、TNF-α和IL-1β等表达调控及可能机制。
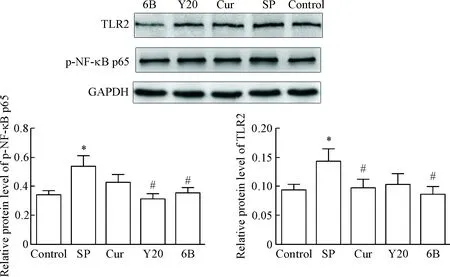
Figure 2. The protein levels of TLR2 and p-NF-κB p65 in the BEAS-2B cells infected with SP for 6 h. Mean±SD.n=5.*P<0.05vscontrol group;#P<0.05vsSP infection group.
图2肺炎链球菌感染BEAS-2B细胞6hTLR2和p-NF-κBp65的蛋白水平变化
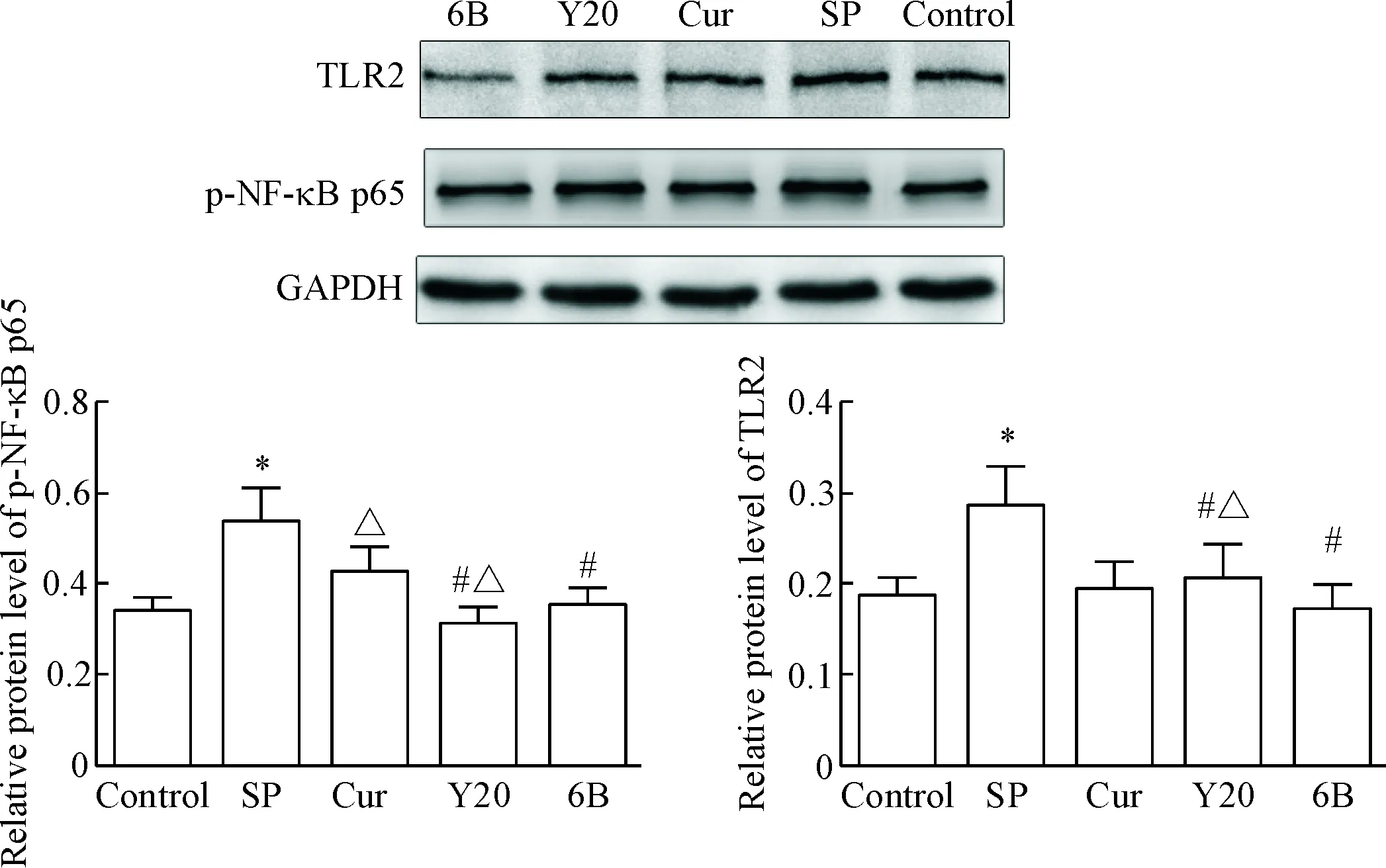
Figure 3. The protein levels of TLR2 and p-NF-κB p65 in the BEAS-2B cells infected with SP at 9 h. Mean±SD.n=5.*P<0.05vscontrol group;#P<0.05vsSP group;△P<0.05vs6B group.
图3肺炎链球菌感染BEAS-2B细胞9hTLR2和p-NF-κBp65的蛋白水平
1SP诱导BEAS-2B细胞表达SLPI
SLPI作为上呼吸道固有的抗菌肽之一,在宿主抗感染的固有免疫反应中起重要作用[4]。有研究指出SLPI能减少大肠埃希菌、金黄色葡萄球菌、结核杆菌以及淋病奈瑟菌的生长繁殖,起抵御病原菌入侵作用,而且SLPI还可减轻病原菌引起的炎症及组织损伤[5]。
本研究以SP感染BEAS-2B细胞,qPCR结果显示,BEAS-2B细胞的SLPI表达均有所升高,表明SP能诱导BEAS-2B细胞表达SLPI,在感染1 h时SLPI的表达呈上升趋势,但随着感染时间增加,SLPI的表达呈下降趋势,稍高于对照组,在早期对细胞起一定的保护作用。相关研究指出,LPS、TNF-α和IL-1β等可以促进SLPI的表达[6],另有研究表明,SLPI也可以通过减少细胞炎症因子如TNF-α和IL-1β等的分泌,减轻炎症反应[7],而感染至9 h时SLPI表达显著增加,这可能与随着感染时间的增加,SP感染所致的炎症反应显著加强,炎症介质释放增加有关。
2Cur、Y20和6B促进BEAS-2B细胞表达SLPI,减轻炎症反应
姜黄素自1910年从姜科植物根茎中分离提纯出后被证实具有抗菌、抗炎、抗氧化、抗肿瘤和抗病毒等多种生物学活性[8]。研究表明姜黄素及其衍生物能抑制众多由感染及非感染性疾病引起的炎症因子、趋化因子和炎症蛋白酶等的表达。Peter等[9]指出姜黄素及其衍生物能够抑制埃博拉及其它病毒感染情况下单核细胞、巨噬细胞、人食管上皮细胞和肺泡上皮细胞等炎症因子如IL-1β、IL-6、IL-8、TNF-α、单核细胞趋化因子1(monocyte chemotactic protein-1,MCP-1)和巨噬细胞炎症蛋白1α(macrophage inflammatory protein-1α,MIP-1α)的分泌。Xu等[10]利用姜黄素治疗金黄色葡萄球菌感染所致小鼠急性肺损伤实验发现姜黄素能减少中性粒细胞的渗透及I型纤溶酶原激活物抑制因子的活性,降低炎症因子和趋化因子的分泌水平及肺组织损伤。刘绪华等[11]研究指出,姜黄素能减少β淀粉样蛋白25-35(amyloid β-protein,Aβ25-35)所致大鼠神经细胞中IL-1β和TNF-α的表达,显著抑制神经细胞的炎症反应。
本实验研究结果显示,感染3、6和9 h时Cur、Y20和6B干预组中IL-1β和TNF-α的表达较感染组相比有显著下降,提示Cur、Y20和6B能减少SP感染引起的炎症反应,尤以6B作用更为显著,感染1 h时IL-1β、TNF-α基本无变化,故未进行后续实验观察。与此同时,Cur、Y20和6B干预组在不同感染时间能不同程度地增加SLPI的表达,提示Cur、Y20和6B可能通过增加SLPI的表达抑制IL-1β和TNF-α分泌,减轻SP感染所致的炎症反应。
3TLR2表达的抑制可能增加SLPI的表达
TLR2在宿主对抗革兰阳性菌的固有免疫应答机制中具有重要作用,有研究指出,TLR2在清除和减少肺炎链球菌黏附及宿主防御免疫应答中至关重要[12]。姜黄素能抑制TLR2的表达并减轻后续炎症反应。Tu等[13]利用姜黄素治疗鼠脑缺血模型发现姜黄素可以抑制TLR2的表达,减少NF-κB的表达与活化,下调下游炎症因子如IL-1β和TNF-α的分泌。另有研究指出,姜黄素衍生物CMC2.24可作用于表面活性蛋白B(surfactant protein B,SP-B),减少炎症细胞的聚集,下调NF-κB的转录活性及基质金属蛋白酶的活性,减轻金黄色葡萄球菌引起的肺损伤,改善生存率[14]。
本研究结果显示,SP感染后BEAS-2B细胞的TLR2和pNF-κB p65蛋白水平较对照组增高,而Cur、Y20和6B干预后BEAS-2B细胞在感染3、6和9 h后 pNF-κB和TLR2的蛋白水平较感染组有不同程度的下降,以6B处理组下降明显,提示SP可激活TLR2信号通路,上调NF-κB的转录活性,Cur、Y20和6B能抑制TLR2的表达而下调NF-κB的活性,支持Tu等[13]的结论。
SLPI的表达受TLR2信号通路的调节[15]。有研究表明,SLPI能够抑制白细胞介素1受体相关激酶(interleukin-1 receptor-associated kinase,IRAK)、IκB(inhibitor of NF-κB)α 以及 IκBβ的激活而抑制NF-κB的转录活性,下调LPS诱导TNF-α及TLR诱导的细胞因子的表达[16]。Palm等[17]通过牙龈卟啉单胞菌体外感染实验指出TLR2基因沉默后SLPI的表达下降,表明SLPI的表达与TLR2息息相关。
本研究结果提示,SP诱导BEAS-2B细胞SLPI的表达随着感染时间的变化而变化,且Cur、Y20和6B预处理后SLPI的表达较SP感染组有不同程度的增加,而TLR2表达却有所减少,这与Palm等[17]的研究结果有所不同,可能与感染时间短,感染细菌类型不同有关。结合TLR2和p-NF-κB p65及炎症因子在不同感染时段及药物处理后的变化,提示SLPI可能通过对TLR2信号通路的调节,影响p-NF-κB p65及炎症因子的水平,表明SLPI可能通过与TLR2-NF-κB的相互作用参与SP感染引起的炎症反应的调控。
[1] Luo BL, Niu RC, Feng JT, et al. Downregluation of secretory leukocyte proteinase inhibitor in chronic obstructive lung disease: the role of TGF-β/Smads signaling pathways[J]. Arch Med Res, 2008, 39(4):388-396.
[2] Kadioglu A, Weiser JN, Paton JC, et al. The role of streptococcus pneumoniae virulence factors in host respiratory colonization and disease[J]. Nat Rev Microbiol, 2008, 6(4):288-301.
[3] Cripps AW, Leach AJ, Lenchmann D. Pneumococcal vaccination in developing countries[J]. Lancet, 2006, 368 (9526):644.
[4] Hiemstra PS, Amatngalim GD, van der Does AM, et al. Antimicrobial peptides and innate lung defenses: role in infectious and noninfectious lung diseases and therapeutic applications[J]. Chest, 2016, 149(2):545-551.
[5] Hannila SS. Secretory leukocyte protease inhibitor (SLPI): emerging roles in CNS trauma and repair[J]. Neuroscientist, 2014, 21(6):630-636.
[6] Reardon C, Lechmann M, Brüstle A, et al. Thymic stromal lymphopoetin induced expression of the endogenous inhibitory enzyme SLPI mediates recovery from colonic inflammation[J]. Immunity, 2011, 35(2):223-235.
[7] Henriksen PA, Hitt M, Xing Z, et al. Adenoviral gene delivery of elafin and secretory leukocyte protease inhibitor attenuates NF-κB-dependent inflammatory responses of human endothelial cells and macrophages to atherogenic sti-muli[J]. J Immunol, 2004, 172(7):4535-4544.
[8] Nquyen TA, Friedam AJ. Curcumin: a novel treatment for skin-related disorders[J]. J Drugs Dermatol, 2013, 12(10):1131-1137.
[9] Sordillo PP, Helson L. Curcumin suppression of cytokine release and cytokine storm. A potential therapy for patients with Ebola and other severe viral infections[J]. In Vivo, 2015, 29(1):1-4.
[10] Xu F, Diao R, Liu J, et al. Curcumin attenuatesStaphylococcusaureus-induced acute lung injury[J]. Clin Respir J, 2014, 9(1):87-97.
[11] 刘绪华, 王孝庆, 王中苏, 等. 姜黄素减弱Aβ25-35致大鼠原代小胶质细胞的神经炎症反应[J]. 中国病理生理杂志, 2016, 32(9):1635-1641.
[12] Echchannaoui H, Bachmann P, Letiembre M, et al. Re-gulation of streptococcus pneumoniae distribution by Toll-like receptor 2invivo[J]. Immunobiology, 2005, 210(2-4):229-236.
[13] Tu XK, Yang WZ, Chen JP, et al. Curcumin inhibits TLR2/4-NF-κB signaling pathway and attenuates brain damage in permanent focal cerebral ischemia in rats[J]. Inflammation, 2014, 37(5):1544-1551.
[14] Xu Y, Ge L, Abdel-Razek O, et al. Differential susceptibility of human SP-B genetic variants on lung injury caused by bacterial pneumonia and the effect of a chemically mo-dified curcumin[J]. Shock, 2016, 4(45):375-384.
[15] Ding A, Yu H, Yang J, et al.Induction of macrophage-derived SLPI byMycobacteriumtuberculosisdepends on TLR2 but not MyD88[J]. Immunology, 2005, 116(3):381-389.
[16] Greene CM,Mcelvaney NG,O’Neill SJ,et al. Secretory leucoprotease inhibitor impairs Toll-like receptor 2- and 4-mediated responses in monocytic cells[J]. Infect Immun, 2004, 72(6):3684-3687.
[17] Palm E, Demirel I, Bengtsson T, et al. The role of Toll-like and protease-activated receptors in the expression of cytokines by gingival fibroblasts stimulated with the periodontal pathogenPorphyromonasgingivalis[J]. Cytokine, 2015, 76(2):424-432.
