TTP减轻大鼠蛛网膜下腔出血后早期脑损伤*
2018-03-01陈朝晖洪溪屏
陈朝晖, 洪溪屏, 兰 频, 潘 锋
(丽水市中心医院急诊科, 浙江 丽水 323000)
蛛网膜下腔出血(subarachnoid hemorrhage,SAH)作为一种危害极其严重的神经系统疾病,其病死率和致残率非常高,大约12.4%的患者在出血后立即死亡,50%左右的幸存者遗留不同程度的神经功能障碍[1-2]。近年来研究表明,早期脑损伤(early brain injury,EBI)是SAH患者出现急性神经功能损害最主要的原因,脑细胞凋亡、脑水肿、炎性反应和血脑屏障损伤是早期脑损伤关键的病理改变,自SAH发生起持续72 h[3-4]。Tristetraprolin (TTP)作为串联CCCH(半胱氨酸-半胱氨酸-半胱氨酸-组氨酸)型锌指蛋白家族的成员,可在转录后水平调控白细胞介素(interleuklin,IL)-6、IL-33、核因子κB(nuclear factor-κB,NF-κB)和低氧诱导因子α(hypoxia-inducible factor-α,HIF-α)等多种细胞因子的表达[5],还参与了包括细胞分化、凋亡和癌变在内的诸多病理生理过程[6]。但TTP在SAH中作用尚不明确,本研究旨在探讨TTP在大鼠SAH后EBI中的作用机制,为临床SAH的防治提供实验依据。
材 料 和 方 法
1实验动物和分组
健康清洁级成年雄性SD大鼠116只, 体质量290~340 g,购自中科院上海动物实验中心,合格证号为SCXK(沪)2012-0002,所有动物实验均依照“NIH Guidelines of Care and Use of Laboratory Animals (2011)”标准进行,动物饲养于18~24 ℃恒温恒湿环境中,12 h/12 h光暗周期,实验动物均自由进食饮水。实验分为2部分,在第1部分实验中,56只大鼠经随机数字表法分为7组:sham组及SAH造模后0、12、24、48、72 h和1 周这6个时点组,每组8只;在第2部分实验中,60只大鼠被随机分成sham组、SAH组、SAH+对照质粒(vector)组和SAH+TTP组,每组15只,SAH+vector组和SAH+TTP组实验动物在SAH建模前经脑室注射对照质粒和TTP过表达质粒。在实验过程中,sham组大鼠无一例死亡,10只大鼠在SAH造模手术中死亡,死亡率为7.9%。
2主要实验仪器和试剂
外科手术器械由华东医药公司提供;LKB-2088型冰冻切片机由LKB提供;垂直转移电泳仪由Bio-Rad提供;组织匀浆仪器由Prosolution提供;自动恒温箱由山东菏泽生化仪器厂提供。
细胞蛋白提取试剂盒购自TaKaRa;大鼠TTP基因过表达慢病毒载体及阴性对照载体购自上海吉凯基因化学公司;ELISA试剂盒购自Bender MedSystems;抗TTP、Bax、Bcl-2、cleaved-caspase-3和β-actin抗体购自Epitomics。
3方法
3.1大鼠SAH模型建立 参考Bederson等[7]的血管内穿刺法制备大鼠SAH模型,应用10%水合氯醛对大鼠进行腹腔麻醉,置于实验台上固定,颈部皮肤备皮并消毒后于颈部正中纵向切开,显露右侧颈总动脉、颈外动脉和颈内动脉,用血管夹临时阻断颈总动脉和颈内动脉,在颈外动脉切一个小口,自切口将导管和钨丝插入颈外动脉,将导管缓缓推进至大脑前动脉和中动脉分叉处,将钨丝继续推进1~2 mm,穿破动脉建立SAH模型。Sham组大鼠进行相似手术操作,但不穿破动脉。手术结束后,将大鼠置于恒温箱内并标记。慢病毒液在SAH建模前24 h通过立体定向仪经右侧侧脑室注射。注射坐标为:向后1.0 mm,右侧旁开1.0 mm,深度为4.5 mm。慢病毒注射量为10 μL(浓度为1×1011TU/L),注射完成后继续留针5 min。
3.2IL-6和肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)的检测 严格按照ELISA试剂盒操作步骤进行,分别检测各组大鼠脑组织样本中IL-6和TNF-α的水平,用酶标仪测定650 nm波长处吸光度(A650),实验重复5次,取平均值。
3.3神经功能缺损的评价 在SAH造模48 h后根据Sugawara等[8]的评分方法对各组实验动物进行神经功能缺损评分。改良Garicia评分标准包括:自发活动、四肢对称运动、前掌运动、攀爬能力、身体本体感受及胡须刺激反应6个项目,每个项目0~3分,得分越高,表明神经功能缺损越轻。
3.4脑组织含水量的测定 每组大鼠各取5只在造模48 h后处死,断头取全脑组织,擦去表面血迹后称重(湿重),然后将脑组织放置于110 ℃烤箱内烘干72 h至恒重,并称量其干重,计算脑组织含水量,脑含水量(%)=(湿重-干重)/湿重×100%。
3.5脑血管通透性的测定 每组大鼠各取5只在处死前1 h经尾静脉注射2%的伊文思蓝(Evans blue,EB)溶液(5 mL/kg),全身循环1 h后开胸,去除心脏包膜后暴露心脏,用输液器针头刺入左心室并插入升主动脉,用弯钳固定,用生理盐水自左心室行心脏灌注,维持灌注压在100 mmHg左右,待灌注液为清亮液体后断头取脑组织,将左、右半脑组织称重后按10 mL/kg比例浸入甲酰胺溶液后匀浆,将匀浆液置入60 ℃恒温水浴箱内孵育24 h,待EB浸出后将浸出液于酶标仪630 nm波长处测定吸光度(A630)值,实验重复5次,取平均值。
3.6Western blot检测蛋白的表达 取各组大鼠颞叶皮质脑组织加入细胞裂解液中,置于冰上反应30 min,4 ℃条件下以12 000 r/min离心20 min,收集上清后使用BCA蛋白检测试剂盒对蛋白质浓度进行定量分析。蛋白质样品(30 μg)行10% SDS-PAGE后转移到0.45 μm的硝酸纤维素膜上,并使用5%脱脂奶粉于4℃下孵育过夜,该膜在4 ℃与 I 抗在室温下反应30min后,在室温下与 II 抗再次孵育1 h。以目的蛋白与内参照β-actin蛋白条带灰度值的比值来表示蛋白的相对表达量。
3.7TUNEL法检测脑细胞凋亡 各组大鼠脑组织石蜡切片经脱蜡水化,按TUNEL试剂盒说明书操作,切片经3%过氧化氢室温封闭15 min,滴加含0.1% Triton X-100的0.1%柠檬酸溶液于冰上反应3 min,每个样本滴加 50 μL TUNEL反应混合液,置于湿盒中37 ℃孵育1 h,再添加100 μg/L的DAPI核染8 min,置于荧光显微镜(OLYMPUS, BX51TF型)下选择视野拍片,凋亡细胞核为绿色,凋亡细胞的计数由一位对分组不了解的病理医师观察,每张切片随机计数5个视野。
4统计学处理
采用SPSS 17.0统计软件进行统计分析,数据均以均数±标准差(mean±SD)表示,多组样本均数之间比较采用单因素(one-way ANOVA)方差分析,各组均数间的两两比较用Bonferroni法,以P<0.05为差异有统计学意义。
结 果
1TTP在SAH大鼠中的表达
Western blot检测结果显示,与sham组相比较,TTP在SAH造模术后12 h开始下降(P<0.01),在SAH后48 h达到最低点,随着时间的延续,SAH造模1周后,TTP开始表达上调(P<0.05),见图1A;将慢病毒注射入大鼠脑室后,利用Western blot检测TTP在各组大鼠脑组织中的表达,与SAH+vector组相比较,SAH+TTP组脑组织中TTP蛋白的表达明显上调,差异有统计学意义(P<0.01),见图1B。

Figure 1. The changes of TTP protein expression in the brain tissues of SAH rats. A: the expression of TPP in the brain tissues after SAH determined by Western blot; B: the protein level of TTP in rat brains after transfected withTPPover-expression vector. Mean±SD.n=3.**P<0.01vssham group;##P<0.01vsSAH 0 h group;▲P<0.05vsSAH 48 h group;△△P<0.01vsSAH+vector group.
图1SAH大鼠脑组织中TTP表达的变化
2TTP对大鼠SAH后EBI的影响
ELISA法分析IL-6和TNF-α在各组脑组织中的表达,结果显示, IL-6和TNF-α在SAH组大鼠脑组织中的表达较sham组明显上调,差异有统计学意义(P<0.01);与SAH+vector组相比较,SAH+TTP组大鼠脑组织中IL-6和TNF-α的表达显著下降(P<0.05),见图2A、B。
如图2C所示,与sham组相比较,SAH组大鼠出现严重神经功能缺损的表现,Garcia评分显著降低(P<0.01);而SAH+TTP组大鼠神经缺损评分显著高于SAH+vector组,差异有统计学显著性(P<0.01)。
如图2D所示, SAH建模48 h后大鼠脑组织含水率较sham组上升(P<0.01);上调TTP在大鼠脑组织中的表达可显著降低脑组织含水率,与SAH+vector组相比较差异有统计学意义(P<0.01)。
如图2E所示,SAH组大鼠脑组织中EB渗出较sham组显著增加(P<0.01),表明SAH可增强脑血管通透性;而SAH+TTP组大鼠在SAH建模48 h后脑组织中EB含量低于SAH+vector组,差异有统计学意义(P<0.05)。
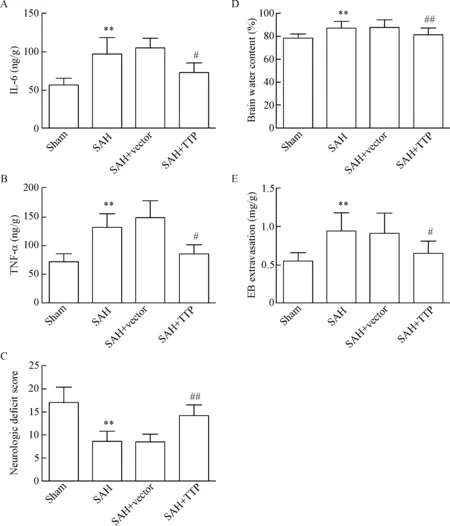
Figure 2. The effects of TTP on early brain injury following SAH in the rats. A and B: ELISA analysis was performed to evaluate the effect ofTTPover-expression on the levels of IL-6 and TNF-α in the brain tissues of SAH rats; C, D and E: the changes of neurological deficit score, brain water content and EB extravasation were also measured 48 h after SAH. Mean±SD.n=3.**P<0.01vssham group;#P<0.05,##P<0.01vsSAH+vector group.
图2TTP对大鼠SAH后EBI的影响
3TTP对大鼠SAH后脑细胞凋亡的影响
TUNEL法检测各组大鼠脑细胞凋亡结果显示,SAH组大鼠脑细胞凋亡数较sham组明显增加,差异有统计学意义(P<0.01);过表达TTP可显著减少SAH导致的脑细胞凋亡(P<0.01),见图3。
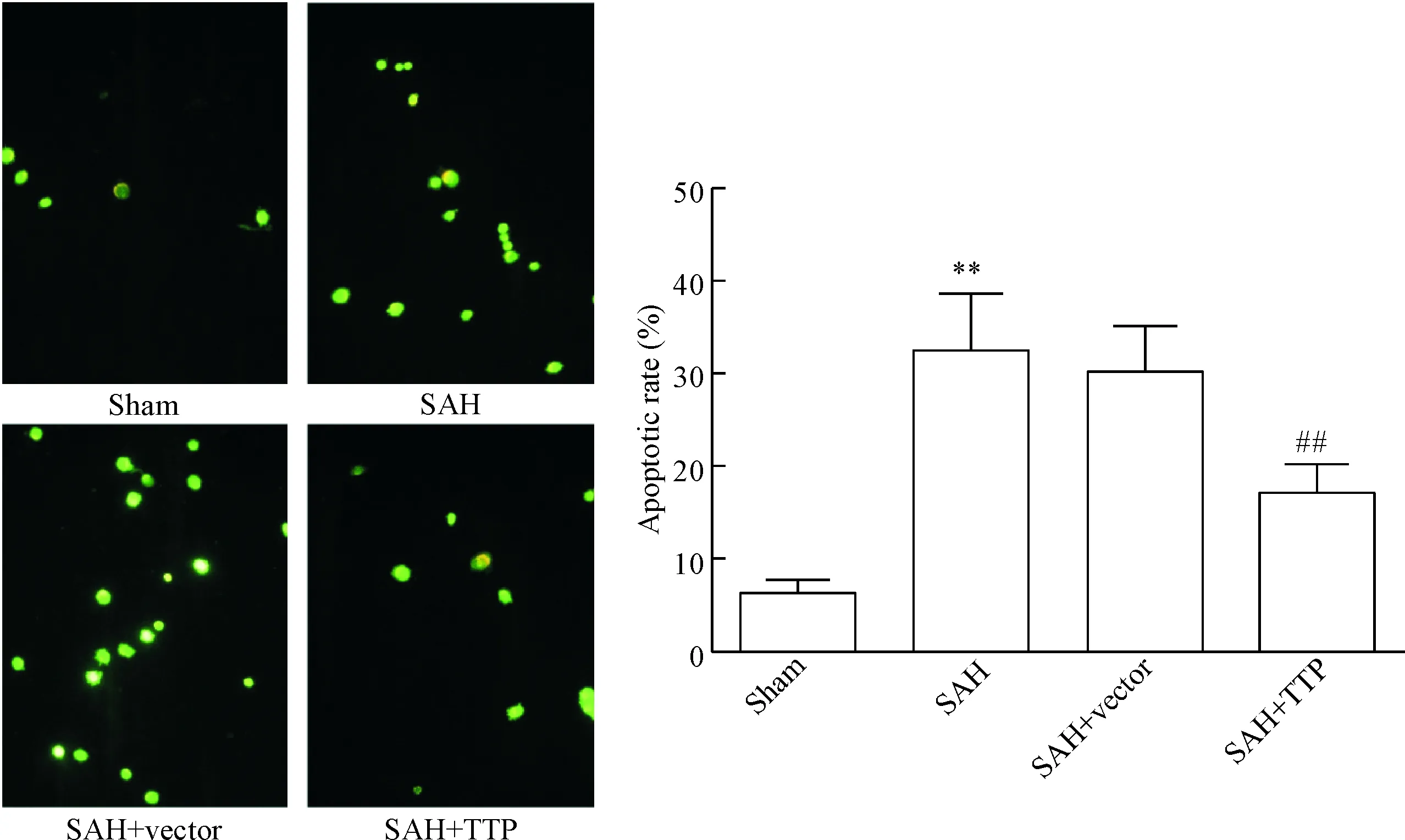
Figure 3. Over-expression of TTP significantly inhibited the number of TUNEL-positive neural cells compared with SAH+vector group (×200). Mean±SD.n=3.**P<0.01vssham group;##P<0.01vsSAH+vector group.
图3TTP对大鼠SAH后脑细胞凋亡的影响
Western blot检测结果表明,与sham组相比较,SAH建模48 h后大鼠脑组织中Bax的表达明显上调,同时上调cleaved caspase-3的水平,而Bcl-2的表达下调(P<0.01);上调TTP在脑组织中的表达可上调Bcl-2的表达,同时Bax和cleaved caspase-3的水平明显下调(P<0.01),见图4。
讨 论
SAH作为一种常见的出血性脑血管疾病,具有极大的危害性[1-2]。SAH后72 h内可发生脑水肿、脑血管痉挛、炎性反应、血脑屏障破坏和肺水肿等一系列并发症,从而引发早期脑损伤,而脑水肿和血脑屏障的破坏是引起早期脑损伤最关键的病理生理反应。研究表明早期脑损伤是导致SAH患者致死致残的最主要原因。目前,大鼠SAH模型的建立有枕大池注血法、视交叉注血法和血管内穿刺法3种[9],而血管内穿刺法更适合研究大鼠SAH后早期脑损伤,为此,本研究通过血管内穿刺法建立大鼠SAH模型,观察到假手术组大鼠术后蛛网膜下腔未见明显出血及血凝块,而SAH造模后在颅底脑组织表面可见大量弥漫性出血及血凝块,包绕脑底部主要血管。既往研究表明,SAH后引起脑细胞炎症反应和免疫反应在导致脑水肿和脑细胞凋亡反应中发挥了重要作用。在颅内压增加和脑血流减少的双重影响下,外周免疫细胞渗入脑组织并释放大量促炎因子,这些促炎因子不仅损伤周围脑细胞,同时损伤神经细胞并导致脑水肿的发生,本次研究也观察到大鼠SAH后可诱导诸如IL-6和TNF-α在脑组织中的表达,与既往研究相仿[10]。
TTP作为一种当今研究得较为透彻的富含AU元件(AU-rich elements,AREs)结合蛋白,可通过有效降解炎症和肿瘤相关基因mRNA,从而在转录后水平调控机体多种病理生理反应[5-6]。近年来,越来越多证据表明TTP在恶性肿瘤的发生发展过程中也发挥了一定作用。研究表明,TNF-α、IL-6和GM-CSF等多种mRNA在特异性沉默TTP的裸鼠体内保持稳定状态,同时这些炎症相关因子的过度表达导致裸鼠恶液质、侵蚀性关节炎、皮肤炎、结膜炎和肾小球肾炎等多种炎症反应;另外改变TTP在机体中的表达对诸如类风湿性关节炎、全身性红斑狼疮和溃疡性结肠炎等疾病的发生和严重程度起到非常重要的作用[10-13]。但目前尚未有TTP与SAH的相关性研究报道,在本研究中,我们观察到TTP在SAH造模后12 h即开始表达下调,在48 h达到最低值,表明TTP有可能作为SAH后EBI发生的早期预测因子及治疗靶点。为进一步研究TTP在大鼠SAH中的作用,我们通过慢病毒干扰技术上调大鼠脑组织中TTP的表达,功能性实验结果表明,过表达TTP不仅可抑制促炎因子在大鼠SAH后脑组织中的表达,同时首次观察到TTP可有效改善SAH后脑水肿、神经功能缺损和脑血管通透性增加等EBI表现,从而表明TTP作为SAH治疗靶点的潜在价值。
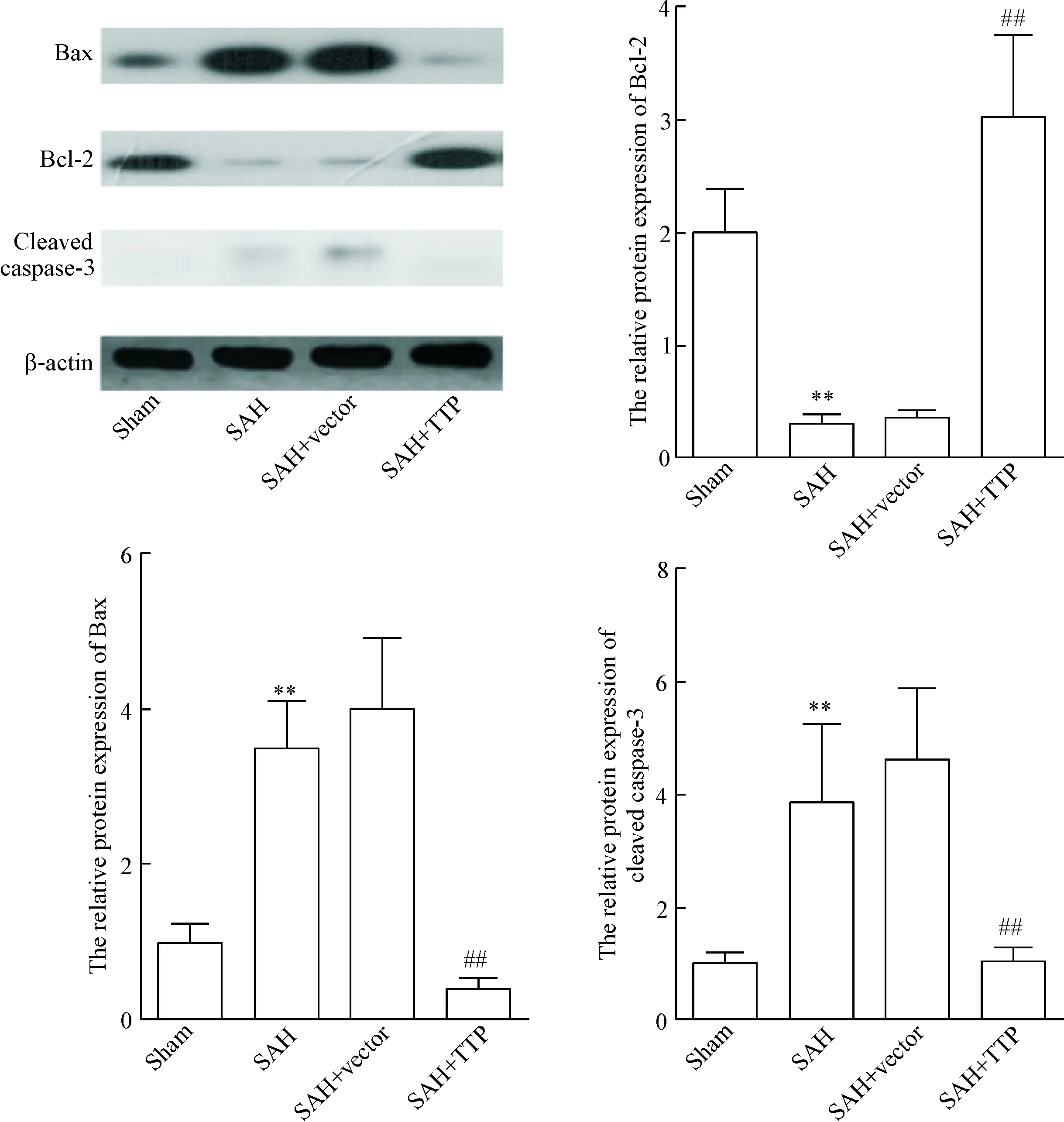
Figure 4. Over-expression of TTP markedly decreased the levels of cleaved caspase-3 and Bax, and elevated the diminished level of Bcl-2. Mean±SD.n=3.**P<0.01vssham group;##P<0.01vsSAH+vector group.
图4Westernblot检测TTP对大鼠脑细胞中Bax、Bcl-2和cleavedcaspase-3水平的影响
细胞凋亡作为一种细胞程序性死亡方式,在SAH后早期脑损伤中扮演着重要角色,凋亡细胞可通过释放诸如TNF-α和IL-6等炎性因子从而影响周围正常细胞发生坏死,因此,抑制SAH后脑细胞凋亡被认为是SAH治疗策略中重要的一环[14]。Caspase-3作为一种在凋亡线粒体通路和死亡受体通路中均发挥作用的关键蛋白酶,被称为细胞凋亡发生的执行者[15]。在本研究中,SAH可诱导大鼠脑细胞凋亡,同时促进caspase-3的活化形式cleaved caspase-3在脑细胞中的表达,而TTP不仅可有效抑制SAH诱导产生的脑细胞凋亡,还能抑制caspase-3的活化,从而表明抑制脑细胞凋亡在TTP的SAH后脑细胞保护作用中扮演了重要角色。研究表明促凋亡蛋白Bax可通过编码产物从而使得抗凋亡蛋白Bcl-2失活,从而在细胞凋亡过程中发挥重要调控作用[16]。在本研究中,过表达TTP可抑制Bax在脑细胞中的表达,同时促进Bcl-2的表达,表明降低Bax/Bcl-2比值在TTP发挥脑细胞保护作用中可能起到关键作用。
综上所述,本研究表明TTP可有效保护大鼠SAH后早期脑损伤的发生,同时抑制脑细胞凋亡,其抑制脑细胞凋亡的机制可能与降低Bax/Bcl-2比值有关,但TTP是否对体外神经元细胞具有保护作用尚未可知,同时TTP发挥SAH后脑细胞保护作用的具体作用机制仍需进一步实验明确,另外TTP在本次实验造模晚期出现表达上调,可能与机体免疫反应有关,其具体调节机制有待进一步研究发现。但本次研究为临床SAH治疗提供一个新的作用靶点,在揭示SAH的发病机制及治疗上具有一定积极意义。
[1] 王 轩, 贾丽丽, 孙保亮, 等. 脑淋巴引流阻滞后蛛网膜下腔出血兔脑脊液对PC12细胞的损伤作用[J]. 中国病理生理杂志, 2010, 26(1):91-95.
[2] 孙保亮, 张苏明, 夏作理, 等. 枕大池动脉血溶血物注入法建立大鼠蛛网膜下腔出血模型[J]. 中国病理生理杂志, 2007, 23(2):411-412.
[3] Gu H, Fei ZH, Wang YQ, et al. Angiopoietin-1 and angiopoietin-2 expression imbalance influence in early period after subarachnoid hemorrhage[J]. Int Neurourol J, 2016, 20(4):288-295.
[4] Tao C, Fan C, Hu X, et al. The effect of fenestration of the lamina terminalis on the incidence of shunt-dependent hydrocephalus after aneurysmal subarachnoid hemorrhage (FISH): study protocol for a randomized controlled trial[J]. Medicine (Baltimore), 2016, 95(52):e5727.
[5] Blackshear PJ. Tristetraprolin and other CCCH tandem zinc-finger proteins in the regulation of mRNA turnover[J]. Biochem Soc Trans, 2002, 30(Pt 6):945-952.
[6] Xiao J, Gao H, Jin Y, et al. The abnormal expressions of tristetraprolin and the VEGF family in uraemic rats with peritoneal dialysis[J]. Mol Cell Biochem, 2014, 392(1-2):229-238.
[7] Bederson JB, Germano IM, Guarino L. Cortical blood flow and cerebral perfusion pressure in a new noncraniotomy model of subarachnoid hemorrhage in the rat[J]. Stroke, 1995, 26(6):1086-1091.
[8] Sugawara T, Ayer R, Jadhav V, et al. A new grading system evaluating bleeding scale in filament perforation subarachnoid hemorrhage rat model[J]. J Neurosci Methods, 2008, 167(2):327-334.
[9] Jin Q, Cai Y, Li S, et al. Edaravone-encapsulated agonistic micelles rescue ischemic brain tissue by tuning blood-brain barrier permeability[J]. Theranostics, 2017, 7(4):884-898.
[10] Zhao XD, Zhou YT. Effects of progesterone on intestinal inflammatory response and mucosa structure alterations following SAH in male rats[J]. J Surg Res, 2011, 171(1):e47-e53.
[11] Clark AR, Dean JL. The control of inflammation via the phosphorylation and dephosphorylation of tristetraprolin: a tale of two phosphatases[J]. Biochem Soc Trans, 2016, 44(5):1321-1337.
[12] Ryu J, Seong H, Yoon NA, et al. Tristetraprolin regulates the decay of the hypoxia-induced vascular endothelial growth factor mRNA in ARPE-19 cells[J]. Mol Med Rep, 2016, 14(6):5395-5400.
[13] Berglund AE, Scott KE, Li W, et al. Tristetraprolin disables prostate cancer maintenance by impairing proliferation and metabolic function[J]. Oncotarget, 2016, 7(50):83462-83475.
[14] Liu H, Yang M, Pan L, et al. Hyperbaric oxygen intervention modulates early brain injury after experimental subarachnoid hemorrhage in rats: possible involvement of TLR4/NF-κB-mediated signaling pathway[J]. Cell Physiol Biochem, 2016, 38(6):2323-2336.
[15] Li G, Wang QS, Lin TT. Alterations in the expression of protease-activated receptor 1 and tumor necrosis factor-α in the basilar artery of rats following a subarachnoid hemorrhage[J]. Exp Ther Med, 2016, 11(3):717-722.
[16] Kordezangeneh M, Irani S, Mirfakhraie R, et al. Regualtion ofBAX/BCL2 gene expression in breast cancer by docetaxel-loaded human serum albumin nanopaticles[J]. Med Oncol, 2015, 32(7):208.
