丙泊酚对结直肠癌细胞生物学行为的影响*
2018-03-01余海燕刘德生
余海燕, 刘德生, 王 云
(青海省人民医院麻醉科, 青海 西宁 810001)
大肠癌是常见的消化道肿瘤之一,近些年随着人民膳食结构及生活方式的改变,大肠癌的发病率呈上升趋势,对人们的生命健康造成了严重的威胁,主要治疗手段为外科手术,但相当多的患者就诊时已处于晚期,错失了最佳的治疗时机,造成术后的复发率高,且5年生存率低[1-2]。因此,寻找新的治疗方法具有重要意义。肿瘤手术中麻醉是不可或缺的部分,麻醉过程中使用的药物可能对肿瘤有有害或有益的作用,从而影响肿瘤的预后及治疗。丙泊酚(propofol)是常用的一种静脉麻醉药物,广泛用于麻醉维持、麻醉诱导及重症监护室[3]。近些年的研究发现,丙泊酚有抑制肿瘤细胞增殖、侵袭及诱导细胞凋亡的作用[4-5],若在手术治疗过程中,采用丙泊酚麻醉患者,可能具有抑制肿瘤细胞生长和促凋亡作用。目前,关于丙泊酚对结直肠癌的影响机制尚不清楚。本研究拟在离体条件下,探讨丙泊酚对结直肠癌细胞活力、侵袭和凋亡的影响,并探讨其可能的分子机制。
材 料 和 方 法
1细胞、主要试剂和仪器
大肠癌LoVo细胞株购自济南赛尔生物科技有限公司。
丙泊酚购自AstraZeneca;胎牛血清和RPMI-1640培养基均购自Gibco;Transwell小室购自Millipore;CCK-8试剂盒、二喹啉甲酸(bicinchoninic acid,BCA)试剂盒和膜联蛋白 V(Annexin V)-FITC凋亡试剂盒购自碧云天生物技术研究所;抗基质金属蛋白酶2(matrix metalloproteinase-2,MMP-2)、基质金属蛋白酶9(matrix metalloproteinase 9,MMP-9)、活化的胱天蛋白酶3(cleaved caspase-3)、Notch1和发状分裂相关增强子1(hairy and enhancer of split 1,Hes1)抗体均购自Abcam。酶标仪购自Bio-Rad;流式细胞仪购自Becton Dickinson。
2方法
2.1细胞培养 LoVo细胞在37 ℃、5% CO2、95%饱和湿度的恒温培养箱中,用含有10%胎牛血清、1×105U/L青霉素和100 mg/L链霉素的RPMI-1640培养液中培养。每2~3 d传代1次。实验取对数生长期的细胞。
2.2CCK-8法检测细胞活力 取生长至对数期的 LoVo细胞制成细胞悬液,以1×107/L密度每孔加入200 μL接种至96孔细胞培养板中,37 ℃、5% CO2的培养箱中培养24 h后,将细胞分为丙泊酚组和对照组。丙泊酚组分别加入10、25、50和100 μmol/L的丙泊酚处理细胞72 h,或用100 μmol/L的丙泊酚处理细胞12、24、48和72 h;对照组加入等量的培养液。每组设置5个复孔,并设立调零孔。各组细胞作用至规定时点后,每孔加入CCK-8试剂10 μL,37 ℃、5% CO2继续培养2 h。用空白对照孔调零,酶标仪测定各个孔在450 nm波长处的吸光度(A)值,计算细胞活力。细胞活力(%)=实验组细胞A值/对照组细胞A值×100%。
2.3Transwell小室检测细胞侵袭能力 4 ℃融化Matrigel,于冰上将Matrigel用磷酸盐缓冲液(phosphate-buffered saline,PBS)按照1∶6稀释,取35 μL铺在小室内,常温放置10~15 min风干,Transwell小室的上室中加入200 μL的丙泊酚(100 μmol/L)处理72 h的细胞悬液(密度为1×108/L),下室中加入含有10%胎牛血清的RPMI-1640培养基,37 ℃、5% CO2培养箱中经过24 h培养,膜清洗,甲醛固定30 min,结晶紫染色5 min,显微镜下拍照,随机取6个不同的视野(×200)观察并记录穿膜的细胞数,实验重复3次,计算每组小室细胞的平均数。
2.4流式细胞术检测细胞周期 以2×108/L的密度将 LoVo细胞接种至6孔细胞培养板中,每孔2 mL,每组设置3个复孔,100 μmol/L的丙泊酚处理细胞72 h,离心收集细胞,预冷的PBS洗涤后迅速用预冷的70%乙醇固定,-20 ℃过夜后,离心去除乙醇,预冷的PBS洗涤,碘化丙锭(propidium iodide,PI)避光染色20 min,流式细胞术检测各组细胞的周期分布。
2.5流式细胞术检测细胞凋亡 以2×108/L的密度将 LoVo细胞接种至6孔细胞培养板中,每孔2 mL, 100 μmol/L的丙泊酚处理细胞72 h,胰蛋白酶消化细胞,离心后收集细胞,采用Annexin V-FITC/PI 双标记试剂盒用流式细胞仪检测各组细胞的凋亡情况。
2.6Western blot法检测蛋白表达 取100 μmol/L的丙泊酚处理72 h的细胞,加入适量的细胞裂解液于冰上充分裂解,离心,收集上清,取少量蛋白用BCA试剂盒检测蛋白浓度。每泳道30μg的上样量经12% SDS-PAGE电泳分离,再转移至硝酸纤维素膜,5%脱脂奶粉封闭,分别加入抗MMP-2、MMP-9、cleaved caspase-3、Notch1、Hes1(均按1∶500稀释)和GAPDH(1∶1 000稀释) I 抗,4 ℃过夜,TBST洗涤3次,每次10 min,加入1∶5 000稀释的HRP标记的羊抗鼠IgG,室温孵育1 h,ECL化学发光后,X线显像。
3统计学处理
所有实验数据采用SPSS 21.0软件进行分析,计量资料用均数±标准差(mean±SD)表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析,两两比较采用LSD-t检验,以P<0.05为差异有统计学意义。
结 果
1丙泊酚抑制LoVo细胞的活力
CCK-8实验结果显示,0、10、25、50和100 μmol/L的丙泊酚处理LoVo细胞72 h后,细胞活力分别为(100.00±4.44)%、(96.88±4.12)%、(91.79±4.39)%、(80.22±3.44)%和(62.48±3.54)%,细胞活力随剂量的增加而减少,50和100 μmol/L的丙泊酚可显著抑制细胞的活力(P<0.01),见图1A;100 μmol/L的丙泊酚处理细胞0、12、24、48和72 h后,细胞活力分别为(100.00±5.12)%、(95.31±5.02)%、(85.12±4.75)%、(71.18±4.22)%和(60.09±3.78)%,细胞活力可随着时间的延长降低,从24 h起可显著抑制细胞活力(P<0.01),见图1B。
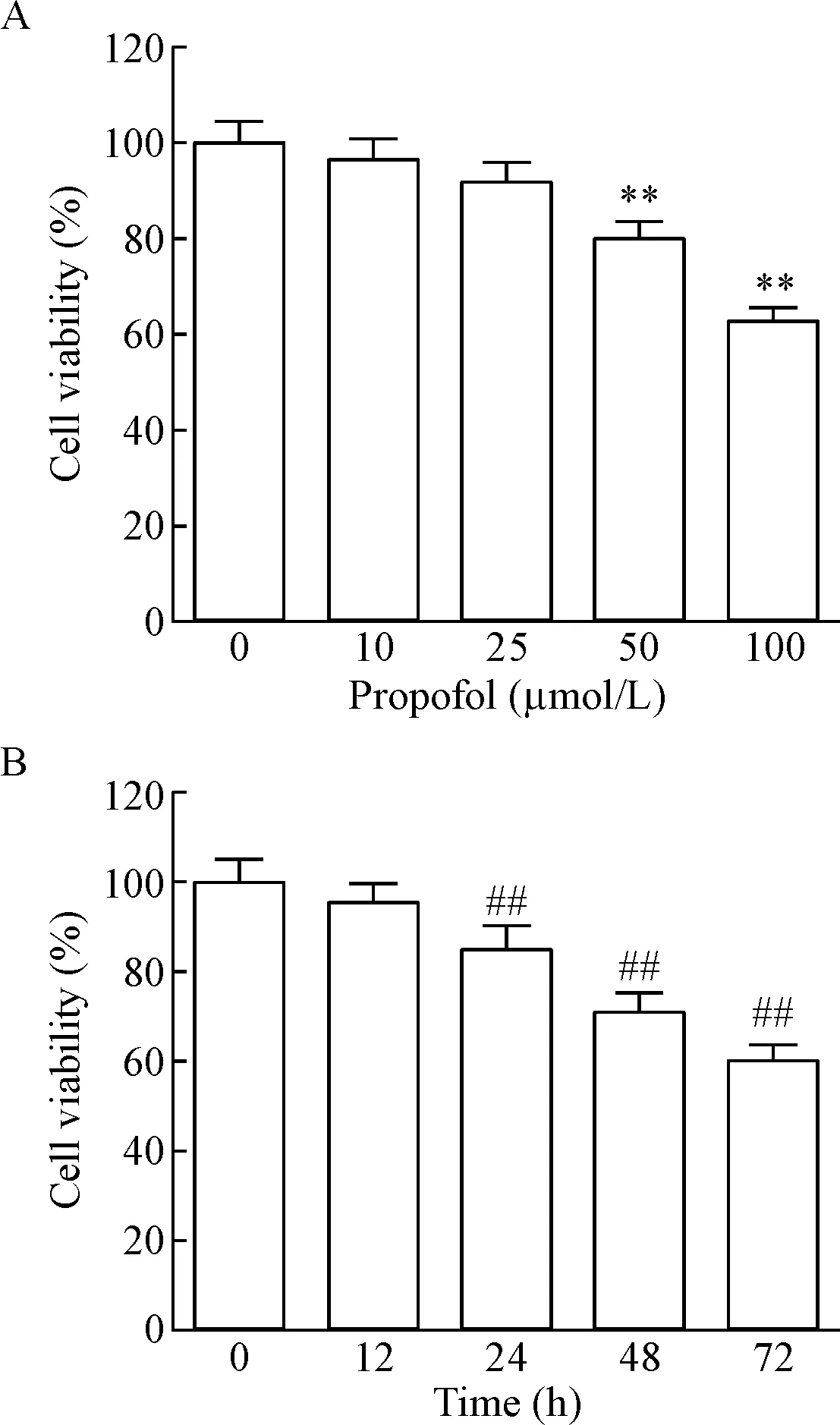
Figure 1. The effect of propofol on the viability of the LoVo cells. A: the viability of the LoVo cells treated with propofol at different doses; B: the viability of LoVo cells treated with propofol at different time. Mean±SD.n=3.**P<0.01vs0 μmol/L group;##P<0.01vs0 h group.
图1丙泊酚对LoVo细胞活力的影响
2丙泊酚抑制LoVo细胞的侵袭能力
Transwell小室检测100 μmol/L的丙泊酚处理LoVo细胞72 h后细胞侵袭能力的变化,并以Wes-tern blot检测侵袭相关蛋白MMP-2和MMP-9的蛋白表达水平,结果显示,与对照组相比,丙泊酚组相对侵袭细胞明显减少(P<0.01),细胞侵袭能力及MMP-2和MMP-9的蛋白表达均显著降低(P<0.01),见图2。
3丙泊酚阻滞LoVo细胞周期
流式细胞术检测各组细胞的周期变化,结果显示,丙泊酚组G0/G1期细胞显著高于对照组(P<0.01),S期细胞显著低于对照组(P<0.01),G2/M期细胞两组间差异无统计学显著性(P>0.05),见图3。
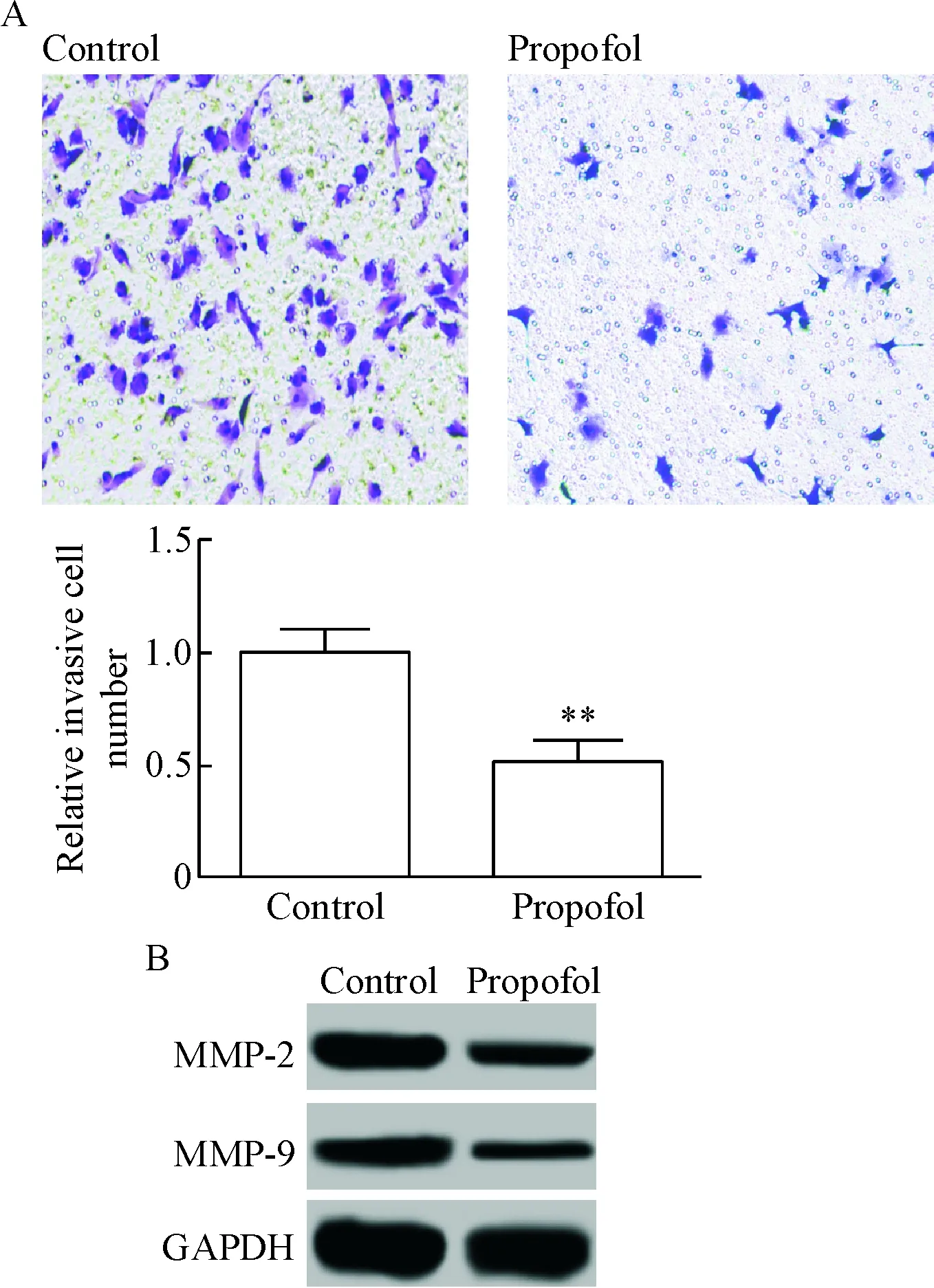
Figure 2. The effect of propofol on the invasion ability of LoVo cells. A: the results of Transwell assay (crystal violet staining,×100); B: the protein expression of MMP-2 and MMP-9 was detected by Western blot. Mean±SD.n=3.**P<0.01vscontrol group.
图2丙泊酚对LoVo细胞侵袭能力的影响
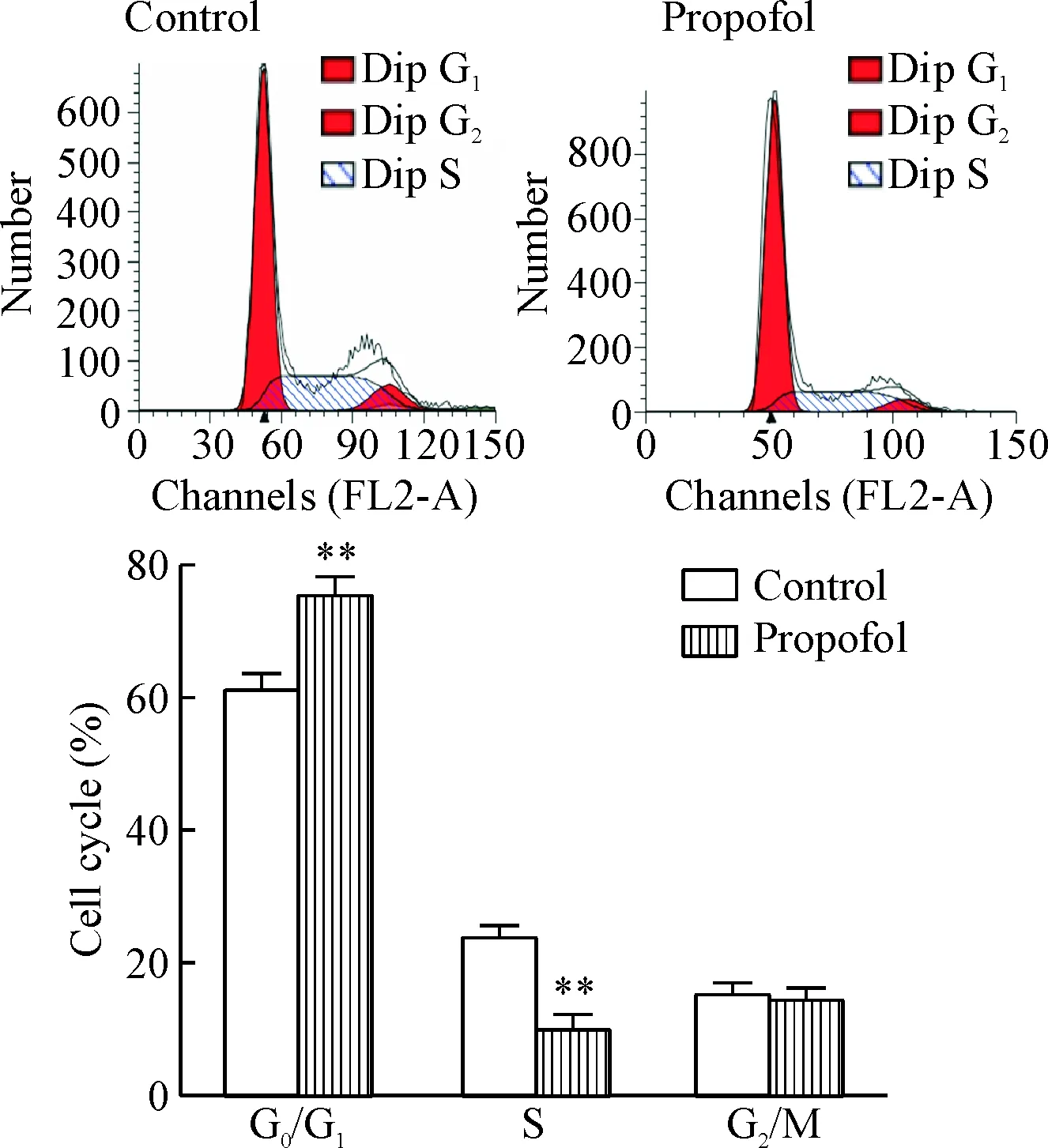
Figure 3. The effect of propofol on the cell cycle distribution of the LoVo cells. Mean±SD.n=3.**P<0.01vscontrol group.
图3丙泊酚对LoVo细胞周期分布的影响
4丙泊酚促进LoVo细胞凋亡
流式细胞术检测LoVo细胞凋亡结果显示,对照组和丙泊酚组细胞凋亡率分别为(5.18±0.67)%和(19.63±1.22)%,丙泊酚组细胞凋亡率显著高于对照组(P<0.01),见图4。
5丙泊酚对LoVo细胞cleavedcaspase-3、Notch1和Hes1蛋白表达的影响
Western blot检测凋亡相关蛋白cleaved caspase-3及Notch1信号通路相关蛋白Notch1和Hes1的蛋白水平,结果显示,丙泊酚组cleaved caspase-3的蛋白水平显著高于对照组,而Notch1和Hes1的蛋白水平显著低于对照组(P<0.01),见图5。
讨 论
近年来的研究显示,一些麻醉药物除了有镇静作用外,还能抗肿瘤和调节机体免疫反应,其中最典型的是丙泊酚。丙泊酚的有效成分为2,6-二异丙酚,是临床上常用的静脉麻醉药,在各种手术的麻醉诱导中广泛使用,其特有的结构能抑制炎症细胞聚集、增殖、活化及减少释放炎症因子,从而达到抗炎作用[6-7]。新近的研究显示,丙泊酚可通过直接或间接作用抑制肿瘤细胞的增殖、侵袭、迁移和生存能力,并促进细胞凋亡,从而达到有效的抗肿瘤作用[8-10]。有报道显示,丙泊酚可抑制胃癌细胞增殖和侵袭[11];通过下调ERK-VEGF/MMP-9信号通路抑制食管癌细胞的增殖[12];通过调控miR-9/NF-κB信号抑制卵巢癌细胞的增殖和侵袭[13];通过激活GABA-A受体使MDA-MB-468乳腺癌细胞侵袭能力增强[14]。以上的研究说明丙泊酚可通过不同作用途径抑制不同肿瘤细胞的增殖、凋亡和侵袭等过程。本研究以大肠癌细胞为研究对象,检测了丙泊酚对大肠癌细胞增殖、凋亡和侵袭的影响,结果显示,丙泊酚可显著抑制大肠癌细胞的增殖和侵袭,阻滞细胞周期,并促进细胞的凋亡。侵袭是恶性肿瘤的标志之一,受到多种基因和蛋白的调控及其它多种因素的影响。基质金属蛋白酶(matrix metalloproteinases,MMPs)可使细胞外的基质及基膜中的大多数蛋白质降解,正常情况下在组织中以平衡状态存在,而在肿瘤中平衡被打破,表达增强,降解细胞外的基质,进而促进细胞的转移、侵袭能力[15-16]。食管癌和肝癌等肿瘤中MMP基因的表达升高与肿瘤预后及转移相关[17-18]。MMP-2和MMP-9在MMPs家族中被研究得较多。有研究指出,大肠癌中MMP-2和MMP-9的表达显著升高,其表达与大肠癌的发生及侵袭转移密切相关,抑制其表达可显著降低大肠癌细胞的侵袭能力[19-20]。细胞的增殖和凋亡不平衡是引起肿瘤发生的原因,caspase家族在细胞凋亡过程中发挥重要作用。本研究中已检测丙泊酚可促进结直肠细胞的凋亡,是否是通过调控caspase家族引起的凋亡还未可知。Caspase-3的基因定位于人染色体4q32~35.1,是细胞凋亡过程中的关键酶,也是caspase家族最重要的凋亡执行者之一,在受到凋亡信号刺激后被激活,降解多种蛋白底物,从而诱导细胞发生凋亡,作为凋亡过程中的效应蛋白,是多种凋亡刺激信号的汇聚点,其活性将使凋亡进入不可逆阶段[21-23]。本研究的结果说明,丙泊酚可通过下调MMP-2和MMP-9蛋白表达而抑制细胞侵袭,上调cleaved caspase-3而诱导细胞凋亡。
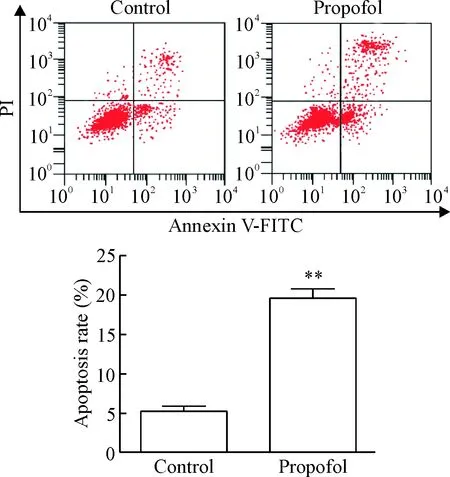
Figure 4. The effect of propofol on the apoptosis of LoVo cells. Mean±SD.n=3.**P<0.01vscontrol group.
图4丙泊酚对LoVo细胞凋亡的影响

Figure 5. The effect of propofol on the protein levels of cleaved caspase-3, Notch1 and Hes1 in the LoVo cells. Mean±SD.n=3.**P<0.01vscontrol group.
图5丙泊酚对LoVo细胞cleavedcaspase-3、Notch1和Hes1蛋白水平的影响
Notch信号通路由Notch受体、配体及DNA结合蛋白组成,在进化上高度保守,不仅影响正常细胞的增殖、发育、凋亡和分化,而且影响多种肿瘤细胞的发生及发展[24-25]。Notch1是Notch信号通路的一个受体,在人类T淋巴母细胞白血病中被鉴定出来,与肿瘤的发生存在密切关系,在多种肿瘤细胞中有异常表达,如大肠癌、乳腺癌和胶质瘤等,该信号的紊乱可通过直接或间接作用引起肿瘤的发生[26-28]。有研究指出,抑制Notch1可降低肝癌和胶质瘤等多种肿瘤细胞的发生及发展[29-30]。Hes1是Notch1信号的关键靶基因,是Notch1信号是否激活的标志[31]。本研究检测丙泊酚对Notch1和Hes1蛋白表达的影响,结果显示,Notch1和Hes1蛋白表达均显著下调。这说明丙泊酚可通过下凋Notch1信号通路降低大肠癌的发生和发展。
综上所述,丙泊酚可通过下调Notch1信号通路降低结直肠癌细胞的增殖和侵袭能力,阻滞细胞周期,并促进细胞的凋亡,提示丙泊酚可能作为肿瘤治疗手术中理想的麻醉药。但本研究只在细胞水平检测丙泊酚的作用,后期将做体内实验,以更深入研究丙泊酚在结直肠癌中的作用。
[1] Tabernero J, Yoshino T, Cohn AL, et al. Ramucirumab versus placebo in combination with second-line FOLFIRI in patients with metastatic colorectal carcinoma that progressed during or after first-line therapy with bevacizumab, oxaliplatin, and a fluoropyrimidine (RAISE): a rando-mised, double-blind, multicentre, phase 3 study[J]. Lancet Oncol, 2015, 16(5):499-508.
[2] Bettington M, Walker N, Clouston A, et al. The serrated pathway to colorectal carcinoma: current concepts and challenges[J]. Histopathology, 2013, 62(3): 367-386.
[3] Cattai A, Pilla T, Cagnardi P, et al. Evaluation and optimisation of propofol pharmacokinetic parameters in cats for target-controlled infusion[J]. Vet Rec, 2016, 178(20):503.
[4] Xu J, Xu W, Zhu J. Propofol suppresses proliferation and invasion of glioma cells by upregulating microRNA-218 expression[J]. Mol Med Rep, 2015, 12(4):4815-4820.
[5] Ye Z, Jingzhong L, Yangbo L, et al. Propofol inhibits proliferation and invasion of osteosarcoma cells by regulation of microRNA-143 expression[J]. Oncol Res, 2014, 21(4):201-207.
[6] Abbasivash R, Aghdashi MM, Sinaei B, et al. The effects of propofol-midazolam-ketamine co-induction on hemodynamic changes and catecholamine response[J]. J Clin Anesth, 2014, 26(8):628-633.
[7] Ma X, Hu YW, Zhao ZL, et al. Anti-inflammatory effects of propofol are mediated by apolipoprotein M in a hepatocyte nuclear factor-1α-dependent manner[J]. Arch Biochem Biophys, 2013, 533(1-2):1-10.
[8] 高伟忠, 但 伶, 田泽丹, 等. 丙泊酚对肝缺血再灌注大鼠肺损伤及 PI3K/Akt 通路的影响[J]. 中国病理生理杂志, 2013, 29(3):488-492.
[9] Zhang D, Zhou X, Zhang J, et al. Propofol promotes cell apoptosis via inhibiting HOTAIR mediated mTOR pathway in cervical cancer[J]. Biochem Biophys Res Commun, 2015, 468(4):561-567.
[10] Xu YB, Jiang W, Zhao FR, et al. Propofol suppresses invasion and induces apoptosis of osteosarcoma cellinvitrovia downregulation of TGF-β1 expression[J]. Eur Rev Med Pharmacol Sci, 2016, 20(7):1430-1435.
[11] Wang ZT, Gong HY, Zheng F, et al. Propofol suppresses proliferation and invasion of gastric cancer cells via downregulation of microRNA-221 expression[J]. Genet Mol Res, 2015, 14(3):8117-8124.
[12] Nonaka S, Kawaguchi Y, Oda I, et al. Safety and effectiveness of propofol-based monitored anesthesia care without intubation during endoscopic submucosal dissection for early gastric and esophageal cancers[J]. Dig Endosc, 2015, 27(6):665-673.
[13] Huang X, Teng Y, Yang H, et al. Propofol inhibits invasion and growth of ovarian cancer cells via regulating miR-9/NF-κB signal[J]. Brazilian J Med Biol Res, 2016, 49(12):e5717.
[14] Ecimovic P, Murray D, Doran P, et al. Propofol and bupivacaine in breast cancer cell functioninvitro: role of theNET1 gene[J]. Anticancer Res, 2014, 34(3):1321-1331.
[15] 魏 莉, 徐 盈. 基质金属蛋白酶 9 在老年肺癌中的表达及临床意义[J]. 中国老年学杂志, 2014, 34(1):89-90.
[16] Crisp JL, Savariar EN, Glasgow HL, et al. Dual targeting of integrin αvβ3 and matrix metalloproteinase-2 for optical imaging of tumors and chemotherapeutic delivery[J]. Mol Cancer Ther, 2014, 13(6):1514-1525.
[17] Zhang Y, Pan T, Zhong X, et al. Androgen receptor promotes esophageal cancer cell migration and proliferation via matrix metalloproteinase 2[J]. Tumor Biol, 2015, 36(8): 5859-5864.
[18] Ordonez R, Carbajo-Pescador S, Prieto-Dominguez N, et al. Inhibition of matrix metalloproteinase-9 and nuclear factor kappa B contribute to melatonin prevention of motility and invasiveness in HepG2 liver cancer cells[J]. J Pineal Res, 2014, 56(1):20-30.
[19] Salem N, Kamal I, Al-Maghrabi J, et al. High expression of matrix metalloproteinases: MMP-2 and MMP-9 predicts poor survival outcome in colorectal carcinoma[J]. Future Oncol, 2016, 12(3): 323-331.
[20] Groblewska M, Mroczko B, Gryko M, et al. Serum levels and tissue expression of matrix metalloproteinase 2 (MMP-2) and tissue inhibitor of metalloproteinases 2 (TIMP-2) in colorectal cancer patients[J]. Tumor Biol, 2014, 35(4):3793-3802.
[21] Maellaro E, Leoncini S, Moretti D, et al. Erythrocyte caspase-3 activation and oxidative imbalance in erythrocytes and in plasma of type 2 diabetic patients[J]. Acta Diabetol, 2013, 50(4):489-495.
[22] 袁 磊, 李伯和, 时冉冉, 等. 沉默JAG1基因对人乳腺癌 MDA-MB-231 细胞增殖和凋亡的影响[J]. 中国病理生理杂志, 2014, 30(2):262-267.
[23] Yu Z, Zhang C, Wang H, et al. Multidrug resistance-associated protein 3 confers resistance to chemoradiotherapy for rectal cancer by regulating reactive oxygen species and caspase-3-dependent apoptotic pathway[J]. Cancer Lett, 2014, 353(2):182-193.
[24] Takebe N, Nguyen D, Yang SX. Targeting notch signaling pathway in cancer: clinical development advances and challenges[J]. Pharmacol Ther, 2014, 141(2):140-149.
[25] Kang JH, Kim EG, Kim W, et al. Rhamnetin and cirsiliol induce radiosensitization and inhibition of epithelial-mesenchymal transition (EMT) by miR-34a-mediated suppression of Notch-1 expression in non-small cell lung cancer cell lines[J]. J Biol Chem, 2013, 288(38):27343-27357.
[26] Rodriguez JM, Miranda D, Bunout D, et al. Folates induce colorectal carcinoma HT29 cell line proliferation through Notch1 signaling[J]. Nutrition Cancer, 2015, 67(4):706-711.
[27] Qiu M, Peng Q, Jiang I, et al. Specific inhibition of Notch1 signaling enhances the antitumor efficacy of chemotherapy in triple negative breast cancer through reduction of cancer stem cells[J]. Cancer Lett, 2013, 328(2):261-270.
[28] Guichet PO, Guelfi S, Teigell M, et al. Notch1 stimulation induces a vascularization switch with pericyte-like cell differentiation of glioblastoma stem cells[J]. Stem Cells, 2015, 33(1):21-34.
[29] Wu G, Wilson G, George J, et al. Modulation of Notch signaling as a therapeutic approach for liver cancer[J]. Curr Gene Ther, 2015, 15(2):171-181.
[30] Xu R, Shimizu F, Hovinga K, et al. Molecular and clinical effects of Notch inhibition in glioma patients: a phase 0/I trial[J]. Clin Cancer Res, 2016, 22(19):4786-4796.
[31] Zhang K, Zhang YQ, Ai WB, et al. Hes1, an important gene for activation of hepatic stellate cells, is regulated by Notch1 and TGF-β/BMP signaling[J]. World J Gastroenterol, 2015, 21(3):878-887.
