左卡尼汀联合阿托伐他汀钙治疗慢性心力衰竭的疗效及对心功能和血清CRP,IL- 6,TNF- α水平的影响
2018-03-01,,,,
,, ,,
慢性心力衰竭(chronic heart failure,CHF)是指心脏结构异常或功能障碍,引起的进行性左心室舒张和收缩功能不全,导致肺循环和体循环淤血的临床综合征,是多数器质性心脏病的终末阶段[1]。临床症状有呼吸困难、运动耐力下降,体潴留及心脏扩大或心功能不全等。目前认为炎症反应和心室重构是引发CHF进展的重要因素,临床治疗策略为采用药物长期修复心肌功能,延缓心肌重构的进展[2]。阿托伐他汀钙(atorvastatin calcium,AC)属他汀类降脂药,具有降血脂、抑制炎症反应、改善内皮功能等药理作用,近年来用于CHF治疗效果较好[3]。左卡尼汀(levocarnitine,LC)是机体能量代谢必需的天然物质,具有提高体力、升高血压、维持心率等作用,能够提高CHF病人心肌代谢水平,目前已广泛用于CHF的治疗,且效果显著[4]。
炎症因子,如C反应蛋白(C- reactionprotein,CRP)、白细胞介素(interleukin,IL)- 6、肿瘤坏死因子(tumor necrosis factor,TNF)- α等具有负性肌力作用,能加速心室重构,参与了CHF的病理生理过程,炎症反应是其进展的重要因素[5]。心功能指标检测在CHF早期诊断及预后评估等方面具有重要临床价值。本研究以我院2015年6月—2017年6月收治的CHF病人为研究对象,探讨LC联合AC治疗CHF的临床效果及对病人心功能和血清CRP,IL- 6,TNF- α水平的影响,以期指导CHF临床用药。
1 资料与方法
1.1 临床资料 选择我院2015年6月—2017年6月收治的144例CHF病人,纳入标准:①符合《慢性心力衰竭诊断治疗指南》CHF诊断标准[6];②左室射血分数(LVEF)≤50%;③年龄>18岁;④纽约心脏病协会(NYHA)心功能分级Ⅱ级~Ⅳ级;⑤对本次研究知情并自愿签署知情同意书;⑥出现呼吸困难、乏力等运动耐力下降症状。排除标准:①严重肝肾功能不全者;②过敏体质,对治疗药物过敏者;③妊娠或哺乳期妇女;④合并凝血系统异常或严重房室传导阻滞等严重心律失常者;⑤合并甲状腺功能异常;⑥患有急性冠脉综合征,包括急性脑卒中、急性心肌梗死等;⑦患有严重精神疾病或认知障碍者;⑧合并恶性肿瘤或自身免疫缺陷疾病者。
本研究经我院医学伦理委员会审核同意。采用随机数字表法均分为两组。对照组72例,男37例,女35例;年龄(36.3±1.2)岁,病程(2.6±1.1)年;基础疾病:缺血性心脏病24例,冠心病26例;扩张性心肌病22例;NYHA分级:Ⅱ级20例,Ⅲ 级33例,Ⅳ 级19例。观察组72例,男35例,女37例;年龄(36.5±1.6)岁,病程(2.5±1.3)年;基础疾病:缺血性心脏病22例,冠心病27例;扩张性心肌病23例;NYHA分级:Ⅱ级21例,Ⅲ 级31例,Ⅳ 级20例。两组基线资料相比无统计学意义(P>0.05),具有临床可比性。
1.2 方法 两组均采取相同临床处理流程,具体参照《指南》[6]。①一般治疗:限水、饮食控制、抗抑郁治疗。②药物治疗:给予利尿药、血管紧张素Ⅱ受体拮抗剂、地高辛等常规抗心衰药物治疗。对照组在此基础上给予AC(辉瑞制药,规格:20 mg×7片,生产批号:N11672)治疗;睡前口服,20 mg/d。观察组:在对照组基础上联合LC(回音必集团抚州制药,规格:5 mL∶1 g,生产批号:20150509)治疗,将2 g的LC注射液和50 mL的0.9%氯化钠注射液混合后,静脉滴注,滴速为(20~40)滴/min,每天1次,两组均连续治疗4周。
1.3 观察指标 临床疗效[7],显效:临床症状完全消失,心功能等级显著改善;有效:临床症状明显改善,心功能分级提高1级;临床症状无改善或加重,心功能分级无明显变化。心功能指标检测:于治疗前后应用心脏多普勒诊断仪(美国GE,型号Vivid7)检测左心室舒张/收缩末期内径(LVEDD/LVESD)值,并计算LVEF值(测量3次取平均值)。血清指标检测,于治疗前后抽取病人清晨空腹外周静脉血5 mL,离心后取血清置于-80℃冰箱中待检;仪器选用全自动生化分析仪(美国贝克曼库尔特,型号D×C600),应用酶联免疫吸附法(ELISA)测定CRP,IL- 6,TNF- α水平,试剂盒购自美国TSZ公司;各操作严格按说明书进行。不良反应,记录病人治疗期间因药物引起的呕吐、腹泻、皮肤瘙痒等不良反应/事件。

2 结 果
2.1 临床疗效比较 观察组治疗4周后总有效率达91.7%(66/72),显著高于对照组的69.0%(54/72),P<0.01。详见表1。
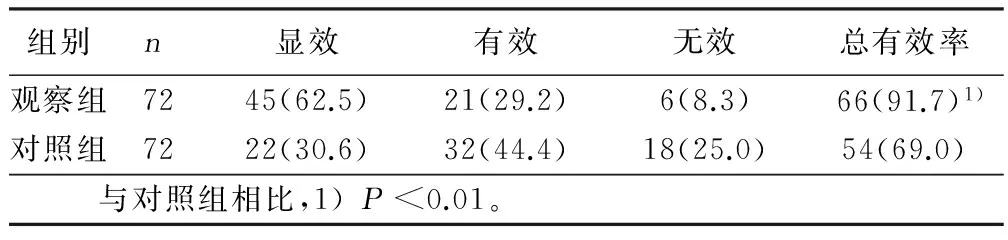
表1 两组临床疗效比较 例(%)
2.2 心功能指标比较 与治疗前比较,两组治疗4周后 LVESD、LVEDD值均显著降低(P<0.01),LVEF值显著升高(P<0.01),且观察组改善更显著(P<0.01)。详见表2。

表2 两组治疗前后心功能指标比较(±s)
2.3 血清指标比较 两组治疗4周后血清CRP,IL- 6,TNF- α水平较治疗前均显著下降(P<0.01),且观察组较对照组下降更显著(P<0.01)。详见表3。

表3 两组治疗前后血清指标比较(±s)
2.4 不良反应比较 治疗期间,对照组发生呕吐1例,腹泻1例,皮肤瘙痒2例;观察组出现呕吐1例,皮肤瘙痒2例。与对照组5.6%(4/72)比较,观察组不良反应率为4.2%(3/72),无统计学意义(P>0.05)。两组均未见严重不良反应/事件。
3 讨 论
现代医学认为,CHF的发生、发展与呼吸道感染、心律失常、心肌梗死、循环负荷过重、体力劳动过度、炎症、高血压等因素有关。其病理机制可能为心室重塑和能量代谢重塑[8]。有研究表明[9]炎症因子活化可加速诱导心肌细胞凋亡,使心肌组织结构和功能异常,加速心肌重塑的进展。目前临床治疗方案主要为通过药物治疗抑制炎症反应、增加心肌能量代谢,进而延缓心室重塑和能量代谢重塑进展。AC属他汀类药物,是一种甲基羟戊二酰辅酶 A还原酶抑制剂,调脂、抗氧化、改善内皮功能、抗炎等多重药理作用,广泛用于CHF治疗[10]。AC作用机制及优势有:①通过抑制还原酶和胆固醇的生物合成,降低血浆低脂蛋白和胆固醇水平,发挥调脂作用;②抑制炎性因子合成及释放,较少心肌毒性,抑制心肌纤维化,逆转心室重塑;③可阻断多种心肌肥厚细胞因子转导,改善心功能;④降低氧自由基水平,促进血管新生;⑤可直接发挥药物活性,半衰期长,具有较高生物利用度。AC联合曲美他嗪、LC等药物治疗,能有效增加心肌能量代谢,改善病人心脏功能,且安全有效,可用于长期治疗[11]。
LC是机体广泛存在的特殊氨基酸,心肌缺血缺氧时,内源性LC水平降低,主要由糖酵解提供心肌活动所需能量,使得脂酰辅酶A大量堆积,导致心肌代谢障碍,补充外源性LC,可促使心肌细胞能量代谢方式恢复正常。LC具有调节血糖、脂肪代谢,改善心肌能量代谢,抑制炎症反应等多种药理作用,在CHF治疗中具有良好应用基础。有研究显示[12],LC用于治疗CHF,能够有效下调炎性因子水平,调节心肌能量代谢方式,改善病人心功能。一项Meta分析亦表明LC对CHF病人可有效缓解临床症状,对运动耐量提升明显,且安全性较高[13]。
本研究中与予以AC治疗的对照组(69.0%)对比,在此基础上联合LC治疗的观察组治疗4周后总有效率为91.7%比较,显著提高,这与沈红枫等[14]研究结果一致,提示CHF病人采用AC联合LC治疗更有利于缓解临床症状和体征,提高治疗效果。究其原因可能与LC具有以下机制有关:①可运载长链脂肪酸和脂酰辅酶A进入线粒体进行氧化反应,使心肌细胞能量代谢为正常的脂肪代谢;②加快脂肪代谢速率,为机体心肌活动提供充足能量;③可清除机体潜在的毒性脂肪酸代谢产物;④通过抑制炎性因子合成及释放,阻止钙离子超负荷,进而减少心肌细胞损伤,抑制心肌重构等。本研究显示治疗4周后与对照组同期相比,观察组心功能指标LVESD,LVEDD值均显著更低,LVEF更高,与赵翔宇等[15]结果相似,动物实验亦表明[16],LC能通过增加心肌组织能量供应,减轻并修复心肌损伤,促进心功能恢复。由此可见,LC联合AC用药方案在调节CHF病人心肌能量代谢,保证心肌供血供氧,改善心功能等方面优势更为突出。两组不良反应发生率均较低,与沙莎等[17]结果相似,CHF病人应用LC联合AC用药方案治疗的耐受性较高。
CRP是机体炎症反应时肝脏合成急性时相蛋白,组织损伤后可大量释放,是广泛应用的炎症反应标志物,能够减少心肌细胞供血并诱导激活凝血及形成血栓,可加速心肌损伤。IL- 6是由单核巨噬细胞合成并释放的炎性因子,可通过一氧化氮途径促使细胞凋亡,抑制心肌收缩力,进而导致心室重塑,在CHF的发生发展中占有重要作用,可作为心功能恶化的指标之一。TNF- α是由单核细胞、肥大细胞等生成的常见促炎因子,能够提高凝血因子活性,损伤血管内皮功能,促进心室重塑。有研究表明[18],血清TNF- α水平与CHF病人心衰程度及预后具有一定相关性。本研究结果显示,与对照组同期比较,观察组治疗4周后血清CRP、IL- 6、TNF- α水平均更低;说明LC联合AC用药在调节CHF病人炎症反应、保护心肌细胞等方面优势更突出。李葆华等[19]研究称LC可通过减轻心肌炎症反应,抑制心肌重塑,显著改善CHF病人心功能。据此提示通过降低机体炎性因子水平、减轻炎症反应可能是本研究加用LC治疗CHF增效的重要机制之一。
综上所述,LC联合AC治疗CHF更能有效改善病人心功能、缓解症状体征,疗效显著且安全可靠,可能与其显著下调病人血清中CRP,IL- 6,TNF- α水平有关,可作为CHF治疗的方案之一。但对于本联合用药方案的具体作用机制及远期疗效与安全性,仍需更多大样本、多中心、大规模的长期研究加以证实。
[1] Franz H,Milton P,Coats AJ,et al.NT- proBNP in severe chronic heart failure: rationale,design and preliminary results of the COPERNICUS NT- proBNP substudy[J].Eur J Heart Fail,2014,6(3):343- 350.
[2] Carvalho VO,Mezzani A.Aerobic exercise training intensity in patients with chronic heart failure: principles of assessment and prescription[J].Eur J Cardiovasc Prev Rehabil,2016,18(1):5- 14.
[3] 李雁.阿托伐他汀对慢性心力衰竭患者心功能的影响[J].安徽医学,2015,36(7):871- 873.
[4] Mao CY,Lu HB,Kong N,et al.Levocarnitine protects H9C2rat cardiomyocytes from H2O2- induced mitochondrial dysfunction and apoptosis[J].Int J Med Sci,2014,11(11):1107- 1115.
[5] 方玲,李冠兰,李云,等.贝那普利联合阿托伐他汀治疗慢性心力衰竭的临床疗效[J].现代生物医学进展,2017,17(11):2102- 2105.
[6] 中华医学会心血管病学分会.慢性心力衰竭诊断治疗指南[J].中华心血管病杂志,2007,35(12):1076- 1095.
[7] 郑筱萸.中药新药临床研究指导原则(试行)[M].北京:中国医药科技出版社,2002:88- 94.
[9] Gargiulo G,Testa G,Cacciatore F,et al.Moderate alcohol consumption predicts long- term mortality in elderly subjects with chronic heart failure[J].J Nutr Health Aging,2013,17(5):480- 485.
[10] 倪伟.曲美他嗪联合阿托伐他汀钙治疗慢性心力衰竭的临床疗效[J].心血管康复医学杂志,2016,25(6)607- 609.
[11] 杜锦权,周俊阁,孟志刚,等.阿托伐他汀联合曲美他嗪治疗对慢性心力衰竭患者心功能和细胞因子的影响[J].海南医学院学报,2015,21(5):621- 623.
[12] 余梅玫,孟令毅.左卡尼汀治疗慢性心力衰竭的疗效分析[J].安徽医药,2014,18(4):744- 745.
[13] 王鑫璐,陈亚丹,付秀娟.左卡尼汀治疗心力衰竭疗效的Meta分析[J].中国药房,2016,27(27):3818- 3821.
[14] 沈红枫,夏海江.左卡尼汀注射液联合阿托伐他汀钙片治疗慢性心力衰竭的临床研究[J].中国临床药理学杂志,2017,33(5):395- 397.
[15] 赵翔宇.左卡尼汀联合复合辅酶对重症慢性心力衰竭患者CRP、BNP水平及心功能的影响[J].现代医学,2016,44(11):1560- 1564.
[16] 王玲,张美丹,李若林,等.左卡尼汀对心力衰竭大鼠PPAR- α及三磷酸腺苷的影响[J].中国医药导报,2016,13(32):17- 20.
[17] 沙莎,胡威,欧阳定安,等.阿托伐他汀对慢性心力衰竭患者心功能的影响[J].中国心血管病研究,2014,12(11):1005- 1007.
[18] 王庆旭,周致远,李德才,等.米力农对老年心力衰竭心功能及血清hs- CRP、TNF- α、IL- 6水平的影响[J].陕西医学杂志,2017,46(5):602- 604.
[19] 李葆华,刘凌,肖纯,等.左卡尼汀口服液对慢性心力衰竭患者血清NT- proBNP、TNF- α、IL- 6、MMP- 9和心功能的影响[J].临床和实验医学杂志,2016,15(8):765- 768.
